小鼠MCAO总结
两种脑出血动物模型的制备和比较研究

两种脑出血动物模型的制备和比较研究魏纯纯;王培;缪朝玉【摘要】目的本研究制备两种脑出血动物模型:脑缺血后使用tPA诱导的出血转化模型(MCAO-HT)及胶原酶注射诱导的脑出血模型(clCH),并比较两种出血模型的异同及可能的优缺点.方法 MCAO-HT模型:栓线经颈内动脉入颅,堵塞大脑中动脉,构建线栓法大脑中动脉堵塞模型,堵塞后5h静脉注射组织型纤溶酶原激活剂(tPA,10mg/kg)制备脑缺血后出血转化模型;cICH模型:利用脑立体定位技术,直接向纹状体注射0.05U胶原酶Ⅳ,诱导脑出血模型.结果 MCAO-HT模型小鼠较MCAO模型小鼠,24h患侧半脑血红蛋白含量显著升高,MCAO-HT模型小鼠血-脑脊液屏障(BBB)通透性显著高于MCAO模型小鼠;cICH模型小鼠,较假手术组小鼠,24h神经功能损伤、脑水肿、出血量和炎性水平都有显著升高.结论 MCAO-HT 模型引起的出血为tPA诱导BBB通透性增加,导致的“渗血”,可能更适用于对血-脑脊液屏障及血管通透性的研究.而clCH模型引起的出血为胶原酶直接破坏小血管壁导致的“漏血”,可能更适用于出血诱导的水肿、炎性反应、细胞死亡和氧化应激的研究.【期刊名称】《医学研究杂志》【年(卷),期】2016(045)011【总页数】6页(P39-44)【关键词】脑缺血;出血转化;脑出血;动物模型【作者】魏纯纯;王培;缪朝玉【作者单位】200433 上海,中国人民解放军第二军医大学药理学教研室;200433 上海,中国人民解放军第二军医大学药理学教研室;200433 上海,中国人民解放军第二军医大学药理学教研室【正文语种】中文【中图分类】R96脑卒中是脑血液循环障碍引起的急性脑血管病,因为循环障碍的原因不同主要分为缺血性脑卒中和出血性脑卒中,也分别称为脑缺血和脑出血(intracerebral hemorrhage,ICH)。
缺血性脑卒中约占全部卒中的80%,是由各种原因引起的局部脑组织供血障碍,导致缺血缺氧性的脑组织病变坏死,进而造成一系列的神经功能损伤。
PE小动物活体成像在神经性疾病的应用
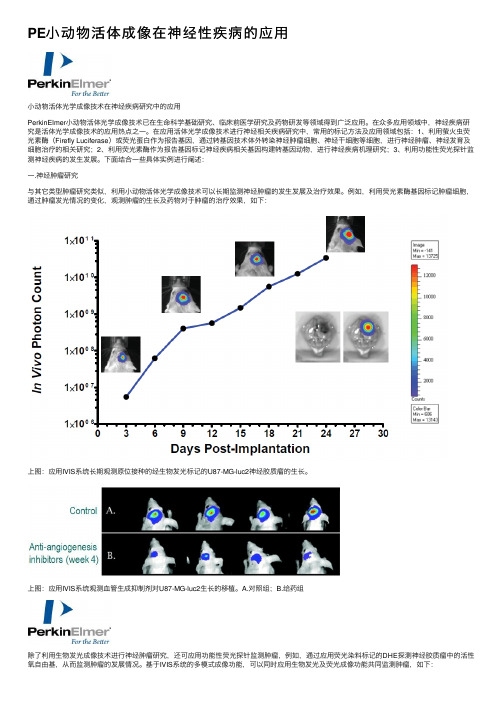
PE⼩动物活体成像在神经性疾病的应⽤⼩动物活体光学成像技术在神经疾病研究中的应⽤PerkinElmer⼩动物活体光学成像技术已在⽣命科学基础研究、临床前医学研究及药物研发等领域得到⼴泛应⽤。
在众多应⽤领域中,神经疾病研究是活体光学成像技术的应⽤热点之⼀。
在应⽤活体光学成像技术进⾏神经相关疾病研究中,常⽤的标记⽅法及应⽤领域包括:1、利⽤萤⽕⾍荧光素酶(Firefly Luciferase)或荧光蛋⽩作为报告基因,通过转基因技术体外转染神经肿瘤细胞、神经⼲细胞等细胞,进⾏神经肿瘤、神经发育及细胞治疗的相关研究;2、利⽤荧光素酶作为报告基因标记神经疾病相关基因构建转基因动物,进⾏神经疾病机理研究;3、利⽤功能性荧光探针监测神经疾病的发⽣发展。
下⾯结合⼀些具体实例进⾏阐述:⼀.神经肿瘤研究与其它类型肿瘤研究类似,利⽤⼩动物活体光学成像技术可以长期监测神经肿瘤的发⽣发展及治疗效果。
例如,利⽤荧光素酶基因标记肿瘤细胞,通过肿瘤发光情况的变化,观测肿瘤的⽣长及药物对于肿瘤的治疗效果,如下:上图:应⽤IVIS系统长期观测原位接种的经⽣物发光标记的U87-MG-luc2神经胶质瘤的⽣长。
上图:应⽤IVIS系统观测⾎管⽣成抑制剂对U87-MG-luc2⽣长的移植。
A.对照组;B.给药组除了利⽤⽣物发光成像技术进⾏神经肿瘤研究,还可应⽤功能性荧光探针监测肿瘤,例如,通过应⽤荧光染料标记的DHE探测神经胶质瘤中的活性氧⾃由基,从⽽监测肿瘤的发展情况。
基于IVIS系统的多模式成像功能,可以同时应⽤⽣物发光及荧光成像功能共同监测肿瘤,如下:上图:左.应⽤荧光成像技术观测尾静脉注射DHE后观测DHE对肿瘤的靶向;中.应⽤⽣物发光成像技术观测经荧光素酶基因标记的肿瘤;右.荧光与⽣物发光成像结果融合。
⼆.神经退⾏性疾病的研究神经退⾏性疾病是由神经元或其髓鞘的丧失所致,随着时间的推移⽽恶化,以导致功能障碍。
常见的神经退⾏性疾病包括阿兹海默症、帕⾦森⽒病、多发性硬化症、脊髓性肌萎缩症等。
线栓法大鼠脑缺血再灌注模型(MCAO)制备方法pdf

线栓法大鼠脑缺血再灌注模型制备前言相信不少神经内科的研究生都作过或将要作大鼠线栓模型,都有一个从查文献了解方法到跟师兄、师姐学习再到自己体会摸索直至熟练的过程,在模型制作的过程中可能的经历了从模型不成功的郁闷到熟练后成功的喜悦(我们是有这样的感觉)。
为了缩短各位将要作或刚开始作MCAO模型的战友的摸索过程,提高模型制作的成功率,我们愿意将自己的经验与大家分享,相信各位战友看过后将对制作大鼠线栓模型有更深的认识,并以其为乐趣,同时欢迎各位熟练的战友与我们交流经验。
第一部分线栓模型制备理论及经验⒈ 插线法局灶性脑缺血模型简介八十年代 Koizumi 和 Longa 创用了不开颅的大鼠 MCA 可逆性脑梗塞模型,此后,应用插线法制备大鼠局灶性脑缺血再灌注模型的方法不断改进和完善,已渐趋成熟,目前该法已逐渐取代开颅法而成为最流行的方法。
该模型先阻断颈外动脉(ECA)及其分支,且阻断翼腭动脉(PPA),以切断颅外来源的侧副循环血流。
从 ECA 插入尼龙线,经颈内动脉(ICA)到大脑前动脉(ACA),机械性阻断大脑中动脉(MCA)发出处的血供来建立大脑中动脉缺血模型。
此模型可在无麻醉状态下拔出尼龙线,恢复血流,实现再灌注。
1994 年 Huang 等[55]首次将线栓技术应用于小鼠局部永久性脑缺血模型。
1997 年 Hara等[56]将线栓技术改进后应用于小鼠局部暂时性脑缺血模型。
此后不断有学者借助于显微技术和多功能生理监测手段建立小鼠局部线栓脑缺血模型[57,58]。
国内蒋晓帆等[59],王芙蓉等[60]也对该方法进行了研究。
线栓法具有不开颅、效果肯定、可准确控制缺血及再灌注时间的优点,用于研究神经元对缺血的敏感性、耐受性,药物疗效观察以及再灌注损害和治疗时间窗较为理想,同时也具有对全身影响小、动物存活时间长的特点,适于慢性脑损伤的研究。
控制好易变因素,可避免实验结果的不稳定性。
但线栓造模也并非完美无缺,存在着下列不足:①线栓造模过程是非直视下的手术,血流是否完全阻断不能即刻得知。
脑梗死治疗中的新视角

·综述·脑梗死是脑卒中最常见的一种类型,发病率及致残率高。
脑梗死的防治一直是研究的热点。
脑组织缺血后,脑细胞代谢障碍导致凝固、变性或沉淀的蛋白质增多并积累,加重细胞应激性损害并加速细胞死亡[1]。
热休克蛋白(heat shock proteins ,HSPs )可作为缺血相关的应激蛋白在脑组织缺血后被诱导激活,在脑损伤中起到重要作用,依据其分子量的大小可分为6个家族,依次为HSP100、HSP90、HSP70、HSP60、HSP40及小HSPs 家族[2]。
HSPs 作为分子伴侣可协助蛋白质的正确折叠、防止受损蛋白质的聚集,促使错误折叠的蛋白质降解等[3]。
研究指出HSPs 在脑梗死的损伤中起重要作用,靶向某些HSPs 可能对缺血性损伤的脑组织起保护作用。
因此,本文将与脑梗死相关的HSPs 的最新文献进行综述,为后续开展以HSPs 为靶点药物的研发及相关药物的临床转化提供理论依据,为脑梗死的治疗提供新的思路。
1HSP90与脑梗死HSP90是一种高度保守的同源二聚体蛋白,在人体内含量丰富,在维持细胞结构和功能稳定中起重要作用。
神经元缺血缺氧后HSP90含量明显升高,靶向抑制该蛋白可通过多方面发挥抗缺血性卒中的作用[4,5]。
Serwetnyk 等[6]研究显示,脑组织缺血缺氧后HSP90含量增多并可正向调控缺氧诱导因子-1α通路,损坏血脑屏障的完整性。
Zhang 等[7]发现HSP90在脑梗死患者血清中升高并与破坏血脑屏障完整性的基质金属蛋白酶(matrix metalloprote-inase ,MMP )9呈正相关,在大脑中动脉闭塞(middle cerebral artery occlusion ,MCAO )模型小鼠中使用HSP90的抑制剂阿螺旋霉素可降低经典炎症因子核因子κB (nuclear factor of κB ,NF-κB )和MMP9的活性,使梗死面积缩小,神经功能得到明显改善。
缺血性脑血管病后小胶质细胞极化的研究进展

缺血性脑血管病后小胶质细胞极化的研究进展温少红;吴迪;刘向荣;吉训明【期刊名称】《中国脑血管病杂志》【年(卷),期】2017(014)003【总页数】5页(P159-163)【关键词】脑缺血;小胶质细胞;极化;综述【作者】温少红;吴迪;刘向荣;吉训明【作者单位】100053 北京,首都医科大学宣武医院中美神经科学研究所;100053北京,首都医科大学宣武医院脑血管病研究室;100053 北京,首都医科大学宣武医院中美神经科学研究所;100053 北京,首都医科大学宣武医院中美神经科学研究所;100053 北京,首都医科大学宣武医院脑血管病研究室;100053 北京,首都医科大学宣武医院神经外科【正文语种】中文脑血管病是一类严重威胁到人类健康与生命安全的重大疾病,目前已经成为全球第三大致死原因[1]。
我国是脑血管病发病与死亡的高发区域,发病率排名世界第一,每年大约有50万人死于脑血管病,其中缺血性脑血管病占脑血管病80%左右。
研究显示,炎性反应是缺血性脑血管病的重要病理生理学基础,脑内炎性反应的第一步即是小胶质细胞的激活与极化,进而启动效应分子和其他免疫细胞的释放[2]。
脑缺血后,小胶质细胞的不同极化表型可以发挥促炎或抗炎、神经保护等不同作用。
笔者对小胶质细胞的极化及其在缺血性脑血管病中的作用与机制进行综述如下。
小胶质细胞是脑内固有的免疫细胞,具有营养、保护和修复神经细胞的作用,其也是中枢神经系统抵御各类损伤的第一道防线,与许多神经退行性疾病和脑内炎性疾病的发病机制有着密切联系[3]。
目前关于小胶质细胞的来源存在争议,近年来学者们相继提出了一系列假说,如小胶质细胞来源于循环单核细胞或前体细胞、血液单核细胞、中胚层祖细胞、脑膜巨噬细胞等[4-6]。
尽管如此,学者们普遍认为,小胶质细胞来源于骨髓细胞[7]。
小胶质细胞在脑内分布具有明显差异性,在海马、嗅球、基底节、黑质、端脑内分布最多,在脑干和小脑分布最少[8]。
ERK调节的神经元凋亡作用脑缺血神经元凋亡机制的新观

ERK调节的神经元凋亡作用—脑缺血神经元凋亡机制的新观点曹阳广州市红十字会医院麻醉科510220通常认为,细胞外信号调节激酶(ERK1和ERK2,缩写为ERK1/2)在有丝分裂原激活蛋白酶(MAPKs)家族中属于促进细胞存活类因子,发挥调节增殖和分化的作用(Oncogene.2004;23:2838–2849; Science.2002;298: 1911–1912)。
然而德国海德堡大学神经科学研究中心的Subramaniam和他的同事(J.Cell Biol. 2004;165, 357–369)最新研究结果表明,在钾离子外流诱导下,ERK1/2也可以发挥促进神经元凋亡的重要作用(proapoptosis)。
该研究提出了一个由ERK1/2介导的神经元死亡的新观点。
同时也进一步开启了通过调控ERK1/2活性进而调节缺血后神经元的存活的可能机制。
我们前期的研究工作也发现了一些类似的证据,在我们的缺血再灌注脑损伤研究中,抑制ERK1/2的活性,产生了抑制神经元凋亡的作用,提示ERK1/2在某些特定的条件下,可以发挥促凋亡因子的作用,即并非传统意义上的单纯促进存活因子。
我们比较了小鼠中脑动脉梗塞模型(MCAO)中ERK1/2的活性以及炎症因子IL-1β、TNFα、MCP-1的表达变化,探讨脑缺血损伤对ERK1/2活性变化和炎症因子表达的影响;进而我们观察应用ERK1/2抑制剂(U0126)预处理对小鼠MCAO后IL-1β、TNFα、MCP-1表达的变化,观察MAKP通路ERK1/2水平的抑制是否影响脑损伤所致炎症反应的影响;上述试验也证实,在试验条件下,脑损伤后ERK1/2的激活和炎症因子的表达相关联,而抑制了ERK1/2的活性可以控制炎症因子的产生进而是抑制神经元的过度凋亡。
许多研究也报道,脑缺血后MAPKs被激活,在小鼠脑MCAO后磷酸化的ERK1/2,P38MAPK,JUN的表达增加,并且伴随炎症因子IL-1β的增加,抑制ERK1/2通路可以抑制炎症因子的表达,用PD98059抑制MEK的激活减少了小鼠局灶性脑缺血后的梗塞体积和减轻神经损害的程度,从而改善病理性损害的程度(Brain Res.2004;16,996(1):55-66;Chin Med Sci J.2004 Dec;19(4):270-5;Chin Med J (Engl). 2003;116(10):1497-503)。
局灶性脑缺血小鼠皮层HSP60、HSP70表达的时序性变化

脑缺血可导致严重的迟发性神经元损伤,影响患者的愈后 和功能的恢复。缺血缺氧后早期脑中蛋白质合成普遍降低,在 某些神经元内出现多种基因的诱导表达。热休克蛋白( HSP) 是一类在生物 进 化 过 程 中 极 为 保 守 的 蛋 白 质,广 泛 存 在 于 原 核、真核细胞中,当机体受到各种有害刺激( 如缺血、高渗、肿瘤 发生等) ,胞内 HSP 合成增多〔1〕。HSP 在缺血缺氧性脑损伤过 程中的 特 殊 改 变,使 其 成 为 该 方 面 的 研 究 热 点 之 一。其 中 HSP70、HSP60 分布相当广泛,应激后生成最为显著,是主要的 应激蛋白,本实验利用大脑中动脉阻塞( MCAO) 小鼠局部脑缺 血模型,观察局灶性脑缺血不同时间点 HSP70、HSP60 在小鼠 皮层缺血核心区和半影区表达的时序性变化。
Sequential changes of HSP60 and HSP70 expressions in mice with focal cerebral ischemia JIANG Shu-Jun,DIAO Hui-Ling,MA Zhong-Nü. Department of Physiology,Binzhou Medical University,Yantai 264003,Shandong,China
【Abstract】 Objective To investigate sequential changes of HSP60 and HSP70 expression at 1,2,3 h in the ischemic core and the penumbra of cortex in theቤተ መጻሕፍቲ ባይዱmice with focal cerebral ischemia. Methods Focal cerebral ischemia was induced by middle cerebral artery occlusion in mice,healthy male BALB / c mice weighted 18 ~ 20 g were randomly divided into 4 groups: sham,ischemia 1 h,ischemia 2 h,ischemia 3 h groups. Western blot combined with Gel Doc imagine systems were applied to examine the changes in HSP60 and HSP70 protein expression levels in the cerebral of mice. Results Protein expression levels of HSP60 and HSP70 in the ischemic core and penumbra were increased significantly in response to the repetitive of ischemia time when compared with sham group ( P < 0. 05,n = 6 for each group) . Protein expression level of HSP60 showed a continous increasing trend with the ischemia time,while that of HSP70 was increased at 1 hour point, reached climax at 2 hour point,but decreased at 3 hour point. Conclusions HSP60 and HSP70 are the sensitive markers for nerve injury, and focal cerebral ischemia can result in the sequential changes of HSP60 and HSP70 expression,which provides evidence for the recognition and protection of focal cerebral ischemia.
人参二醇组皂苷20(s)对大脑中动脉梗死老年小鼠MAPK蛋白表达的影响

人参二醇组皂苷20(s )对大脑中动脉梗死老年小鼠MAPK 蛋白表达的影响张颖纪莉张馨木1鲍爽王赞陈海燕(吉林大学第一医院,吉林长春130021)〔摘要〕目的探讨人参二醇组皂苷(PDS )20(s )对大脑中动脉梗塞(MCAO )老年小鼠p-erk1/2、p-JNK2、P-38蛋白表达的影响及其机制。
方法C57BL /6老年小鼠40只,制备老年小鼠MCAO 模型,随机分为4组:90min MCAO 组、PDS 小剂量组、PDS 中剂量组、PDS 大剂量组,应用激光多普勒血流仪进行术中脑血流监测,应用Western 印迹方法观察各组p-erk1/2、p-JNK2、P-38蛋白表达的变化。
结果与90min MCAO 组比较,中、大剂量PDS 组p-erk1/2、p-JNK2蛋白表达明显增高,P-38蛋白表达无变化。
结论PDS 促进MCAO 老年小鼠脑p-erk1/2、p-JNK2蛋白表达早期明显升高。
〔关键词〕大脑中动脉梗塞;老年小鼠;p-erk1/2;p-JNK2;P-38〔中图分类号〕R743.3〔文献标识码〕A〔文章编号〕1005-9202(2012)08-1649-02;doi :10.3969/j.issn.1005-9202.2012.08.045基金项目:长春市科技局国际合作基金(No.2008145)1吉林大学药学院通讯作者:王赞(1969-),女,副教授,硕士生导师,主要从事脑血管病、睡眠及癫痫的研究。
陈海燕(1965-),女,副教授,主要从事老年心脑血管病研究。
第一作者:张颖(1977-),女,主治医师,主要从事帕金森及脑血管病研究。
传统中医认为人参的功能主治为益气活血,通络止痛,可以改善脑血液循环,改善神经行为学,保护缺血脑组织,改善患者半身不遂或偏身麻木、口角偏斜、言语不利等症状,具有很好的临床疗效〔1〕;但其缩小梗死面积、脑保护的具体机制,尤其是脑保护的信号传导机制尚不十分清楚。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠MCAO模型 一、实验器材: 1. 手术器械:眼科剪1、显微剪1、钩镊1、直镊1、显微镊2、止血钳1、持针器1、缝合线(2-0/5-0)、缝合针、 麻醉剂:10%水合氯醛(350mg/kg) 2. 栓线:0.18mm(20~25g)、0。20mm (25~30g) ;在栓线10mm的位置用黑色记号笔标记;75%酒精清洁后置1: 2500单位肝素化生理盐水中备用。 3. 其他用品:酒精棉球、75%酒精、生理盐水、注射器(1ml、2ml)、黑色记号笔、固定鼠用粗线绳、鼠板 二、步骤:Zea Longa 线栓法 1.麻醉:10%水合氯醛腹腔注射 (350mg/kg) 2.术前准备:仰卧位固定大鼠,备皮消毒 3。分离血管及挂线: 1) 自胸骨柄到下颌骨间取长约1cm 正中切口。见下颌下腺,将其分离至两侧; 2) 见右侧肩胛舌骨肌、胸骨舌骨肌、二腹肌形成的三角区,镜下分离此三角区内,暴露右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA); 3) 首先分离CCA于其上挂线1; 4) 随后向头侧分离ECA血管及其分支,于ECA上头尾侧分别挂线2、3; 5) 然后清除CCA分叉部脂肪,观察ECA分支与ICA关系,分离ICA及ECA分支,于其上挂线4; 6) 注意操作轻柔避免迷走神经、舌咽神经、气管损伤,避免过度牵拉血管使其严重移位或断裂。 5.结扎:死结:线1、2;活结:线4;不系结:线3 6。剪口插入: 1) 将鼠台逆时针旋转90°,在ECA上距分叉1~1.5mm用显微剪剪一切口; 2) 将标记好的线栓由此切口插入CCA 中; 3) 将鼠台转回,将线栓从CCA拔出至分叉稍尾侧,右手将线栓转向滑入ICA,右手拉开线4活结,后继续插入ICA,待有阻力时再进入少许,深度1cm+,到达大脑中动脉与前交通之间; 4) 顺利插入后将丝线4扎紧,抽出线3减去多余线头。 6.缝皮 7.术后:小鼠俯卧位,头略抬高,至于温湿度适宜环境。 三、注意事项: 1. 雌性鼠对于牵拉等操作的反应更强烈, 故建议选择雄性大鼠作为实验对象。 2. 大鼠解剖学变异:一般而言,Fisher—344大鼠MCA解剖变异较小,闭塞后形成的梗死体积一致性好;Wistar-Kyoto 大鼠变异相对最大; 而Sprague—Dawley大鼠介于两者之间. 3. 麻醉:10%水合氯醛腹腔注射(30ml/kg), 一般可持续1~1。5h。如按标准体重计算的麻醉剂量效果欠佳, 可使用总量的10%进行追加。需注意反复多次或过量追加易造成动物死亡, 或导致清醒推迟而影响再灌注前评分, 从而使再灌注时间不能统一界定在2h.水合氯醛可使动物呼吸频率下降50%左右,但一般不会导致动物窒息而死亡.术中严密观察动物呼吸频率、 深度及有无痰鸣音等。 4. 分离气管前肌肉时注意保护好甲状腺和甲状旁腺。甲状腺呈鲜红色, 紧密贴在气管前壁上, 甲状旁腺位于甲状腺外上方, 颜色略淡。血管分离要到位, 使用电凝器可明显减少小血管的出血, 从而保证手术野清晰, 尤其是肌肉内部的血管和 ECA 的一些细小分支, 未 明确时不可随意离断。结扎血管时要注意力度和方向, 由于血管被膜被分离后血管表面相当光滑, 结扎不牢可能导致难以控制的出血;术中还要注意保护与血管紧密相依的神经, 注意观察神经的颜色、 反光性和轻触时的感觉, 切勿损伤或离断。牵拉迷走神经时可见动物呼吸明显减慢甚至血液呈深紫色, 出现肢体末端紫绀。在无法给予辅助通气时, 应暂停操作.一般来说, 动物呼吸可恢复到麻醉后的平稳状态, 血液颜色也可恢复到正常, 这时再继续手术较为安全。 5. 关于是否结扎 PPA 文献报道尚不一致.可沿ICA一直分离至看到其入颅分支与PPA分叉处,观察线栓走行状况, 若顺利将长度约1cm的线栓插入, 则可固定线栓而无需对 PPA进行操作; 如只进入5mm左右即遇到明显阻力, 则线栓进入PPA的可能性很大, 此时可将线栓撤离至ECA/ICA处, 提起PPA, 以帮助线栓沿ICA进入颅内而最终阻塞MCA。 6. Koizumi等1986年首次报道不开颅经CCA插入尼龙线栓致MCA闭塞;之后,Longa等进行了改良,将栓线从ECA插入, 再灌注时将栓线抽回ECA内, 通过CCA实现再灌注。Koizumi使用的丝线末段均匀包被硅胶, 直径增加近30~40%, 插入后不仅可伸入大脑前动脉ACA) 近端, 肯定阻塞ACA及前交通动脉, 而且阻塞MCA及后交通动脉开口处, 彻底阻塞MCA及其所有侧枝供应血管, 形成供应区域完全缺血, 因此局部梗死面积大, 均匀一致, 各动物间差异较小.Longa使用的4-0尼龙线末端球形扩大, 但并非直接闭塞MCA, 而是依靠结扎同侧ICA和其球形扩大的末端伸入ACA腔内、 阻断经前交通动脉来自对侧ACA的血流形成局灶性脑缺血, 但不能阻断来自后交动脉的侧枝供应, 且丝线末端伸入ACA腔内位置不同, 所起作用差异很大, 因此形成的梗死面积很小, 各动物之间差异较大。宋红松等建议采用Koizumi方法. 丁香园: 1. 注意尽量不要损伤在颈内颈外分叉下的交感神经节。 2. 栓线进入后颈内动脉后即可逐渐插入了,有时候很顺利一插到底,但有时候在中间就怎么也进不去了,这是因为在血管入颅穿过颅骨时有一个狭窄或者角度。因此,碰上这种明显阻力时,一定不能盲目向前使力插,越插栓线前端变形越进不去且容易损伤血管.这时候正确的作法是往外抽出较多栓线,也许会有一定的动脉血流出,不必慌,只要顺着血管走行调整一下进线角度轻柔的使劲,一般都能进去,反复试几次还不行最好换根栓线,很可能前端也经变形角度变了!颈内动脉的走向为内上方,可以用眼科镊夹住鱼线插,但进去后要注意,别太用力,要不血管就要破了 3. 栓线不能在血管里反复进退,否则及容易造成蛛网膜下腔出血,而且很容易误解为模型成功,因为这时的神经功能改变也很明显,但并不是由于栓塞引起的 4. 大鼠仰卧时,ICA从CCA分出后下行(向背侧)约5mm又分为两支A,即走向乳突泡(Mastoid bulla)的 翼腭A和进入颅内的ICA的延伸部分。因为翼腭A的走向几乎和分支前的ICA走向相同,而ICA的延伸部分则是改向头侧走行,所以插线时会很自然的进入翼腭A。进线时,用镊子将ICA轻轻往头侧推一下,使ICA和其延长的分支成一直线,同时顺势插线,可很容易的进入颅内。或使栓线有一定程度的弯曲,且只要保证栓线向屋顶方向弯曲,一般都能将线插如颅内,决不会进入翼腭A。 5. 注意手的感觉,轻缓推进,直至感觉到阻力为止(当遇到阻力后,再插线会见到线弯曲)。可能有人会说,把血管插破了也未感觉到阻力或线遇阻后的弯曲。一个原因是线太硬,另一主要原因是当栓线从血管切口插入后为防止血液从此处流出,需要结扎一条细线,这条线结扎的松紧程度很关键,应在不流血的情况下尽可能的松,这样你会发现进线时很轻松,一旦遇到阻力,就会感觉到。后者至关重要,请体会. 6. 栓线一旦进入ACA,就要把上面提到的那根细线适度扎紧(“适度”很重要,会影响到再灌 流时大鼠的生死存亡),此时的关键是动作轻柔,不要使ICA有任何的牵拉,否则栓线会脱出ACA,可能会造成缺血失败.血管外的栓线不要留得过长,更不要缝在皮外,大鼠醒来后会自己拔出。 7. 如果你用的是中长效麻醉剂,插线成功后,固定丝线,然后让其俯卧位,而且稍稍抬高其颈部,才能确保模型成功. 8. 术后一定要注意保暖。 9. 插入线拴要轻柔熟练,速度尽可能快,以避免时间长了血管内血栓形成. 10. 手术后评分的主观因素很大,有用5分制和11分制的,我个人认为用5分制比较准些。 11. 大鼠大脑中动脉永久性闭塞性脑缺血模型,梗死体积出现的最小时间点可能为2h,体积随时间进行性增大,至12h基本趋于稳定 12. 整个试验是很费动物的,存在15—30%的淘汰率(如果你做的好),但注意严格控制自己淘汰的动物(纪录具体情况)。 13. 除了刚才说的蛛网膜下腔出血外,还有一些老鼠肺出血明显,整个肺暗红,我也想不出原因,不知道是不是医学临床所说的脑肺综合症. 14. 术后处理:由于术后动物尚未清醒,因此护理也很重要.但为保证栓线成功,达到预期的阻塞时间,防止栓线脱落暂时把动物留在手术台上,保证动物不会因挣扎而把栓线过早脱落,但仍需监测体温,并注意保暖.再灌注后动物可放入笼中。另外笼中应保持干燥,没有积水及粉尘,防止动物误吸而窒息。我们在实验中发现一些模型症状不典型甚至没有症状,都是由于动物苏醒后极力挣扎使栓线过早脱落所致。手术后大鼠存活期可以满足通常的实验需求,一般来讲,随着栓塞和再灌注损伤时间的延长,死亡率会上升。大鼠在术后24~48小时最容易死亡,这种死亡是严重脑缺血损伤造成的,较直接的因素是脑水肿。用线栓制作持续性局灶性脑缺血模型时,术后要肌注庆大霉素预防感染;如果动物模型要生存1周以上,必要肌注速尿,防止因脑水肿动物在短期内死亡。术后饮水中加入葡萄糖,保证动物术后有充足的能量生存到实验要求的时间. 舍去标准: ⑴栓线插入深度不足18 mm,且无明显神经功能缺损表现或症状很轻的大鼠 ⑵ 蛛网膜下腔出血、MCA起始部或其附近的willis环动脉有凝血块的大鼠,因为这是出血性脑损伤或永久性脑缺血损伤,而非MCAO/Reperfusion损伤。 3)手术时出血较多,症状很重的动物. 死亡原因分析: 首先要找出死亡原因,解剖死亡大鼠的脑,先看是否有蛛网膜下腔出血,如有出血,表明死因是插线太深,以后注意插线深度;如无出血,则还要再看是否有严重的半球水肿,如水肿严重,则表明死因是脑缺血时间太重,需要缩短缺血时间;如既无出血,又无明显的脑水肿,那就要注意动物状态或生活环境是否太差.
