上海师范大学标准试卷化学 (6)
上海师范学校2021-2022学年高一化学期末试题含解析

上海师范学校2021-2022学年高一化学期末试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 质量相同的两种气体A、B,在同温、同压下,A的分子数比B多。
下列说法正确的( )A.A占的体积比B小 B.A的摩尔质量比B大C.A的密度比B小 D.A的物质的量比B小参考答案:C略2. 下列分子中14个碳原子不可能处于同一平面上的分子是()A. B. C. D.参考答案:CA、该分子结构可以看作是相邻的两个苯环共用两个碳原子形成的,所以所有的碳原子都处在同一平面上14个碳原子处于同一平面上,错误;B、苯环上所有原子共面,所以两个苯环形成的结构中12个碳原子共面,甲基上碳原子连接苯环,甲基和苯环上碳原子共面,所以该分子中14个碳原子可能共面,错误;C、该分子结构可以看作是两个苯环共用两个碳原子形成的,每个苯环上的碳原子一定共面,但是甲基碳原子以及甲基相连的碳原子是烷烃的结构,一定不会共面,该分子中的所有碳原子不可能都处在同一平面上,正确;D、该分子结构可以看作是两个苯环共用两个碳原子形成的,每个苯环上的碳原子一定共面,亚甲基上碳原子连接苯环,亚甲基和甲基中两个碳原子可以共面,亚甲基和苯环上碳原子共面,所以该分子中所有碳原子可能共面,错误;故选C。
点睛:本题考查碳原子共面问题。
解答这种题型应联想到已学过典型有机化合物的空间构型,甲烷是正四面体,乙烯、苯是平面型分子,乙炔是直线型分子。
3. 胶体和其它分散系的本质区别是()A.分散质粒子的大小B.是不是一种稳定的体系C.会不会产生丁达尔效应D.粒子有没有带电荷参考答案:A考点:胶体的重要性质.专题:溶液和胶体专题.分析:胶体分散系与其它分散系的本质差别是分散质直径的大小不同.解答:解:胶体区别于其它分散系的本质特征是胶体粒子直径在1﹣100nm之间,溶液的分散质粒子直径小于1nm,浊液的分散质粒子直径大于100nm.故选A.点评:本题考查胶体的判断,注意胶体区别于其它分散系的本质特征是胶体粒子直径在1﹣100nm之间.4. 下列关于物质结构和化学用语的说法正确的是( )A. 78gNa2O2晶体中所含阴、阳离子的物质的量均为2 molB. 1个乙烯分子中存在6对共用电子对C. NaOH和Na2O中所含的化学键类型完全相同D. PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构参考答案:B5. 下列溶液中Cl-浓度最大的是A、200mL 2mol/L MgCl2溶液B、1000mL 2.5mol/L NaCl溶液C、300mL 5mol/L KClO3溶液D、250mL 1mol/L AlCl3溶液参考答案:A略6. 已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量下列叙述正确的是()A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/molC.氢气和氯气反应生成2mol氯化氢气体,反应的△H=﹣183kJ/molD.氢气和氯气反应生成1mol氯化氢气体,反应的△H=﹣183kJ/mol参考答案:C【考点】化学反应中能量转化的原因;有关反应热的计算.【分析】A.热化学方程式应标出反应热;B.根据反应热等于反应物的总键能﹣生成物的总键能来解答;C.根据反应热等于反应物的总键能﹣生成物的总键能来解答;D.反应中的热量与反应物的物质的量成正比.【解答】解:A.热化学方程式应标出反应热的数值,故A错误;B.H2(g)+Cl2(g)=2HCl(g)的反应热=反应物的总键能﹣生成物的总键能=436kJ?mol﹣1+243kJ?mol﹣1﹣2×431 kJ?mol﹣1=﹣183kJ?mol﹣1,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=﹣183kJ/mol,故B错误;C.反应热=反应物的总键能﹣生成物的总键能=436kJ?mol﹣1+243kJ?mol﹣1﹣2×431 kJ?mol﹣1=﹣183kJ?mol﹣1,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=﹣183kJ/mol,故C正确;D.当生成1mol氯化氢气体时,放出的热量是原来的一半,△H=﹣91.5kJ/mol,故D错误.故选C.7. 下列物质中,碱性最强的是A.NaOH B.Mg(OH)2 C.Al(OH)3 D.KOH参考答案:D钾的金属性最强,KOH碱性最强,答案选D。
2020-2021学年上海师范学校高三化学模拟试卷含解析

2020-2021学年上海师范学校高三化学模拟试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 已知短周期元素的四种离子:a A2+、b B+、c C3-、d D—都具有相同的电子层结构,则下列叙述中正确的是A.原子序数d>c>b>aB.单质的还原性D<C<B<AC.离子半径C3->D—> B+>A2+D.A、B、C最高价氧化物对应水化物溶液(等物质的燕浓度)的pH值C>B>A参考答案:C略2. 下列说法错误的是A.在晶体中只要有阴离子就一定有阳离子B.金属晶体通常具有导电、导热和良好的延展性C.原子晶体中只存在非极性共价键D.离子晶体在熔化状态下能导电参考答案:C3. 能在水溶液中大量共存的一组离子是A. H+、I―、NO3―、SiO32-B. Ag+、Fe3+、Cl―、SO42―C.K+、SO42-、Cu2+、NO3―D.NH4+、OH-、Cl-、HCO3-参考答案:C4. 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:CH2=CH2(g) + H2O(g) CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。
下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是()A.合成乙醇的反应一定为吸热反应B.目前工业上采用250~300℃,主要是在此温度下乙烯的转化率最大C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率D.相同催化剂下,在300℃ 14.7MPa乙醇产率反而比300℃ 7MPa低得多,是因为加压平衡向逆反应方向移动参考答案:C5. 在进行中和滴定时使用的仪器中,事先不能用所盛溶液润洗且内壁上附着水珠也不影响实验结果的是()A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.胶头滴管参考答案:C略6.参考答案:答案:C7. 下列所得溶液的物质的量浓度等于0.1 mol·L-1的是A.将0.1 mol氨充分溶解在1 L水中B.将10 g质量分数为98%的硫酸与990 g水混合C.将8 g三氧化硫溶于水并配成1 L溶液D.将0.1 mol氧化钠溶于水并配成1 L溶液参考答案:C根据溶液中溶质的物质的量浓度等于溶质的物质的量除以溶液的体积;A、溶液的体积不是1 L,故A 错误;B、只能计算稀释后硫酸的质量分数,故B错误;C、8 g三氧化硫溶于水得到1摩尔硫酸,配成1 L溶液溶质的物质的量浓度等于0.1 mol·L-1,故C正确;D、根据钠元素守恒,0.1 mol氧化钠溶于水得0.2摩尔NaOH,配成1 L溶液得溶质的物质的量浓度等于0.12mol·L-1,故D错误。
上海上海师范大学康城实验学校高中化学必修二第六章《化学反应与能量》经典测试卷(答案解析)

一、选择题1.可逆反应3H 2+N 2高温、高压催化剂2NH 3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是 A .v 正(N 2)=v 正(H 2) B .v 正(N 2)=v 逆(NH 3) C .2v 正(H 2)=3v 逆(NH 3) D .v 正(N 2)=3v 逆(H 2) 答案:C 【分析】因化学反应达到平衡时,正、逆反应速率相等(同种物质)或正、逆反应速率之比等于化学计量数之比(不同物质)。
【详解】A .无论该反应是否达到平衡状态都有()()223v N v H =正正,而()()22v N v H =正正不能说明正、逆反应速率相等,则不能说明反应达平衡状态,A 错误;B .反应达到平衡状态时,()2v N :正()3v NH 1:2=逆,B 错误;C .反应达到平衡状态时,()()23v H :v NH 3:2=正逆,即()()232v H 3v NH =正逆,C 正确;D .反应达到平衡状态时,()()22v N :v H 1:3=正逆,即()()223v N v H =正逆,D 错误; 故选C 。
2.一定温度下,向容积为4L 的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对反应的推断合理的是A .该反应的化学方程式为3B+4C ⇌6A+3DB .反应进行到1s 时,υ(A)=υ(D)C .反应进行到6s 时,各物质的反应速率相等D .反应进行到6s 时,B 的平均反应速率为0.025mol ⋅(L ⋅s)−1 答案:D 【详解】A.由图可知,反应达到平衡时A物质增加了1.2mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质减小了0.8mol,所以A、D为生成物,物质的量之比为3:1,B、C为反应物,物质的量之比为3:4,B、C、A、D的变化量之比为3:4:6:2,故反应方程式为:3B+4C⇌6A+2D,故A错误;B.化学反应速率之比等于化学计量数之比,故反应到1s时,υ(A)=3υ(D),故B错误;C.根据3B+4C⇌5A+2D可知,反应中计量数不同,而化学反应速率与化学计量数成正比,所以各物质的反应速率不相同,故C错误;D.反应进行到6s时,B的物质的量为0.4mol,B的物质的量的变化量为0.6mol,容器容积为4L,所以反应进行到6s时,υ(B)=ΔcΔt=0.6mol4L6s=0.025mol⋅(L⋅s)−1,故D正确。
上海师范大学标准试卷 无机化学

上海师范大学标准试卷考试日期 年 月 日科目 无机化学我认真遵守《上海师范大学考场规则》,诚信考试.签名一、选择题 ( 共23题 46分 每题2分 )1. 核外主量子数n = 3的原子轨道共有…………………………………………………( )(A) 3个 (B) 5个 (C) 7个 (D) 9个2. 下列各含氧酸中,三元酸是 …………………………………………………………( )(A) H 3PO 4 (B) H 3PO 2 (C) H 3PO 3 (D) H 3BO 33. 反应的焓变可代表NaCl 晶格能的是…………………………………………………( )(A) Na(g) + Cl(g) = NaCl(s) (B) Na(g) +21Cl 2(g) = NaCl(s)(C) Na +(g) + Cl -(g) = NaCl(g) (D) Na +(g) + Cl -(g) =NaCl(s)4. 根据分子轨道中电子排布,下列分子的稳定性大小顺序为…………………………( )(A) O 2 >+2O >-2O >-22O (C)+2O >-2O >-22O > O 2(B)-22O >-2O >+2O > O 2 (D)+2O > O 2 >-2O >-22O 5. 下列物质中,是CO 的等电子体的是…………………………………………………( )(A) NO (B) O 2 (C) N 2 (D) NaH6. BF 3与NH 3 之间的结合力是…………………………………………………………( )(A) 分子间力 (B) 氢键 (C) π 键 (D) 配位键7. 下列各组元素中,电负性依次减小的是………………………………………………( )(A) K > Na > Li (B) O > Cl > H (C) As > P > H (D) 三组都对8. 下列各分子或离子中,最稳定的是……………………………………………………( )(A) N 2 (B)+2N (C)-2N (D)-22N9. 下列元素第一电离能大小顺序正确的是…………………………………………… ( )(A) B < C < N < O (B) N < O < B < C(C) B < C < O < N (D) C < B < O < N10. Pb2+离子的价电子层结构是…………………………………………………………()(A) 6s26p2(B) 5s25p2(C) 6s2(D) 5s25p65d106s211. 二氧化氮溶解在NaOH溶液中可得到:(D)(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O12. 对于H2O2和N2H4,下列叙述正确的是………………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用13. 有关H3PO4、H3PO3、H3PO2不正确的论述是…………………………………()(A) 氧化态分别是+5,+3,+1 (B) P原子是四面体几何构型的中心(C) 三种酸在水中的离解度相近(D) 都是三元酸14. 下列第三周期元素的离子中,半径最大的是…………………………………………()(A) Na+(B) Al3+(C) S2-(D) Cl-15. 下列各物质的摩尔质量近乎相等,其中沸点最高的可能是…………………………()(A) C2H5OC2H5(B) CH3CH2CH2SH(C) (CH3)2NC2H5(D) CH3CH2CH2CH2OH16. 下列化合物中可用于干燥氢气的是…………………………………………………()(A) CaCO3(B) Ca3(PO4)2(C) CaCl2(D) Ca(OH)217. 某晶体的晶轴长短和晶轴夹角有如下关系a=b =c,α= β= γ,则下列判断中正确的是……………………………………………………………………………………………()(A) 一定属于立方晶系(B) 一定属于三方晶系(C) 属于立方晶系或三方晶系(D) 属于正交晶系18. 下列各对含氧酸盐热稳定性的大小顺序,正确的是…………………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO319. CO32-的几何构型是…………………………………………………………………()(A) 平面三角形(B) 三角锥形(C) T形(D) 直线形20. 下列物质中,既有离子键又有共价键的是……………………………………………()NH(A) KCl (B) CO (C) Na2SO4(D)+421. 下列各组数字都是分别指原子的次外层、最外层电子数和元素的一种常见氧化态,最符合硫的情况的一组是……………………………………………………………………()(A) 2,6,-2 (B) 8,6,-2 (C) 18,6,+4 (D) 2,6,+622. 下列原子中半径最大的是……………………………………………………………()(A) Ba (B) Ca (C) Sr (D)Mg23. 下列化学键中,极性最弱的是…………………………………………………………()(A) H—F (B) H—O (C) O—F (D) C—F二、填空题( 共4题20分)24. 5 分比较下列各物质的性质:(1) BeCl2和CaCl2的沸点,前者______________后者;(2) NH3和PH3的碱性,前者______________后者;(3) NaOCl和NaClO3的氧化性,前者______________后者;(4) BaCrO4和CaCrO4在水中的溶解度,前者______________后者;(5) TlCl和TlCl3的水解度,前者______________后者。
沪教版化学初二上学期试卷与参考答案(2024年)

2024年沪教版化学初二上学期自测试卷(答案在后面)一、单项选择题(本大题有12小题,每小题3分,共36分)1、下列物质属于有机化合物的是:A、二氧化碳(CO₂)B、氢氧化钠(NaOH)C、甲烷(CH₄)D、硫酸(H₂SO₄)2、下列关于化学反应速率的说法正确的是:A、反应物浓度越高,反应速率越快B、温度越高,反应速率越慢C、反应物接触面积越大,反应速率越慢D、催化剂的加入会降低反应速率3、下列关于元素周期律的说法中,正确的是:A、元素周期表中,同一周期的元素,原子序数越大,金属性越强。
B、元素周期表中,同一族元素,原子序数越大,原子半径越小。
C、元素周期表中,同一周期的元素,原子序数越大,非金属性越弱。
D、元素周期表中,同一族元素,原子序数越大,金属性越弱。
4、下列物质中,不属于有机化合物的是:A、甲烷B、二氧化碳C、乙醇D、苯5、在下列物质中,属于酸的是()A、NaClB、H2OC、CO2D、HCl6、下列关于化学反应速率的说法中,正确的是()A、反应速率越快,反应时间就越短B、反应速率与反应物的浓度成正比C、温度越高,反应速率越快D、所有物质的反应速率都相同7、下列物质中,不属于酸碱盐的是()A、氯化钠B、氢氧化钠C、硫酸D、氧化钙8、下列溶液中,属于强酸的是()A、硫酸溶液B、醋酸溶液C、氢氧化钠溶液D、氢氧化钙溶液9、下列哪种物质属于纯净物?A. 空气B. 海水C. 氧化铁D. 矿泉水11、下列关于物质的描述,正确的是:A. 水分子由两个氢原子和一个氧原子构成B. 铁在空气中生锈是因为与氧气和水反应生成了氧化铁C. 盐酸是硫酸的水溶液D. 碘酒是碘的酒精溶液二、多项选择题(本大题有3小题,每小题3分,共9分)1、下列关于物质分类的说法正确的是:A. 纯净物一定只由一种元素组成B. 氧化物都是化合物C. 含有氧元素的化合物一定是氧化物D. 盐类物质中一定含有金属元素E. 酸性氧化物都能与碱反应生成盐和水2、下列哪些实验现象可以证明氢氧化钠(NaOH)是一种强碱?A. 在水中溶解时,溶液温度显著升高B. 加入酚酞指示剂后溶液呈现红色C. 能与盐酸(HCl)完全中和生成食盐(NaCl)和水D. 与硫酸铜(CuSO₄)溶液反应生成蓝色沉淀E. 使紫色石蕊试纸变蓝3、以下关于物质的描述中,正确的是()A. 氧气是一种无色、无味的气体,不易溶于水B. 氢气是一种无色、无味的气体,难溶于水C. 碳酸钙是一种白色固体,不易溶于水D. 氯化钠是一种无色固体,易溶于水三、填空题(本大题有5小题,每小题6分,共30分)1、在化学反应中,反应物转变为生成物的过程中一定发生变化的是______(选填:“物质种类”、“原子种类”或“元素种类”)。
上海师范学校高三化学模拟试卷含解析

上海师范学校高三化学模拟试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列各组表达式表示意义相同的是 ( )A.—NO2NO2 B.—OH H·····C.CH3CH2OH CH3OCH3 D.HCOOCH3HOOCCH3参考答案:B略2. 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如下图。
反应中镁和铝的:A.物质的量之比为3:2B.质量之比为3:2C.摩尔质量之比为2:3D.反应速率之比为2:3参考答案:A略3. 反应CO(g)+2H2(g)CH3OH(g)过程中能量的变化如图示。
下列判断正确的是( )A.达到平衡时,升高温度,CO的转化率增大B.1mol CO(g)和2mol H2(g)在密闭容器中反应,达平衡时,放出的热量为91KJ C.相同条件下,1mol CO(g)和2mol H2(g)完全反应生成1mol液态CH3OH 放出的热量小于91KJD.反应热取决于反应物总能量与生成物总能量的相对大小,与反应发生的条件无关参考答案:D略4. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I(aq)。
某I2、KI混合溶液中,I的物质的量浓度c(I)与温度T的关系如图K3-16-5所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是()。
图K3-16-5A.反应I2(aq)+I-(aq)I(aq)的ΔH>0B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2C.若反应进行到状态D时,一定有v正>v逆D.状态A与状态B相比,状态A的c(I2)大参考答案:BC略5.生活中碰到的某些问题,常涉及到一些化学知识,下列分析不正确的是。
A.Mg(OH)2和Al(OH)3均受热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃性气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂B.用工业废弃物二氧化碳生产塑料,不会产生白色污染并有助于缓解温室效应C.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质参考答案:C6. 下列实验操作、理象和结论均正确的是参考答案:BA. 不可将红色石蕊试纸置于溶液中检验氨,故A操作不正确;B. 实验操作、理象和结论均正确;C. 应向某溶液中滴加KSCN溶液检验Fe3+,故C操作不正确;D. BaSO4、BaCO3、BaSO3都是白色沉淀,该无色溶液中可能含有SO42-、CO32-、SO32-等,故D结论不正确。
2024年上海化学合格考试卷

2024年上海化学合格考试卷1. 以物质的化学反应为基础进行的分析属于() [单选题] *A .无机分析B .有机分析C .定性分析D.化学分析(正确答案)2. 在化学定量分析中,一般采用() [单选题] *A .常量分析法(正确答案)B .微量分析法C .痕量分析法D .定性分析3. 常量分析法中所取试样的质量应()。
[单选题] *A .大于0.1g(正确答案)C .大于0.001gD·大于0.0001g4. 当精密称定的样品量大于100mg,应选用感量为()的天平。
[单选题] *A . 0.001mgB .0.001mgC.0.01mgD.0.1mg(正确答案)5. 下列仪器需要用待装溶液润洗的是()。
[单选题] *A.量筒B.容量瓶C.烧杯D.移液管(正确答案)6. 容量瓶使用的第一步是()。
[单选题] *A.检漏(正确答案)B.洗涤C.定量转移D.定容7. 化学定量分析实验中应使用()。
[单选题] *A.一级水B.二级水C.三级水(正确答案)D.都可以8. 分析化学实需要采用()试剂。
[单选题] *A.一级B.二级(正确答案)C.三级D.四级9. 下列哪种情况造成的误差为偶然误差() [单选题] *A .砝码被腐蚀B .蒸馏水中含微量的干扰离子C .容量瓶与移液管不配套D .称量时天平的零点突然变动(正确答案)10. 系统误差又称为() [单选题] *A .随机误差B .不可定误差C .可定误差(正确答案)D .不可测误差11. 偶然误差又称为() [单选题] *A .随机误差(正确答案)B .相对误差C .可定误差D .操作误差12. 误差是表示分析结果的() [单选题] *A.准确度(正确答案)B.精密度C.灵敏度D.均匀度13. 偏差是表示分析结果的() [单选题] *B.精密度(正确答案)14. 数字5.60的有效数字位数为() [单选题] *A.一位B.二位C.三位(正确答案)D.四位15. 将20.13ml变换单位为L后的数字的有效数字院() [单选题] * A.一位B.二位C. 三位D. 四位(正确答案)16. 用千分之一分析天平称量物质质量,读数正确的是() [单选题] *A. 0.364g(正确答案)B.0.36gC. 0.3645gD. 0.4g17. 18,用滴定管量取液体体积,读数正确的是() [单选题] *A. 10.235mlB.10mlC. 10.23ml(正确答案)18. 滴定分析法主要用于() [单选题] *A.仪器分析B.定性分析C.常量分析(正确答案)D.重量分析19. 下列误差中属于终点误差的是() [单选题] *A.在终点时多加或少加半滴滴定液而引起的误差B.指示剂的变色点与化学计量点不一致而引起的误差(正确答案) C.由于确定终点的方法不同,使测量结果不一致而引起的误差D.终点时由于指示剂消耗滴定液而引起的误差20. 下列说法中正确的是()。
上海师范大学标准试卷化学 (9)
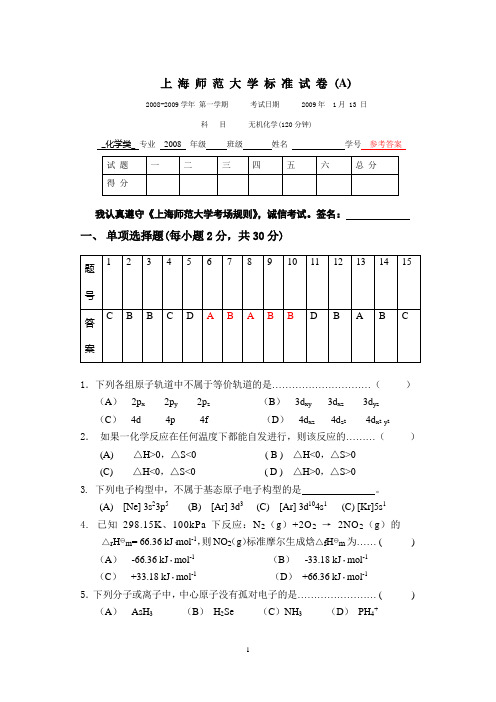
上海师范大学标准试卷 (A)2008-2009学年第一学期考试日期 2009年 1月 13 日科目无机化学(120分钟)_化学类_专业2008 年级班级姓名学号参考答案我认真遵守《上海师范大学考场规则》,诚信考试。
签名:一、单项选择题(每小题2分,共30分)1.下列各组原子轨道中不属于等价轨道的是…………………………()(A)2p x2p y2p z(B)3d xy 3d xz 3d yz(C)4d 4p 4f (D)4d xz 4d z24d x2- y22.如果一化学反应在任何温度下都能自发进行,则该反应的………()(A) △H>0,△S<0 ( B ) △H<0,△S>0(C) △H<0,△S<0 ( D ) △H>0,△S>03. 下列电子构型中,不属于基态原子电子构型的是。
(A) [Ne] 3s23p5(B) [Ar] 3d3 (C) [Ar] 3d104s1(C) [Kr]5s14.已知298.15K、100kPa下反应:N2(g)+2O2 →2NO2(g)的△r H m= 66.36 kJ·mol-1,则NO2(g)标准摩尔生成焓△f H m为…… ( )(A)-66.36 kJ·mol-1(B)-33.18 kJ·mol-1(C)+33.18 kJ·mol-1(D)+66.36 kJ·mol-15.下列分子或离子中,中心原子没有孤对电子的是…………………… ( )(A)AsH3(B)H2Se (C)NH3(D)PH4+6.下列各组量子数中,合理的一组是……………………………………( ) (A)n = 3 l = 1 m = +1 m s = +1/2 (B)n = 3 l = 5 m = -1 m s = +1/2(C)n = 2 l = 2 m = +1 m s= -1/2 (D)n = 4 l = 2 m= +3 m s= -1/27. 某温度时,反应 H 2(g) + Br 2(g) 2HBr(g) 的K = 4⨯10-2,则反应HBr(g)21H 2(g) +21Br 2(g) 的K等于……………………………( ) (A) 1/(4×10-2) (B) 1/4102⨯-(C) 4 ⨯ 10-2 (D)4102⨯-8.下列晶体熔化时,需要破坏共价键的是………………………………( )(A ) SiO 2 (B )MgO (C )Fe (D ) I 29. 下列物质中,分子间不能形成氢键的是………………………………( )(A ) NH 3 (B ) C 6H 6 (C )H 3BO 3 (D )H 2O 10. 下列叙述中错误的是…………………………………………………( ) (A )单原子分子的偶极矩等于零;(B )键矩越大,多原子分子的偶极矩就越大; (C )具有对称中心的分子,其偶极矩等于零; (D )分子的偶极矩是分子中键矩的矢量和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上海师范大学标准试卷考试日期 2007年1月 24 日科目 无机化学(A) 参考答案我认真遵守《上海师范大学考场规则》,诚信考试.签名一、选择题 ( 共25题 每题2分,共50分 )1. 有可逆反应(假设是基元反应) A + 2B = 2C ,已知某温度下,正反应速率常数k 正 = 1,逆反应速率常数k 逆 = 0.5,下述体系中处于平衡状态的是……………( C )(A) [A] = 1 mol ·dm -3 [B] = [C] =2 mol ·dm -3(B) [A] = 2 mol ·dm -3 [B] = [C] =1 mol ·dm -3(C) [A] = [C] =2 mol ·dm -3 [B] = 1 mol ·dm -3(D) [A] = [C] =1 mol ·dm -3 [B] = 2 mol ·dm -32. 将0.10 mol ·dm -3 HAc 与0.10 mol ·dm -3 NaOH 等体积混合,其pH 值为(K a (HAc) = 1.76 ⨯ 10-5) …………………………………………………………( B )(A) 5.27 (B) 8.73 (C) 6.73 (D) 10.493. 下列量子数组合ψ,不能作为薛定谔方程合理解的一组是 …………………( C ) n l m(A) 5 3 -3(B) 3 2 0(C) 4 4 2(D) 2 1 -14. 某温度下,反应N 2(g) + 3H 2(g)2NH 3(g) 的K c = 0.56,若设法使2N c (g) = 0.1mol ·dm -3、2H c (g) = 0.2 mol ·dm -3、3NH c = 0.05 mol ·dm -3,按热力学角度则反应是 …………………………………………………………………………………… ( C )(A) 正向进行 (B) 达到平衡状态(C) 逆向进行 (D) 方向无法判断5. CaF 2的K sp = 3.9 ⨯ 10-11,在F - 离子浓度为3.0 mol ·dm -3的溶夜中,Ca 2+ 离子可能的最高浓度为 ………………………………………………………………… ( B )(A) 1.3 ⨯ 10-11 mol ·dm -3 (B) 4.3 ⨯ 10-12 mol ·dm -3(C) 2.0 ⨯ 10-6 mol ·dm -3 (D) 6.2 ⨯ 10-6 mol ·dm -36. 下列离子半径变小的顺序正确的是 ……………………………………… (A )(A) F - > Na + > Mg 2+ > Al 3+ (B) Na + > Mg 2+ > Al 3+ > F -(C) Al 3+ > Mg 2+ > Na + > F - (D) F - > Al 3+ > Mg 2+ > Na +7.下列试剂中能使PbSO 4(s) 溶解度增大的是…………………………………( D )(A) Pb(NO 3)2 (B) Na 2SO 4 (C) H 2O (D) NH 4Ac8. 量子力学中所说的原子轨道是指……………………………………… ( C )(A) 波函数s ,,,m m l n ψ (B) 电子云(C) 波函数m l n ,,ψ (D) 概率密度9. 0.36 mol ·dm -3 NaAc 溶液的pH 为(HAc :K a = 1.8 ⨯ 10-5) ……………………(C )(A) 4.85 (B) 5.15 (C) 9.15 (D) 8.8510. 下列各组量子数中,合理的一组是 ………………………………………(A )(A) n = 3, l = 1, m l = +1, m s = +21 (B) n = 4, l = 5, m l = -1, m s = +21 (C) n = 3, l = 3, m l = +1, m s = -21 (D) n = 4, l = 2, m l = +3, m s = -2111. 在Cu -Zn 原电池中下列叙述不正确的是 ………………………………… (D )(A) 盐桥中的电解质可保持两个半电池中的电荷平衡(B) 盐桥为原电池构成一个闭合回路,使两电极反应能继续进行(C) 盐桥中的电解质不能参与电池反应(D) 电子通过盐桥流动12. pH = 1.0 和pH = 3.0 两种强酸溶液等体积混合后溶液的pH 值是 ……… (C )(A) 0.3 (B) 1.0 (C) 1.3 (D) 1.513. 关于下列元素第一电离能的大小的判断,正确的是 ……………………(A )(A) N > O (B) C > N (C) B > C (D) B > Be14. 对于电极反应O 2 + 4H + + 4e --2H 2O 来说,当2O p = 101.3 kPa 时,酸度对电极电势影响的关系式是 ……………………………………………………… ( B )(A) ϕ = ϕ+ 0.0592 pH(B) ϕ = ϕ- 0.0592 pH(C) ϕ = ϕ+ 0.0148 pH(D) ϕ = ϕ- 0.0148 pH15. 已知:K sp (AgCl) = 1.8 ⨯ 10-10,K sp (Ag 2CrO 4) = 2.0 ⨯ 10-12。
在含Cl - 和CrO 42-浓度均为0.3 mol ·dm -3的溶液中,加AgNO 3应是…………………………… (B )(A) Ag 2CrO 4先沉淀,Cl - 和CrO 42-能完全分离开(B) AgCl 先沉淀,Cl - 和CrO 42-不能完全分离开(C) AgCl 先沉淀,Cl - 和CrO 42-能完全分离开(D) Ag 2CrO 4先沉淀,Cl - 和CrO 42-不能完全分离开16. 下列元素第一电离能大小顺序正确的是…………………………………… ( C )(A) B < C < N < O (B) N < O < B < C(C) B < C < O < N (D) C < B < O < N17. 在-272O Cr + I - + H + −→−Cr 3+ + I 2 + H 2O 反应式中,配平后各物种的化学计量数从左至右依次为……………………………………………………………… (C )(A) 1,3,14,2,11,7 (B) 2,6,28,4,3,14 (C) 1,6,14,2,3,7 (D) 2,3,28,4,11,1418. 用0.20 mol ·dm -3 HAc 和0.20 mol ·dm -3 NaAc 溶液直接混合(不加水),配制1.0 dm 3 pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3 HAc 溶液为……………………… (D ) (p K a (HAc) = 4.75)(A) 6.4 ⨯ 102 cm3(B) 6.5 ⨯ 102 cm3(C) 3.5 ⨯ 102 cm3(D) 3.6 ⨯ 102 cm319. 在H原子中,对r = 52.9pm 处的正确描述是……………………(C )(A) 该处1s电子云最大(B) r是1s径向分布函数的平均值(C) 该处为H原子Bohr半径(D) 该处是1s电子云界面20. ψ(3, 2, 1)代表简并轨道中的一个轨道是…………………………………(B )(A) 2p轨道(B) 3d轨道(C) 3p轨道(D) 4f轨道21. 以下第二周期各对元素的第一电离能大小次序不正确的是………………(C )(A) Li < Be (B) B < C (C) N < O (D) F < Ne22. 下列关于量子数的说法中,正确的一条是……………………………………(D )(A)电子自旋量子数是1,在某个轨道中有两个电子,所以,总自旋量子数是1或者是0(B) 磁量子数m = 0的轨道都是球形轨道(C) 当角量子数是5时,可能有的简并轨道数是10(D) 当主量子数n = 5时,就开始出现g分层23. 下列元素中,原子半径最接近的一组是…………………………………(D )(A) Ne,Ar,Kr,Xe (B) Mg,Ca,Sr,Ba(C) B,C,N,O (D) Cr,Mn,Fe,Co24. 反应N2(g)+3H2(g)2NH3(g)mrH∆= -92kJ·mol-1,从热力学观点看要使H2达到最大转化率,反应的条件应该是………………………………(A )(A) 低温高压(B) 低温低压(C) 高温高压(D) 高温低压25. 基态原子的第五电子层只有2个电子,则原子的第四电子层中的电子数…(C )(A) 肯定为8个(B) 肯定为18个(C) 肯定为8 ~ 18个(D) 肯定为8 ~ 32个二、填空题( 共3题15分)26. 理想气体向真空膨胀过程中,下列热力学数据W、Q、ΔU、ΔH、ΔS和ΔG中,不为零的是ΔS、ΔG。
若过程改为液态H2O在100℃、1.013 ⨯ 105 Pa下蒸发,上述热力学数据中为零的是 ΔG 。
,27. 已知反应 2Cl(g) =Cl 2(g)T / K 600 800p K 2.08 ⨯ 1015 9.62 ⨯ 109 m r H ∆ = -245 kJ ·mol -1 Cl —Cl 键焓 = 245 kJ ·mol -128. 5 分将Ni + 2Ag + = 2Ag + Ni 2+ 氧化还原反应设计为一个原电池。
则电池的负极为_________镍电极_________________,正极为___银电极_____________________,原电池符号为__(-) Ni(s)│Ni 2+(c 1)‖Ag +(c 2)│Ag(s) (+)___。
已知 ϕ(Ni 2+ / Ni) = -0.25 V , ϕ(Ag + / Ag) = 0.80 V ,则原电池的电动势 E 为0.80 - (-0.25) = 1.05 (V), m r G ∆为__-203 kJ ·mol -1____________,该氧化还原反应的平衡常数为__3.41 ⨯ 1035_。
三、计算题 ( 共 4题 40分 任选2题)29. 10 分 已知五氧化磷蒸气按下式进行分解:PCl 5(g)PCl 3(g) + Cl 2(g)当温度为523 K 和平衡总压力为202.65 kPa 时,有69%的PCl 5发生了分解,求该温度下反应的平衡常数 K 和 m r G ∆。
