附录三常用酸碱溶液的浓度
酸碱溶液的浓度与酸碱度

酸碱溶液的浓度与酸碱度酸碱溶液的浓度与酸碱度是化学领域中重要的概念,两者密切相关但却并不完全相同。
本文将详细讨论酸碱溶液的浓度与酸碱度的定义、计算方法和关联性。
一、酸碱溶液的浓度酸碱溶液的浓度是指单位体积(常为1升)中所含的酸碱的质量或摩尔数。
有两种常见的表示方式,分别是质量浓度和摩尔浓度。
1. 质量浓度质量浓度是指溶液中溶质所占的质量与溶液总质量之比。
其计算公式为:质量浓度(g/L)= 溶质质量(g)/ 溶液体积(L)例如,一瓶质量浓度为0.1 g/mL的盐酸溶液,若取出50 mL,则溶质质量为0.1 g/mL × 50 mL = 5 g。
2. 摩尔浓度摩尔浓度是指溶液中溶质的物质量与溶液体积的比值,单位通常为摩尔/升(mol/L)。
其计算公式为:摩尔浓度(mol/L)= 溶质物质量(mol)/ 溶液体积(L)例如,若有1 mol的NaOH溶解在1升溶液中,则其摩尔浓度为1 mol/L。
需要注意的是,溶剂的密度随温度的变化可能会发生改变,因此在计算质量浓度时需注意温度的影响。
二、酸碱度的定义酸碱度是指溶液中酸性或碱性的强弱程度,用于衡量溶液中的氢离子(H+)或氢氧根离子(OH-)的浓度。
常见的表示方式有pH值和pOH值。
1. pH值pH值是负对数刻度,用于表示溶液中的酸、碱溶液的酸碱度。
其计算公式为:pH = -log[H+]其中[H+]为溶液中的氢离子浓度,单位为摩尔/升(mol/L)。
例如,如果溶液中的氢离子浓度为0.001 mol/L,则其pH值为- log(0.001) = 3。
2. pOH值pOH值是与pH值相对应的指标,用于表示溶液中的碱性溶液的酸碱度。
其计算公式为:pOH = -log[OH-]其中[OH-]为溶液中的氢氧根离子浓度,单位为摩尔/升(mol/L)。
pOH值与pH值的关系为pH + pOH = 14,即在常温下,pH值加pOH值等于14。
三、浓度与酸碱度的关联性酸碱度与溶液的浓度具有一定的关联性,但并非完全一致。
1995年国际原子量等六个常用表格

附录附录一原子量相对质量表(1995年国际原子量)附录二不同温度下水的饱和蒸汽压- 1 -附录三常用酸碱溶液的浓度(15℃)附录四弱电解质的电离常数(25℃)- 2 -附录五常见离子和化合物的颜色一、离子1.无色离子阳离子:Na+ K+ NH4+ Mg2+ Ca2+ Ba3+ Al2+ Sn4+ Pb2+ Bi3+ Ag+ Zn2+ Cd2+ Hg22+ Hg2+阴离子:BO2- C2O42- Ac- CO32- SiO32- NO3- NO2- PO43- MoO42- SO32- SO42- S2- S2O32- F- Cl-ClO3- Br- ,BrO3- I- SCN- [CuCl2]-2.有色离子[Cu(H2O)4]2+ [CuCl4]2- [Cu(NH3)4]2+- 3 -浅蓝色黄色深蓝色[Cr(H2O)6]2+ [Cr(H2O)6]3+ [Cr(H2O)5Cl]2+ [Cr(H2O)4Cl2]+蓝色紫色浅绿色暗绿色[Cr(NH3)2(H2O)4]3+ [Cr(NH3)3(H2O)3]3+ [Cr(NH3)4(H2O)2]3+紫红色浅红色橙红色[Cr(NH3)5H2O]2+ [Cr(NH3)6]3+ CrO2- CrO42- Cr2O72-橙黄色黄色绿色黄色橙色[Mn(H2O)6]2+ MnO42- MnO4-肉色绿色紫红色[Fe(C2O4)3]3- [Fe(NCS)n]3-n FeCl63- FeF63-黄色血红色黄色无色[Fe(H2O)6]2+ [Fe(H2O)6]3+ [Fe(CN)6] 4- [Fe(CN)6] 3-浅绿色淡紫色黄色浅桔黄色[Co(H2O)6]2+ [Co(NH3)6]2+ [Co(NH3)6]3+ [CoCl(NH3)5]2+粉红色黄色橙黄色红紫色[Co(NH3)5(H2O)]3+ [Co(NH3)5CO3]+ [Co(CN)6]3- [Co(SCN)4]2-粉红色紫红色紫色蓝色[Ni(H2O)6]2+ [Ni(NH3)6]2+ I3-亮绿色蓝色浅棕黄色二、化合物⒈氧化物CuO Cu2O Ag2O ZnO Hg2O HgO TiO2 V2O3黑色暗红色暗棕色白色黑褐色红色或黄色白色或橙红色黑色VO2 V2O5 Cr2O3 CrO3 MnO2 FeO Fe2O3深蓝色红棕色绿色红色棕褐色黑色砖红色Fe3O4 CoO Co2O3 NiO Ni2O3 PbO Pb3O4黑色灰绿色黑色暗绿色黑色黄色红色- 4 -⒉氢氧化物Zn(OH)2 Pb(OH)2 Mg(OH)2 Sn(OH)2 Sn(OH)4 Mn(OH)2 Fe(OH)2白色白色白色白色白色白色白色或苍绿色Fe(OH)3 Cd(OH)2 Al(OH)3 Bi(OH)3 Sb(OH)3 Cu(OH)2 CuOH红棕色白色白色白色白色浅蓝色黄色Ni(OH)2 Ni(OH)3 Co(OH)2 Co(OH)3 Cr(OH)3浅绿色黑色粉红色褐棕色灰绿色⒊氯化物AgCl Hg2Cl2 PbCl2 CuCl CuCl2 CuCl2·2H2O Hg(NH3)Cl CoCl2 白色白色白色白色棕色蓝色白色蓝色CoCl2H2O CoCl2·2H2O CoCl2·6H2O FeCl3·6H2O蓝紫色紫红色粉红色黄棕色⒋溴化物AgBr CuBr2 PbBr3淡黄色黑紫色白色⒌碘化物AgI Hg2I2 HgI2 PbI2 CuI黄色黄褐色红色黄色白色⒍卤酸盐Ba(IO3)2 AgIO3 KClO4 AgBrO3白色白色白色白色⒎硫化物Ag2S PbS CuS Cu2S FeS Fe2S3 SnS SnS2 灰黑色黑色黑色黑色棕黑色黑色灰黑色金黄色HgS CdS Sb2S3 Sb2S5 MnS ZnS As2S3红色或黑色黄色橙色橙红色肉色白色黄色⒏硫酸盐Ag2SO4 Hg2SO4 PbSO4 CaSO4 BaSO4 [Fe(NO)]SO4 Cu(HO)2 SO4白色白色白色白色白色深棕色浅蓝色- 5 -CuSO4·5H2O CoSO4·7H2O Cr2(SO4)3·6H2O Cr2(SO4)3 Cr2(SO4)3·18H2O蓝色红色绿色紫色或红色蓝紫色⒐碳酸盐Ag2CO3 CaCO3 BaCO3 MnCO3 CdCO3 Zn2(OH)2CO3 FeCO3白色白色白色白色白色白色白色Cu2(OH)2CO3 Ni2(OH)2CO3暗绿色浅绿色⒑磷酸盐Ca3(PO4)2 CaHPO4 Ba3(PO4)2 FePO4 Ag3PO4 MgNH4PO4白色白色白色浅黄色黄色白色11. 铬酸盐Ag2CrO4 PbCrO4 BaCrO4 FeCrO4·2H2O CaCrO4砖红色黄色黄色黄色黄色12. 硅酸盐BaSiO3 CuSiO3 CoSiO3 Fe2(SiO3)3 MnSiO3 NiSiO3 ZnSiO3白色蓝色紫色棕红色肉色翠绿色白色13. 草酸盐CaC2O4 Ag2C2O4 FeC2O4·2H2O白色白色黄色14. 类卤化合物AgCN Ni(CN)2 Cu(CN)2 CuCN AgSCN Cu(SCN)2白色浅绿色浅棕黄色白色白色黑绿色15. 其它含氧酸盐Ag2S2O3 BaSO3白色白色16. 其它化合物Cu2[Fe(CN)6] Ag3[Fe(CN)6] Zn3[Fe(CN)6]2 Co2[Fe(CN)6] Ag4[Fe(CN)6] 红棕色橙色黄褐色绿色白色- 6 -Zn2[Fe(CN)6] K3[Co(NO2)6] K2Na[Co(NO2)6] (NH4)2Na[Co(NO2)6]白色黄色黄色黄色K2[PtCl6] Na2[Fe(CN)5NO]·2H2O NaAc·Zn(Ac)2·3[UO2(Ac)2]·9H2O黄色红色黄色附录六常用有机溶剂的物理常数参考文献:- 7 -1.兰州大学、复旦大学化学系有机化学教研室编, 有机化学实验(第二版), 北京:高等教育出版社, 1994.2.南京大学大学化学实验教学组编, 大学化学实验, 北京: 高等教育出版社, 1999.3.刘约权李贵深主编, 实验化学.,北京: 高等教育出版社, 1999.4.武汉大学主编, 分析化学实验(第二版), 北京: 高等教育出版社, 1985.5.全国自然科学名词审定委员会, 化学名词, 北京: 科学出版社, 1991.6.徐功骅蔡作乾主编, 大学化学实验(第二版), 北京: 清华大学出版社, 1997.7.赵士铎主编, 定量分析, 北京: 中国农业科技出版社, 1996.8.吴泳主编, 大学化学新体系实验, 北京: 科学出版社, 1999.9.朱风岗等主编, 农科化学实验, 北京: 中国农业出版社, 1997.10.周宁怀主编, 微型无机化学实验, 北京: 科学出版社, 1999.11.周宁怀王德琳主编, 微型有机化学实验, 北京: 科学出版社, 1999.12.陈长水等主编, 微型有机化学实验, 北京: 化学工业出版社, 1998.13.叶非等主编, 有机化学实验, 哈尔滨: 黑龙江教育出版社, 1997.14.赵明宪马文英主编, 普通化学实验, 沈阳: 吉林科学技术出版社, 1997.- 8 -。
附录三常用酸碱溶液的浓度
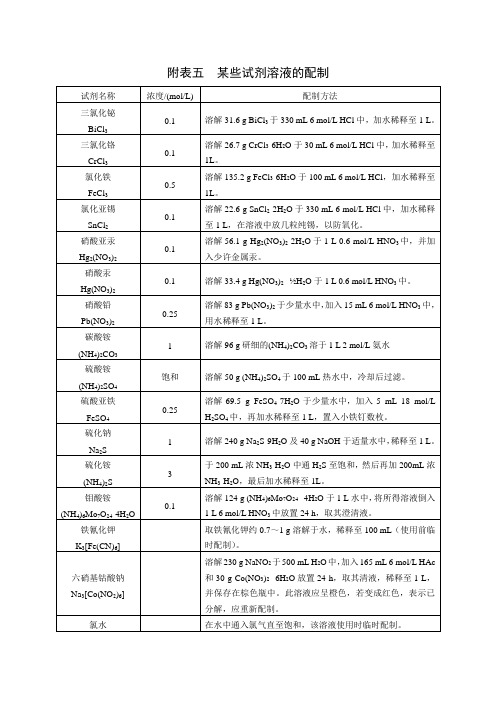
1%
1 g丁二酮肟溶于100 mL 95%乙醇中。
二苯胺
将1 g二苯胺在搅拌下溶于100 mL密度为1.84 g/mL硫酸或100 mL密度为1.70g/mL磷酸中(该溶液可保存较长时间)。
奈斯勒试剂
溶解115 g HgI2和80 g KI于水中,稀释至500 mL,加入500 mL 6 mol/L NaOH溶液,静置后,取其清液,保存于棕色瓶中。
硝酸银-氨溶液
溶解1.7 g AgNO3于水中,加170.1 mol/L碘化钾。
氯水
在水中通入氯气直至饱和,该溶液使用时临时配制。
溴水
在水中滴加液溴至饱和。
碘液
0.01
溶解1.3 g I2和5 g KI于尽可能少量的水中,待I2完全溶解后(充分搅动)再加水稀释至1 L。
六羟基锑(Ⅴ)酸钾
K[Sb(OH)6]
饱和
于配制好的氢氧化钾饱和溶液中陆续加入五氯化锑,加热。当有少量白色沉淀不再溶解时停止加五氯化锑。冷却,静置,上层清液即为六羟基锑(Ⅴ)酸钾溶液。
硫氰酸汞铵试剂
(NH4)2[Hg(SCN)4]
溶解8 g HgCl2和9 g NH4SCN于100 mL水中。
邻二氮菲
2%
2 g邻二氮菲加几滴6 mol/L H2SO4,溶于100 mL水中。
亚硝酰铁氰化钠
Na2[Fe(CN)5NO]
3%
3 g亚硝酰铁氰化钠溶解于100 mL水中,保存于棕色瓶中。如果溶液变成绿色须重新配制。
硫酸铵
(NH4)2SO4
饱和
溶解50 g (NH4)2SO4于100 mL热水中,冷却后过滤。
硫酸亚铁
FeSO4
0.25
溶解69.5 g FeSO4·7H2O于少量水中,加入5 mL 18 mol/L H2SO4中,再加水稀释至1 L,置入小铁钉数枚。
酸碱溶液的浓度与pH值

酸碱溶液的浓度与pH值一、引言酸碱溶液的浓度与pH值是化学中一个重要的关系。
浓度是指单位体积溶液中所含溶质的质量或物质量的多少,而pH值则是用来表示溶液酸碱性强弱的一个指标。
本文将探讨酸碱溶液浓度与pH值的关系,以及它们之间的计算方法和应用。
二、酸碱溶液浓度的计算酸碱溶液的浓度通常可以用溶质的质量分数、质量浓度、体积分数、mol浓度等多种形式来表示。
其中,质量分数指的是溶质质量与溶液质量之比,质量浓度是单位体积溶液中所含溶质的质量,体积分数是溶质体积与溶液体积之比,而mol浓度则是溶质的物质量与溶液的体积之比。
在计算酸碱溶液浓度时,我们可以根据实际情况选择适合的计算方法。
例如,如果已知溶质的质量和溶液的总质量,我们可以通过计算质量分数来得到溶液的浓度;如果已知溶质的质量和溶液的体积,我们可以通过计算质量浓度来得到溶液的浓度。
同样地,如果已知溶质的体积和溶液的体积,我们可以通过计算体积分数得到溶液的浓度;如果已知溶质的物质量和溶液的体积,我们可以通过计算mol浓度来得到溶液的浓度。
三、pH值的含义与计算pH值是表示酸碱性强弱的指标,它反映了溶液中氢离子(H+)的浓度。
pH值的计算方法是通过溶液中H+离子的负对数来得到的,即pH = -log[H+]。
pH值的范围为0到14,数值越小表示酸性越强,数值越大表示碱性越强,中性溶液的pH值为7。
通过pH值的计算,我们可以了解溶液的酸碱性质。
当pH值小于7时,溶液呈酸性,而当pH值大于7时,溶液呈碱性。
此外,我们还可以通过pH值的变化来判断酸碱溶液反应的进行与反应速率的快慢。
四、酸碱溶液浓度与pH值的关系酸碱溶液的浓度与pH值之间存在着密切的关系。
通常情况下,酸性溶液的浓度越高,其pH值越低;而碱性溶液的浓度越高,其pH值越高。
这是因为酸性溶液中含有较多的H+离子,而碱性溶液中含有较多的OH-离子,它们的浓度决定了溶液的pH值。
在实际应用中,我们经常通过调整酸碱溶液的浓度来控制其pH值,以适应不同的化学实验或工业生产需要。
原子量相对质量表

附录附录一原子量相对质量表(1995年国际原子量)- 1 -- 2 -附录五常见离子和化合物的颜色一、离子1.无色离子阳离子:Na+K+NH4+Mg2+Ca2+Ba3+Al2+Sn4+Pb2+Bi3+Ag+Zn2+Cd2+Hg22+Hg2+阴离子:BO2-C2O42-Ac-CO32-SiO32-NO3-NO2-PO43-MoO42-SO32- SO42-S2-S2O32-F-Cl-ClO3-Br-BrO3-I-SCN-[CuCl2]-- 3 -2.有色离子[Cu(H2O)4]2+[CuCl4]2-[Cu(NH3)4]2+浅蓝色黄色深蓝色[Cr(H2O)6]2+[Cr(H2O)6]3+[Cr(H2O)5Cl]2+[Cr(H2O)4Cl2]+蓝色紫色浅绿色暗绿色[Cr(NH3)2(H2O)4]3+[Cr(NH3)3(H2O)3]3+[Cr(NH3)4(H2O)2]3+紫红色浅红色橙红色[Cr(NH3)5H2O]2+[Cr(NH3)6]3+CrO2-CrO42-Cr2O72-橙黄色黄色绿色黄色橙色[Mn(H2O)6]2+MnO42-MnO4-肉色绿色紫红色[Fe(C2O4)3]3-[Fe(NCS)n]3-n FeCl63-FeF63-黄色血红色黄色无色[Fe(H2O)6]2+[Fe(H2O)6]3+[Fe(CN)6] 4-[Fe(CN)6] 3-浅绿色淡紫色黄色浅桔黄色[Co(H2O)6]2+[Co(NH3)6]2+[Co(NH3)6]3+[CoCl(NH3)5]2+粉红色黄色橙黄色红紫色[Co(NH3)5(H2O)]3+[Co(NH3)5CO3]+[Co(CN)6]3-[Co(SCN)4]2-粉红色紫红色紫色蓝色[Ni(H2O)6]2+[Ni(NH3)6]2+I3-亮绿色蓝色浅棕黄色二、化合物⒈氧化物CuO Cu2O Ag2O ZnO Hg2O HgO TiO2V2O3黑色暗红色暗棕色白色黑褐色红色或黄色白色或橙红色黑色VO2V2O5Cr2O3CrO3MnO2FeO Fe2O3深蓝色红棕色绿色红色棕褐色黑色砖红色Fe3O4CoO Co2O3NiO Ni2O3PbO Pb3O4- 4 -黑色灰绿色黑色暗绿色黑色黄色红色⒉氢氧化物Zn(OH)2Pb(OH)2Mg(OH)2Sn(OH)2Sn(OH)4Mn(OH)2Fe(OH)2白色白色白色白色白色白色白色或苍绿色Fe(OH)3Cd(OH)2Al(OH)3Bi(OH)3Sb(OH)3Cu(OH)2CuOH红棕色白色白色白色白色浅蓝色黄色Ni(OH)2Ni(OH)3Co(OH)2Co(OH)3Cr(OH)3浅绿色黑色粉红色褐棕色灰绿色⒊氯化物AgCl Hg2Cl2PbCl2CuCl CuCl2CuCl2·2H2O Hg(NH3)Cl CoCl2 白色白色白色白色棕色蓝色白色蓝色CoCl2H2O CoCl2·2H2O CoCl2·6H2O FeCl3·6H2O蓝紫色紫红色粉红色黄棕色⒋溴化物AgBr CuBr2PbBr3淡黄色黑紫色白色⒌碘化物AgI Hg2I2HgI2PbI2CuI黄色黄褐色红色黄色白色⒍卤酸盐Ba(IO3)2AgIO3KClO4AgBrO3白色白色白色白色⒎硫化物Ag2S PbS CuS Cu2S FeS Fe2S3SnS SnS2灰黑色黑色黑色黑色棕黑色黑色灰黑色金黄色HgS CdS Sb2S3Sb2S5MnS ZnS As2S3红色或黑色黄色橙色橙红色肉色白色黄色⒏硫酸盐- 5 -Ag2SO4Hg2SO4PbSO4 CaSO4BaSO4[Fe(NO)]SO4Cu(HO)2 SO4白色白色白色白色白色深棕色浅蓝色CuSO4·5H2O CoSO4·7H2O Cr2(SO4)3·6H2O Cr2(SO4)3Cr2(SO4)3·18H2O蓝色红色绿色紫色或红色蓝紫色⒐碳酸盐Ag2CO3CaCO3BaCO3MnCO3CdCO3Zn2(OH)2CO3FeCO3白色白色白色白色白色白色白色Cu2(OH)2CO3Ni2(OH)2CO3暗绿色浅绿色⒑磷酸盐Ca3(PO4)2CaHPO4Ba3(PO4)2FePO4Ag3PO4MgNH4PO4白色白色白色浅黄色黄色白色11. 铬酸盐Ag2CrO4PbCrO4BaCrO4FeCrO4·2H2O CaCrO4砖红色黄色黄色黄色黄色12. 硅酸盐BaSiO3CuSiO3CoSiO3Fe2(SiO3)3MnSiO3NiSiO3ZnSiO3白色蓝色紫色棕红色肉色翠绿色白色13. 草酸盐CaC2O4Ag2C2O4FeC2O4·2H2O白色白色黄色14. 类卤化合物AgCN Ni(CN)2Cu(CN)2CuCN AgSCN Cu(SCN)2白色浅绿色浅棕黄色白色白色黑绿色15. 其它含氧酸盐Ag2S2O3BaSO3白色白色16. 其它化合物- 6 -Cu2[Fe(CN)6] Ag3[Fe(CN)6] Zn3[Fe(CN)6]2Co2[Fe(CN)6] Ag4[Fe(CN)6]红棕色橙色黄褐色绿色白色Zn2[Fe(CN)6] K3[Co(NO2)6] K2Na[Co(NO2)6] (NH4)2Na[Co(NO2)6]白色黄色黄色黄色K2[PtCl6]Na2[Fe(CN)5NO]·2H2O NaAc·Zn(Ac)2·3[UO2(Ac)2]·9H2O黄色红色黄色附录六常用有机溶剂的物理常数- 7 -参考文献:1.兰州大学、复旦大学化学系有机化学教研室编,有机化学实验(第二版), 北京:高等教育出版社,1994.2.南京大学大学化学实验教学组编, 大学化学实验, 北京: 高等教育出版社, 1999.3.刘约权李贵深主编, 实验化学.,北京: 高等教育出版社, 1999.4.武汉大学主编, 分析化学实验(第二版), 北京: 高等教育出版社, 1985.5.全国自然科学名词审定委员会, 化学名词, 北京: 科学出版社, 1991.6.徐功骅蔡作乾主编, 大学化学实验(第二版), 北京: 清华大学出版社, 1997.7.赵士铎主编, 定量分析, 北京: 中国农业科技出版社, 1996.8.吴泳主编, 大学化学新体系实验, 北京: 科学出版社, 1999.9.朱风岗等主编, 农科化学实验, 北京: 中国农业出版社, 1997.10.周宁怀主编, 微型无机化学实验, 北京: 科学出版社, 1999.11.周宁怀王德琳主编, 微型有机化学实验, 北京: 科学出版社, 1999.12.陈长水等主编, 微型有机化学实验, 北京: 化学工业出版社, 1998.13.叶非等主编, 有机化学实验, 哈尔滨: 黑龙江教育出版社, 1997.14.赵明宪马文英主编, 普通化学实验, 沈阳: 吉林科学技术出版社, 1997.- 8 -。
标准溶液的浓度
测定条件
酸性铬蓝K
0.1%乙醇溶液
Ca
Mg
红~蓝
红~蓝
pH = 12
pH = 10 (氨性缓冲溶液)
钙指示剂
与NaCl配成1:100的固体混合物
Ca
酒红~蓝
pH > 12 (KOH或NaOH)
铬天青S
0.4%水溶液
Al
Cu
Fe(II)
Mg
紫~黄橙
蓝紫~黄
蓝~橙
红~黄
pH = 4 (醋酸缓冲溶液),热
黄~紫
黄~紫红
pH > 10 (NaOH),25%乙醇
pH = 8~10 (氨性缓冲溶液)
pH = 7~8 (氨性缓冲溶液)
pH = 8.5~11.5 (氨性缓冲溶液)
PAN
0.1%乙醇〔或甲醇〕溶液
Cd
Co
Cu
Zn
红~黄
黄~红
紫~黄
红~黄
粉红~黄
pH = 6 (醋酸缓冲溶液)
醋酸缓冲溶液,70~80℃。以Cu2+离子回滴
标定NaOH溶液
含NaCl和蔗糖饱和液枯燥器
二水合草酸
标定NaOH溶液
室温空气枯燥
氯化钾
500~600℃枯燥至恒重
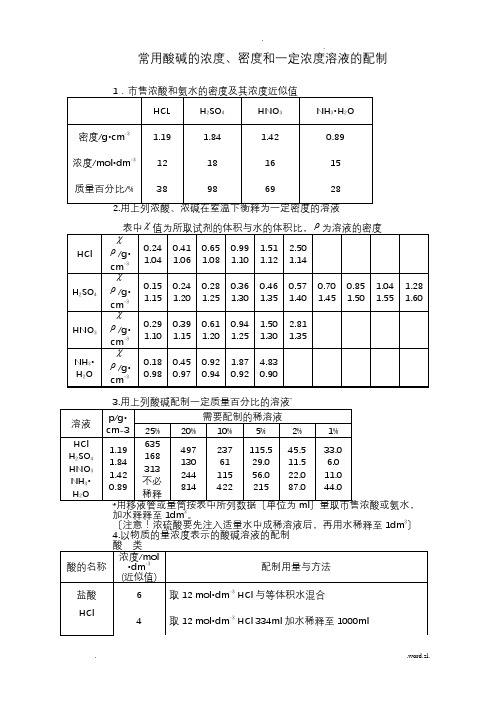
附录2 市售酸碱试剂的浓度及比重
试剂
比重
量浓度〔mol/L〕
重量百分浓度〔%〕
冰醋酸
氨水
苯胺
盐酸
氢氟酸
硝酸
高氯酸
磷酸
硫酸
三乙醇胺
浓氢氧化钠
饱和氢氧化钠
1.05
0.90
1.022
1.19
1.14
HNO3
/g•cm-3
附录基因工程操作中常用的溶液和缓冲液

附录一分子生物学实验中常用的溶液和缓冲液一、酸、碱和盐溶液的配制盐酸(HCl ,分子量36.5,重量百分比36% ),1 mol/L 按以下顺序混合:912.5 mL H 2O;87.5 mL 浓盐酸。
盐酸(HCl ,分子量36.5,重量百分比36%),0.25N/L 按以下顺序混合:978.4 mL H 2O;21.6 mL 浓盐酸。
硫酸(H2SO4,分子量98.07,重量百分比96%), 1 mol/L 按以下顺序混合:944.8 mL H2O;55.6 mL 浓硫酸。
硝酸(HNO3,分子量63.02,重量百分比71%), 1 mol/L 按以下顺序混合:937.5 mL H2O;62.5 mL 硝酸冰醋酸(CH3COOH ,分子量60.05,重量百分比99.5%),1 mol/L 按以下顺序混合:942.5 mL H2O;57.5 mL 冰醋酸。
乙酸(CH3COOH,分子量60.5,重量百分比36%), 1 mol/L 按以下顺序混合:840.5 mL H2O;159.5 mL 乙酸。
甲酸(HCOOH ,分子量46.02,重量百分比90%),1 mol/L 按以下顺序混合:957.3 mL H2O;42.7 mL 甲酸。
高氯酸(HClO 4,分子量100.5,重量百分比70%),1 mol/L 按以下顺序混合:914.5 mL H 2O;85.5 mL 高氯酸。
氢氧化钾(KOH,分子量56.1), 1 mol/L56.0 g KOH 溶解于1 L H2O 中。
氢氧化钠(NaOH ,分子量40.0), 1 mol/L将40.0 g NaOH溶解于450 mL H 2O中,补加H2O至1 L。
氢氧化钠(NaOH,分子量40.0),10 mol/L将400 g NaOH 溶于450 mL 水中,补加H2O 至 1 L。
氨水(NH4OH,分子量35.0,重量百分比25%),1 mol/L 按以下顺序混合:924.9 mL H 2O;75.1 mL 氨水。
酸碱溶液的浓度与酸碱度分析

酸碱溶液的浓度与酸碱度分析酸碱溶液的浓度与酸碱度是化学分析中常见且重要的参数。
通过准确测定溶液的浓度和酸碱度,我们可以更好地了解溶液的性质,并根据需要进行相应的调整和控制。
本文将探讨酸碱溶液浓度的分析方法和酸碱度的测定原理。
一、酸碱溶液浓度的分析方法1. 重量法:酸碱溶液的浓度可以通过称量出一定体积的溶液,然后蒸发溶液,得到残渣的质量后,利用质量守恒原理计算出溶液的浓度。
这种方法适用于不挥发的溶液。
2. 酸碱滴定法:这是一种常用的浓度分析方法,通常使用标准溶液滴定待测溶液,以求得酸碱溶液的浓度。
滴定时,要注意滴定剂的选择、滴定终点的判断以及准确读取滴定量等。
3. 光度法:对于一些有色酸碱溶液,我们可以利用酸碱溶液的吸收特性来确定其浓度。
通过使用特定波长的光源照射溶液,并测量溶液吸光度的变化,可以根据比尔-朗伯定律计算出溶液的浓度。
4. pH计测量法:pH值作为酸碱度的指标,也可以间接用来测定溶液的酸碱浓度。
pH计通过测量溶液的氢离子浓度来确定溶液的酸碱度,从而得到酸碱溶液的浓度信息。
二、酸碱度的测定原理1. 酸碱度概念:根据溶液中氢离子(H+)和氢氧根离子(OH-)的浓度,我们可以确定溶液的酸碱度。
酸性溶液中,氢离子浓度高于氢氧根离子浓度;碱性溶液中,氢离子浓度低于氢氧根离子浓度;中性溶液中,氢离子浓度与氢氧根离子浓度相等。
2. pH值的概念:pH值是表示溶液酸碱度的常用指标,它是负对数函数中的酸离子(氢离子)浓度的倒数。
一般来说,pH值越小,溶液越酸;pH值越大,溶液越碱;pH值为7时,溶液为中性。
3. 酸碱度测定方法:常见的酸碱度测定方法有指示剂法、酸度计法和电位滴定法。
使用指示剂法时,我们在滴定过程中向溶液中加入酸碱指示剂,根据溶液的颜色变化来判断滴定终点;酸度计法通过测量溶液中的酸离子浓度或氢离子浓度来确定溶液酸碱度;电位滴定法则是利用电化学的原理进行测定,通过测量电位差来判断溶液的酸碱度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
紫红
灰蓝
绿
一份0.1%绿酚红钠盐水溶液
一份0.1%溴甲酚绿钠盐水溶液
6.1
黄绿
浅蓝
蓝紫
一份0.1%溴甲酚紫钠盐水溶液 一份0.1%溴百里酚蓝钠盐水溶液
6.7
黄
紫
蓝紫
一份0.1%中性红乙醇溶液
一份0.1%亚甲基蓝乙醇溶液
*
7.0
蓝紫
一
绿
一份0.1%中性红乙醇溶液
一份0.1%溴百里酚蓝乙醇溶液
7.2
黄
绿
紫
一份0.1%酚酞乙醇溶液 一份0.1%百里酚酞乙醇溶液
9.9
无
玫红
紫
一份0.1%酚酞乙醇溶液
二份0.2%尼罗蓝乙醇溶液
*
10.0
蓝
紫
红
二份0.1%百里酚酞乙醇溶液
一份0.1%茜素黄乙醇溶液
10.2
黄
一
紫
二份0.2%尼罗蓝水溶液
一份0.1%茜素黄水溶液
10.8
绿
一
棕红
备注:变色点右上角标“*”者,表明该指示剂颜色变化敏锐,系理想指示剂。
酚红
6.4〜8.0
7.9
黄
红
0.1g溶于14.2mL 0.02mol/L NaOH溶液,用水 稀释至250mL;或0.1g溶于100mL20%乙醇
中性红
6.8〜8.0
7.4
红
黄
0.1g溶于100mL60%乙醇
甲酚红
0.2〜1.8
7.2〜8.8
8.2
红
黄
黄
红
0.1g溶于13.1mL 0.02mol/L NaOH溶液,用水 稀释至250mL;或0.04g溶于100mL50%乙 醇
㈢氧化还原指示剂
名称
变色电位
/V(pH = 0)
颜色
配制方法
氧化态
还原态
中性蓝
0.170
:无色
0.1g中性蓝溶于100mL水中
中性红
0.237
红
无色
0.1g中性红溶于100mL60%乙醇中
靛蓝胭脂红
0.291
HTt.
无色
0.1g靛蓝胭脂红溶于100mL水中
靛蓝三磺酸
0.332
无色
0.1g靛蓝三磺酸溶于100mL水中
玫红
灰绿
绿
一份0.1%酚红钠盐水溶液
一份0.1%溴百里酚蓝钠盐水溶液
*
7.5
黄
浅紫
紫
一份0.1%甲酚红钠盐水溶液
一份0.1%百里酚蓝钠盐水溶液
*
8.3
黄
玫红
紫
三份0.1%酚酞乙醇溶液
一份0.1%a-萘酚酞乙醇溶液
8.9
浅玫红
浅绿
紫
三份0.1%酚酞50%乙醇溶液
一份0.1%百里酚蓝50%乙醇溶液
*
9.0
3.40
红
橙
0.1g溶于100mL水
溴酚蓝
3.0〜4.6
3.85
黄
蓝
0.1g溶于7.45mL 0.02mol/L NaOH溶液,用水 稀释至250mL;或0.1g溶于100mL20%乙醇
刚果红
3.0〜5.2
蓝紫
红
0.1g溶于100mL水
茜素磺酸钠
3.7〜5.2
「黄
紫
0.1g溶于100mL水
溴甲酚绿
3.8〜5.4
0.107g指示剂溶于20mL 5%Na2CO3溶液, 用水稀释至100mL
5-硝基邻二氮菲 亚铁配合物
1.25
淡蓝
红ቤተ መጻሕፍቲ ባይዱ
1.485g5-邻二氮菲和0.695g FeSO47H2O
溶于100mL水中
㈣金属离子指示剂
指示剂
离解平衡和颜色变化
溶液配制方法
颜
In
色
MIn
铬黑T*
(EBT)
pKa =6.32pKa =11.63
百里酚酞
9.4〜10.6
10.0
无
蓝
0.1g溶于100mL90%乙醇
尼罗蓝
10.1〜11.1
蓝
红
0.1g溶于100mL水
西素黄R
1.9〜3.3
10.1〜12.1
11.16
红
黄
黄
淡紫
0.1g溶于100mL水
靛蓝胭脂红
11.6〜14.0
12.2
蓝
黄
0.25g溶于100mL50%乙醇
㈡混合指示剂
混合指示剂变色点pH酸色 转变色碱色
0.85
紫红
无色
0.2g二苯胺磺酸钠溶于100mL水中
专利蓝V
0.95
红
黄:
0.1g专利蓝V溶于100mL水中
酸性绿
0.96
橘红
黄绿
0.1g酸性绿溶于100mL水中
邻二氮菲-亚铁 配合物
1.06
淡蓝
红
1.485g邻二氮菲和0.695g FeSO47缶0溶于
100mL水中
邻苯氨基苯甲酸
1.08
紫红
无色
2%淀粉
0.53
蓝
无色
2g可溶性淀粉,加少许水调成浆状,在搅 拌下注入100mL沸水中,微沸2min,放置, 取上层溶液使用
亚甲基蓝
0.532
蓝
无色
0.1g亚甲基蓝溶于100mL水中
劳氏紫
0.543
紫「
无色「
0.1g劳氏紫溶于100mL水中
二苯胺
0.76
紫
无色
1g二苯胺溶于100mL浓硫酸中
二苯胺磺酸钠
4.68
黄
蓝
0.1g溶于7.15mL 0.02mol/L NaOH溶液,用水 稀释至250mL;或0.1g溶于100mL20%乙醇
甲基红
4.4〜6.2
4.95
红
黄
0.1g溶于18.6mL 0.02mol/L NaOH溶液,用水 稀释至250mL;或0.1g溶于100mL60%乙醇
石蕊
4.5〜8.3
红
一份0.1%甲基黄乙醇溶液 一份0.1%亚甲基蓝乙醇溶液
*
3.25
蓝紫
一
绿
一份0.1%甲基橙水溶液
一份0.25%靛蓝胭脂红水溶液
4.1
紫
灰
绿
一份0.02%甲基橙水溶液
一份0.1%溴甲酚绿钠盐水溶液
4.3
橙
浅绿
蓝绿
一份0.2%甲基红乙醇溶液
三份0.1%溴甲酚绿乙醇溶液
*
5.1
酒红
一
绿
一份0.2%甲基红乙醇溶液 一份0.1%亚甲基蓝乙醇溶液
H2In2-Hln2-“3—In3-
紫红f蓝“橙
0.5%水溶液
蓝
酒红
二甲酚橙
(XO)
4PKa5=6.35
Hein4-5——HIn5-
黄红
0.5%乙醇溶液 或0.2%水溶液
亮黄
红紫
K-B指示剂*
PKa1=8PKa,=132
附表二 常用指示剂及试纸的制备
㈠酸碱指示剂
指示剂
变色范围pH
pKa
酸色
碱色
配制方法
结晶紫
0.0〜2.0
绿
紫
0.02g溶于100mL水中
甲基紫
0.13〜0.5
1.0〜1.5
2.0〜3.0
0.8
黄
绿
蓝
绿
蓝
紫
0.1g溶于100mL水
甲基黄
2.9〜4.0
3.3
红
黄
0.1g溶于100mL90%乙醇
甲基橙
3.1〜4.4
蓝
0.2g溶于100mL乙醇
溴甲酚红紫
5.2〜6.8
6.3
黄
紫红
0.1g溶于9.25mL 0.02mol/L NaOH溶液,用水 稀释至250mL;或0.1g溶于100mL20%乙醇
溴百里酚蓝
6.0〜7.6
7.1
黄
蓝
0.1g溶于8mL 0.02mol/L NaOH溶液,用水稀 释至250mL;或0.1g溶于100mL20%乙醇
a-萘酚酞
7.4〜8.6
黄
蓝绿
0.1g或1g溶于100mL70%乙醇
百里酚蓝
1.2〜2.8
8.0〜9.6
1.65
8.9
红
黄
黄
蓝
0.1g溶于10.75mL 0.02mol/L NaOH溶液,用 水稀释至250mL;或0.1g溶于100mL20%乙 醇
酚酞
8.2〜10.0
9.4
:无
紫红
0.1g溶于100mL60%乙醇
