附录二常用酸碱溶液的浓度
(完整版)药物分析习题集_附答案

药物分析习题第一章绪论(药典概况)一、填空题1.中国药典的主要内容由凡例、正文、附录和索引四部分组成。
2.目前公认的全面控制药品质量的法规有GLP 、GMP 、GSP 、GCP 。
3.“精密称定”系指称取重量应准确至所取重量的千分之一;“称定”系指称取重量应准确至所取重量的百分之一;取用量为“约”若干时,系指取用量不得超过规定量的+-10% 。
4.药物分析主要是采用化学或物理化学,生物化学等方法和技术,研究化学结构已知的合成药物和天然药物及其制剂的组成、理化性质、真伪鉴别、纯度检查以及有效成分的含量测定等。
所以,药物分析是一门的方法性学科。
5.判断一个药物质量是否符合要求,必须全面考虑__鉴别____、_检查_____、含量测定______三者的检验结果。
6.药物分析的基本任务是检验药品质量,保障人民用药__安全___、_合理____、有效____的重要方面二、选择题1、良好药品生产规范可用( )A、USP表示B、GLP表示C、BP表示D、GMP表示E、GCP表示2、药物分析课程的内容主要是以( )A、六类典型药物为例进行分析;B、八类典型药物为例进行分析C、九类典型药物为例进行分析;D、七类典型药物为例进行分析E、十类典型药物为例进行分析3、良好药品实验研究规范可用( )A、GMP表示B、GSP表示C、GLP表示D、TLC表示E、GCP表示4、美国药典1995年版为( )A、第20版B、第23版C、第21版D、第19版E、第22版5、英国药典的缩写符号为( )A、GMPB、BPC、GLPD、RP-HPLCE、TLC6、美国国家处方集的缩写符号为( )A、WHOB、GMPC、INN(D、NFE、USP7、GMP是指A、良好药品实验研究规范;B、良好药品生产规范;C、良好药品供应规范D、良好药品临床实验规范;E、分析质量管理8、根据药品质量标准规定,评价一个药品的质量采用( )A、鉴别,检查,质量测定B、生物利用度;C、物理性质D、药理作用三、问答题1.药品的概念?对药品的进行质量控制的意义?2.药物分析在药品的质量控制中担任着主要的任务是什么?3.常见的药品标准主要有哪些,各有何特点?4.中国药典(2005年版)是怎样编排的?5.什么叫恒重,什么叫空白试验,什么叫标准品、对照品?6.常用的药物分析方法有哪些?7.药品检验工作的基本程序是什么?8.中国药典和国外常用药典的现行版本及英文缩写分别是什么?9.药典的内容分哪几部分?建国以来我国已经出版了几版药典?10.简述药物分析的性质?四、配伍题1、A:RP-HPLC; B:BP; C:USP; D:GLP; E:GMP(1)反相高效液相色谱法(2)良好药品生产规范2、A:GMP; B:BP; C:GLP; D:TLC; E:RP-HPLC(1)英国药典(2)良好药品实验研究规范参考答案一、填空题1、凡例正文附录索引2、GLP GMP GSP GCP3、千分之一百分之一±10%4、化学物理化学生物化学研究与发展药品质量控制5、鉴别,检查,含量测定6、安全,合理,有效二、选择题1、D;2、D;3、C;4、B;5、B;6、D;7、B;8、A三、问答题1、用于预防治疗诊断人的疾病的特殊商品。
酸碱标准溶液的配制与浓度的标定

图 3
图 4
碱式滴定管的使用方法
(1)试漏。给碱式滴定管装满水后夹在 滴定管架上静置1-2分钟。若有漏水应更换 橡皮管或管内玻璃珠,直至不漏水且能灵活 控制液滴为止。 (2)滴定管内装入标准溶液后,要将尖 嘴内的气泡排出。方法是:把橡皮管向上弯 曲,出口上斜,挤捏玻璃珠,使溶液从尖嘴 快速喷出,气泡即可随之排掉(如右图1)。 (3)进行滴定操作时,用左手的拇指和 食指捏住玻璃珠靠上部位,向手心方向捏挤 橡皮管,使其与玻璃珠之间形成一条缝隙, 溶液即可流出(如右图2)。
碱式滴定管取 加1滴甲基 25.00 ml 碱液 橙指示剂
用盐酸标准 溶液滴定
近终点时一滴或半 滴加入,直至溶液 由黄色突变为橙色
数据处理
表1 基准物Na2CO3标定HCl溶液
Ⅰ
m1/g m2/g
Ⅱ
Ⅲ
m/g
V2/mL V1/mL V(HCl)/mL
c(HCl)/mol· L-1 L-1 c ( HCl)/mol·
浓盐酸易挥发, 配置过程应在通 风橱中进行
小量筒量取4.4ml 量筒量取200ml 浓盐酸 水于烧杯中
再加入 300ml水
将溶液转移到 试剂瓶中备用
实验内容
3. 0.1 mol∙L HCl溶液的标定
保持天平室内干 -1 燥、洁净:称量 指示剂用量要平行, 过程手不允许接 且滴加不要过多 触称量瓶
①检查仪器是否漏液②仪 器要用待装液润洗③装满 液后静置1-2分钟④取液最 好从“0”开始⑤读数时视线 与凹液面平齐
2. 溶液的标定
(1)盐酸溶液的标定(基准物标定)
2HCl+Na2CO3=2NaCl+CO2+H2O 滴定到达等量点时,溶液呈酸性,可用甲基橙 作指示剂,溶液由黄色突变为橙色即为ຫໍສະໝຸດ 点。 由反应式可知:实验原理
GB/T601《化学试剂实用标准滴定溶液的制备》注释

GB/T 601《化学试剂标准滴定溶液的制备》注释1概述标准滴定溶液是滴定分析和微量分析等的量值溯源,其主要用途是化工产品的主体含量和产品中杂质含量的测定。
在有机化工、无机化工、食品及食品添加剂、农药化肥、冶金、石油化工、日用化工等很多行业以及大专院校、科研院所的质量监督和检验工作中广泛应用。
标准滴定溶液的制备主要依据是GB/T 601《化学试剂标准滴定溶液的制备》2 GB/T 601—2002《化学试剂标准滴定溶液的制备》主要修改容2.1新增加的容2.1.1一般规定中增加了以下容:1)规定了滴定速度。
2)标准滴定溶液浓度平均值的扩展不确定度。
3)可使用二级纯度标准物质或定值标准物质代替工作基准试剂进行标定或直接制备,并在计算标准滴定溶液浓度值时,将其质量分数代入计算式中。
4)规定了标准滴定溶液贮存容器材料。
2.1.2标准滴定溶液的制备中增加以下容:1)重铬酸钾标准滴定溶液、碘酸钾标准滴定溶液、氯化钠标准滴定溶液、碘标准滴定溶液和硫氰酸钾标准滴定溶液标定方法增加了方法二;2)高氯酸标准滴定溶液配制方法中增加了方法二;3)增加了氢氧化钾--乙醇标准滴定溶液。
2.1.3附录中增加的容1)附录A中补充了碳酸钠标准滴定溶液、氢氧化钾-乙醇标准滴定溶液的补正值;2)附录B标准滴定溶液浓度平均值不确定度的计算。
2.2修改容——工作基准试剂称量的精确度;——工作基准试剂的质量;——工作基准试剂摩尔质量的有效位数;——标定重复性临界极差;——标定时的滴定体积和量取被标定溶液的体积;——氢氧化钠标准滴定溶液、硫代硫酸钠标准滴定溶液配制方法;——溴标准滴定溶液的基本单元;——乙二胺四乙酸二钠标准滴定溶液[c(EDTA)=0.05mol/L])的标定方法和[c(EDTA)=0.02mol/L]的计算式;——氯化锌标准滴定溶液、氯化镁标准滴定溶液、硫氰酸钠标准滴定溶液的标定方法。
2.3取消容——取消了原标准“3.6”和“3.7”条中有关“比较”的相关规定——取消了氢氧化钠标准滴定溶液、盐酸标准滴定溶液、硫酸标准滴定溶液、硫代硫酸钠标准滴定溶液、碘标准滴定溶液、高锰酸钾标准滴定溶液、硫酸铈标准滴定溶液、硫氰酸钠标准滴定溶液和硝酸银标准滴定溶液共九种的“比较”法。
常用酸碱浓度表

盐酸 HCl 质量 百分数 1 2 4 6 8 10 12 14 16 18 20
20 密度 d 4 / g.cm-3
100mL 水溶 液中含 HCl/g
HCl 质量 百分数 22 24 26 28 30 32 34 36 38 40
20 密度 d 4 / g.cm-3
100mL 水溶液 中含 HCl/g
1.004 2.018 3.044 4.080 5.128 10.54 16.26 22.30 28.67 35.40 42.49 49.85 57.52 65.50 73.66 82.00
1.3931 1.4134 1.4337 1.4521 1.4686 1.4826 1.4850 1.4873 1.4892 1.4912 1.4932 1.4952 1.4974 1.5008 1.5056 1.5129
氢氧化钠
NaOH 质 量百分数 1 2 4 6 8 10 12 14 16 18 20 22 24
20 密度 d 4 / g.cm-3
100mL 水溶液 中含 NaOH/g
NaOH 质 量百分数 26 28 30 32 34 36 38 40 42 44 46 48 50 碳酸钠
20 密度 d 4 / g.cm-3
100mL 中 游离 SO3/g
1.860 1.865 1.870 1.875 1.880 1.885 1.890 1.895
2.8 5.0 8.0 10.2 12.1 13.7 15.4 17.7
1.900 1.905 1.910 1.915 1.920 1.925 1.930 1.935
19.1 20.1 21.8 25.5 30.6 35.9 41.2 49.6
标准溶液‘配制’及‘标定’原始记录

标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:温度修正系数f(mL/L) (GB/T 601-2002 附录A)溶液体积 V(mL)CB(mol/L)平均值(mol/L)计算式:V=(V1-V0)×(1+f/1000)CB=1000m/(M×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度 %RH配制:取定溶 mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃ 、湿度: %RH 标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009.1-2003二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定。
2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0.0530]0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g2、数据配制人:复核人:配制日期:复核日期:稀释记录表标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理。
常用缓冲溶液的配制及氨基酸常数等
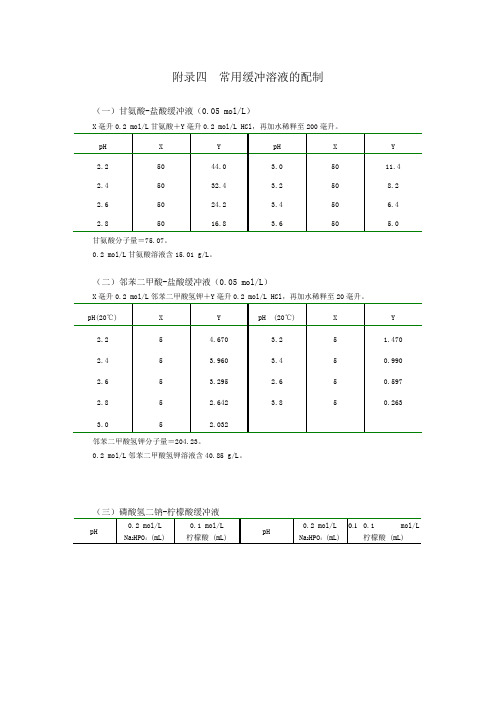
附录四常用缓冲溶液的配制(一)甘氨酸-盐酸缓冲液(0.05 mol/L)甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量=204.23。
0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。
①使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。
冰乙酸11.8 mL稀释至1 L(需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)(八)磷酸盐缓冲液Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。
NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。
巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。
酸碱指示剂的酸碱度范围选择和溶液浓度

酸碱指示剂的酸碱度范围选择和溶液浓度酸碱指示剂是一种常用于酸碱滴定反应中的物质,它可以通过改变颜色来指示溶液的酸碱性质。
在进行滴定实验时,选择合适的酸碱指示剂是十分重要的,因为它能够准确地反映溶液的酸碱度范围和浓度。
本文将探讨酸碱指示剂的酸碱度范围选择和溶液浓度对实验结果的影响。
酸碱指示剂的酸碱度范围选择是根据其酸碱性质和PH范围来确定的。
常见的酸碱指示剂有苏丹红、溴酚蓝、甲基橙等,它们分别对应着酸性、中性和碱性溶液。
首先是苏丹红,它是一种酸性指示剂,可以将酸性溶液的颜色变为红色。
苏丹红的酸碱度范围为PH 0-3,因此适用于酸性溶液的滴定实验。
对于酸碱中性或碱性溶液,苏丹红的指示效果较差。
其次是溴酚蓝,它是一种中性指示剂,会使中性溶液的颜色变为蓝色。
溴酚蓝的酸碱度范围为PH 6.0-7.6,因此适用于中性溶液的滴定实验。
对于酸性或碱性溶液,溴酚蓝的指示效果较差。
最后是甲基橙,它是一种碱性指示剂,可以将碱性溶液的颜色变为橙色。
甲基橙的酸碱度范围为PH 3.1-4.4,因此适用于碱性溶液的滴定实验。
对于酸性或中性溶液,甲基橙的指示效果较差。
除了酸碱度范围的选择,溶液浓度也对酸碱指示剂的使用产生影响。
一般来说,指示剂在浓度较低的溶液中呈现出较明显的颜色变化,而在浓度较高的溶液中颜色变化较为模糊。
例如,在进行酸碱滴定实验时,如果溶液浓度过高,就会导致指示剂颜色变化不明显,难以准确判断等价点。
因此,在实验中应当尽可能使用相对较低浓度的溶液,以确保可观察到明显的颜色变化。
此外,酸碱指示剂的选择还应考虑其化学稳定性和溶解性。
指示剂应具有良好的稳定性,不易受到光、热或其他因素的影响而发生变化。
溶解性也是一个重要的考虑因素,以确保指示剂能够充分溶解在溶液中,不会出现沉淀现象。
综上所述,选择合适的酸碱指示剂对于酸碱滴定实验的准确性和可靠性至关重要。
在选择酸碱指示剂时,应根据需求确定所需的酸碱度范围,并考虑溶液的浓度、化学稳定性和溶解性等因素。
GB/T 601《化学试剂标准滴定溶液的制备》注释

GB/T 601《化学试剂标准滴定溶液的制备》注释1概述标准滴定溶液是滴定分析和微量分析等的量值溯源,其主要用途是化工产品的主体含量和产品中杂质含量的测定。
在有机化工、无机化工、食品及食品添加剂、农药化肥、冶金、石油化工、日用化工等很多行业以及大专院校、科研院所的质量监督和检验工作中广泛应用。
标准滴定溶液的制备主要依据是GB/T 601《化学试剂标准滴定溶液的制备》2 GB/T 601—2002《化学试剂标准滴定溶液的制备》主要修改内容2.1新增加的内容2.1.1一般规定中增加了以下内容:1)规定了滴定速度。
2)标准滴定溶液浓度平均值的扩展不确定度。
3)可使用二级纯度标准物质或定值标准物质代替工作基准试剂进行标定或直接制备,并在计算标准滴定溶液浓度值时,将其质量分数代入计算式中。
4)规定了标准滴定溶液贮存容器材料。
2.1.2标准滴定溶液的制备中增加以下内容:1)重铬酸钾标准滴定溶液、碘酸钾标准滴定溶液、氯化钠标准滴定溶液、碘标准滴定溶液和硫氰酸钾标准滴定溶液标定方法增加了方法二;2)高氯酸标准滴定溶液配制方法中增加了方法二;3)增加了氢氧化钾--乙醇标准滴定溶液。
2.1.3附录中增加的内容1)附录A中补充了碳酸钠标准滴定溶液、氢氧化钾-乙醇标准滴定溶液的补正值;2)附录B标准滴定溶液浓度平均值不确定度的计算。
2.2修改内容——工作基准试剂称量的精确度;——工作基准试剂的质量;——工作基准试剂摩尔质量的有效位数;——标定重复性临界极差;——标定时的滴定体积和量取被标定溶液的体积;——氢氧化钠标准滴定溶液、硫代硫酸钠标准滴定溶液配制方法;——溴标准滴定溶液的基本单元;——乙二胺四乙酸二钠标准滴定溶液[c(EDTA)=0.05mol/L])的标定方法和[c(EDTA)=0.02mol/L]的计算式;——氯化锌标准滴定溶液、氯化镁标准滴定溶液、硫氰酸钠标准滴定溶液的标定方法。
2.3取消内容——取消了原标准“3.6”和“3.7”条中有关“比较”的相关规定——取消了氢氧化钠标准滴定溶液、盐酸标准滴定溶液、硫酸标准滴定溶液、硫代硫酸钠标准滴定溶液、碘标准滴定溶液、高锰酸钾标准滴定溶液、硫酸铈标准滴定溶液、硫氰酸钠标准滴定溶液和硝酸银标准滴定溶液共九种的“比较”法。
