高中化学总复习 物质的量在化学方程式计算中的应用教学案
物质的量在化学方程式计算中的应用(整理)

V(Cl2)=n(Cl2)Vm=0.26mol×22.4L·mol-1=5.8L
答:参加反应的浓HCl的体积为0.087L,生成Cl2的体积在标况下为5.8L.
解法二:
解:(1)MnO2的摩尔质量为87g·mol-1
4HCl(浓)+MnO2 MnCl2+Cl2+H2O↑
41
(1)收集到的H2S气体的体积(标准状况);(2)溶液中Fe2+和H+的物质的量浓度.
【答案:(1)1.8L;(2)Fe2+:0.50mol/L;H+:1.0mol/L.】
13.取一定量的纯MnO2和纯KClO3混合加热,充分反应后将剩余固体与足量的浓盐酸混合加热,反应完毕后,将溶液蒸干,得到固体质量与原混合物质量相等,求MnO2在原混合物中的质量分数.【答案:46.7%.】
n(HCl)0.26mol
n(HCl)= =1.04molV[HCl(aq)]= =0.087L
(2)4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑
1mol2.4?L
0.26molV(Cl2)
V(Cl2)= =5.8?L
答:参加反应的浓HCl的体积为0.087L,生成Cl2的体积在标况下为5.8L.
?4.400mL某浓度的NaOH溶液恰好与5.8LCl2(标准状况)完全反应,计算:
(1)生成NaClO的物质的量.(2)该溶液中NaOH的物质的量浓度.
【答:(1)NaClO的物质的量是0.26mol.(2)NaOH的物质的量浓度是1.3mol·L-1】
5.用8.7gMnO2与100g36.5%的浓盐酸反应,消耗盐酸的物质的量是多少?产生Cl2在标况下的体积是多少?未参加反应的HCl的质量是多少?
请大家分析比较以下几种解法.
《物质的量在化学方程式计算中的应用》教案

《物质的量在化学方程式计算中的应用》教案【学习目标】1.基于物质的量认识化学变化;2.掌握物质的量在化学方程式计算中的应用。
【学习过程】环节一:温故知新,承前启后化学方程式中的化学计量系数可以明确表示出化学反应中粒子之间的数目关系。
2Na+2H2O=== 2NaOH+H2↑化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1扩大6.02×1023倍2×6.02×1023∶2×6.02×1023∶2×6.02×1023∶1×6.02×1023物质的量之比____ mol ∶____ mol ∶___ mol ∶___mol 结论:化学方程式中各物质的______之比等于各物质的化学计量数之比。
环节二:实例切入,新知突破例题:250 mL 2 mol·L-1的硫酸与足量的铁屑完全反应。
计算:(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
请及时记录自主学习过程中的疑难:环节三:运用计算,思维发散医疗上颇为流行的“理疗特效热”,就是利用铁粉缓慢氧化成Fe2O3并放出均匀、稳定的热,使患处保持温热状态。
若56 g铁粉完全氧化成氧化铁,则需要消耗标况下氧气的体积为多少?牛刀小试:某化学实验室准备用一定量的Fe与足量的1 mol/L的H2SO4溶液反应来制取H2。
若要制得2.24 L H2(标况),试计算:(1)参加反应的H2SO4的物质的量。
(2)参加反应的Fe的质量。
(Fe:56)把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,那么参加反应的CO的质量是 g。
(CaCO3:100 CO:28)即时小练:用足量的CO还原Fe2O3,将所生成的气体通入足量澄清石灰水中,得到的沉淀为60 g,则Fe2O3的质量是( )A.16 g B.32 gC.64 g D.80 g环节四:归纳总结,习题巩固利用化学方程式进行计算的步骤:(1)审题并设有关物理量(n、m、V)(2)写出正确的化学方程式(3)在方程式有关物质的化学式下方标出相关物理量注意:注意左右比例相当,上下单位一致(4)列出正确比例式求解【学习效果】一、单项选择题1.标准状况下,2.7 g铝与足量的盐酸反应生成a L的氢气,化学方程式比例关系正确的是()A.2Al+ 6HCl =2AlCl3 +3 H2↑2 mol 67.2 L2.7 g a LB.2Al+ 6HCl =2AlCl3 +3 H2↑27 g 22.4 L2.7 g a LC.2Al+ 6HCl =2AlCl3 +3 H2↑54 g 67.2 L2.7 g a LD.2Al+ 6HCl =2AlCl3 +3 H2↑54 g 3 mol2.7 g a L2.有关反应2Na+2H2O===2NaOH+H2↑的下列说法正确的是()A.反应中Na与NaOH的质量相等B.反应中H2O和H2的质量相等C.反应中H2O和H2的质量比为2∶1D.反应中Na与NaOH的物质的量之比为1∶13.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )。
教案化学高中物质的量

教案化学高中物质的量
教学目标:
1. 了解物质的量和摩尔的概念;
2. 掌握物质的量和物质的量的定律;
3. 能够运用物质的量进行化学计算。
教学内容:
1. 物质的量的概念和单位;
2. 摩尔的概念和摩尔质量;
3. 物质的量与质量、体积的关系;
4. 物质的量和化学方程式;
5. 物质的量在化学计算中的应用。
教学重点和难点:
重点:物质的量和摩尔的概念,物质的量的定律。
难点:物质的量在化学计算中的应用。
教学方法:
1. 讲授结合示例分析;
2. 讨论互动,引导学生思考问题;
3. 实验实践,提升学生实践能力。
教学步骤:
1. 引入:通过实际生活中的例子引入物质的量和摩尔的概念;
2. 讲授:介绍物质的量和摩尔的概念,以及物质的量的定律;
3. 案例分析:通过案例分析,让学生掌握物质的量和化学方程式之间的关系;
4. 实验:进行相关实验,让学生通过实践加深理解;
5. 巩固练习:布置相关练习,让学生巩固知识点;
6. 总结归纳:总结本节课内容,引导学生思考。
教学资源:
1. 课件;
2. 实验器材。
教学评价:
1. 学生课堂表现;
2. 练习成绩;
3. 实验报告。
教学反思:
1. 学生对物质的量概念和摩尔概念的掌握程度;
2. 学生解题能力。
以上是本节化学课程的教案,希望能够对您的教学工作有所帮助。
祝您教学顺利!。
物质的量在化学方程式的计算中的应用

第3课时物质的量在化学方程式计算中的应用【新课导入】在初中时同学们就已经知道化学反应中各反应物和生成物之间符合一定的关系,通过第一章的学习,我们又知道了构成物质的粒子数与物质的质量之间可用物质的量作桥梁联系起来,既然化学反应中各物质的质量之间符合一定的关系,那么,化学反应中构成各物质的粒子数之间,物质的量之间又遵循什么关系呢?物质的量在化学方程式计算中有何应用呢?【教材讲解】一、复习回顾写出下列反应的化学方程式,是氧化还原反应的,指出氧化剂、还原剂,是离子反应的,再写出离子方程式。
学生书写方程式。
新课导入:由金属共同的化学性质可知,金属能与氧气反应,较活泼金属能与酸反应,而金属与碱能否反应呢?今天我们来探究少数金属与强碱的反应。
金属铝是当今世界产量最高、用途最广的有色金属,请同学们归纳总结你学过的有关铝的知识。
学生归纳整理,回答。
归纳整理:有导热性、导电性、延展性。
能与氧气反应生成一层致密的氧化膜,与酸反应生成氢气。
二、新课教学过渡:下面我们通过实验学习铝的另一点性质。
实验探究:1.取2支小试管分别加入5mL盐酸和5mLNaOH溶液,再分别放入一小段铝片,观察现象。
2.将点燃的木条分别放在两支试管口,观察现象。
学生观察并描述实验现象,思考实验现象产生的原因,分析铝的性质。
交流讨论,写出有关化学方程式。
归纳整理并板书:(三)铝与氢氧化钠溶液的反应1.与酸反应产生氢气——金属性2Al+6HCl=2AlCl3+3H2↑2.与碱反应产生氢气——特性2Al+2NaOH+2H2O=2NaAlO2+3H2↑思考与交流:使用铝制餐具应注意哪些问题?学生交流回答。
解释:使用铝制餐具应避免长时间盛放酸性或碱性食物。
思考与交流:从氧化还原反应的角度分析,金属在参加化学反应时通常表现出什么性质?学生思考交流回答。
归纳整理:通过分析,我们知道金属在参加化学反应时,化合价都发生了变化,且都从单质变为化合态阳离子,表现出较强的还原性。
高中化学《物质的量应用于化学方程式的计算》教案设计2套

第四章卤素第三节物质的量应用于化学方程式的计算第一部分教材分析及处理一、教学目的要求1.使学生掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式。
2.使学生加深对物质的量、物质的量浓度、气体摩尔体积等概念的理解,及对化学反应规律的认识。
3.培养学生综合运用知识的能力和综合计算能力。
4.通过化学方程式的计算,培养学生理论联系实际的严谨求实的科学作风。
二、教学重点、难点有关化学方程式的计算问题实际上学生在初中阶段就已经学习过了。
通过初中的学习,学生已经知道了化学反应中反应物和生成物之间质量的关系,并学习了运用方程式进行有关质量的计算。
这里就出现了一个弊端,人们往往有先入为主的观念,如何由质量转为物质的量成了这一节及今后很长一段时间内的主要问题。
根据本人在教学中的观察,很多学生在进行物质的量的计算时,往往先算质量,再进行一道转换,这是由枝叶求根本的途径,而且费时、费力、易出错。
因此,如何尽快地让学生会在方程式的计算中以物质的量为核心成了这一章的重点和难点。
三、我们的对策好在在教材的编排上,我们看见了编者的苦心。
将物质的量应用于方程式的计算安排在这一章,主要是分散了前一章的难点。
在前一章中学习了物质的量、微粒数量、物质质量、气体摩尔体积、物质的量浓度之间的关系和换算后,再将它们应用于方程式中的计算集中安排在一节,也有利于学生对有关知识和技能的理解、掌握和记忆。
这是我们的有利条件之一。
我们的有利条件之二是,课本中安排的三道例题很有特色。
为了进一步降低难度,三道例题都分成了两问,分散了难度;且三个例题在概念上是综合性依次增强,起到了循序渐进的效果。
最后,我们在教学过程中应在适当的地方不动声色地复习物质的量、微粒数量、物质质量、气体摩尔体积、物质的量浓度之间的关系和换算,起到强化物质的量才是核心的作用,使学生避免一提方程式的计算就不自觉地采用质量计算的习惯。
四、课时安排2课时第一课时注重于旧习惯的破除,新习惯的养成及标准的格式。
物质的量在化学方程式计算中的应用教学设计

【导言】1. 引出话题:化学方程式的计算是化学学习中的基础知识,其中涉及到物质的量的概念和计算方法。
2. 阐述重要性:物质的量在化学方程式计算中占据着重要地位,是化学反应中质量和摩尔数之间的联系。
3. 提出问题:如何合理设计物质的量在化学方程式计算中的教学,引导学生正确理解和运用该知识?【正文】一、认识物质的量1. 定义:物质的量是指物质中包含的基本粒子(原子、离子、分子)的数量,通常以摩尔(mol)为单位表示。
2. 摩尔的概念:1摩尔的物质含有6.02×10^23个基本粒子,称为阿伏伽德罗常数。
3. 物质的量与质量的关系:物质的量和质量是两个不同的概念,但二者之间存在着确定的关系。
根据不同物质的摩尔质量可以换算出不同物质的质量。
二、化学方程式中的物质的量计算1. 化学方程式的基本概念:化学方程式是用化学符号表示化学反应的过程,包括反应物、生成物和反应条件等信息。
2. 物质的量与化学方程式:在化学方程式中,物质的量可以通过系数表示,系数的大小代表了反应物和生成物的摩尔数关系。
3. 物质的量计算的方法:根据化学方程式中物质的量比例关系,可以通过已知物质的量计算出其他物质的量。
三、教学设计1. 立足实际案例:通过生活中的化学反应案例,如燃烧反应、中和反应等,引出物质的量的概念及其在化学方程式计算中的应用。
2. 引导学生思考:提出问题,引导学生思考如何根据化学方程式中的物质的量计算其他物质的量,并进行实际运用。
3. 系统化知识点讲解:对物质的量的概念、单位、计算方法等知识进行系统化讲解,让学生建立完整的认识。
4. 合理安排练习:设计一定难度的物质的量计算练习题,包括单一化学方程式和复合化学方程式的计算。
5. 实验结合:组织相关实验,通过实验数据的统计和计算,加深学生对物质的量在化学方程式计算中的理解。
6. 互动讨论:在教学过程中,鼓励学生提问并进行答疑,增强互动,促进知识的深入理解和应用。
【结论】1. 总结重点:物质的量在化学方程式计算中的应用是化学学习中的重要内容,能帮助学生建立化学知识体系,提高化学计算能力。
高一化学上学期物质的量在化学方程式计算中的应用教案

物质的量在化学方程式计算中的应用教案授课课题:四、物质的量在化学方程式计算中的应用授课课时:一课时授课形式:新授使用教具:多媒体教学目标:1、使学生掌握物质的量、气体摩尔体积应用于化学方程式的计算方法和格式。
2、培养学生综合运用知识的能力和综合计算能力。
教学重点:物质的量、气体摩尔体积在化学方程式计算中的应用。
教学难点:物质的量、气体摩尔体积在化学方程式计算中的应用。
教学过程:一、【复习引入】初中已学过化学反应式中反应物和生成物之间的质量关系,并能运用于化学方程式有关质量的计算。
在这节课中我们将学习物质的量、气体摩尔体积在化学方程式计算中的应用。
【课堂练习】把克Fe放入足量的盐酸中,铁完全反应。
计算生成氢气的质量。
【提问】根据氢气的质量计算出氢气的物质的量和标准状况下的体积各是多少【师】如何把物质的量运用于化学方程式中呢二、新授【板书】2Na+ 2H2O=2NaOH+H2化学计量数之比 2 : 2 2 :1物质的量之比2 mol:2 mol2 mol:1 mol 【师】由此可以看出,化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,因此物质的量、气体摩尔体积可用于化学方程式计算。
【板书】例:把克Fe放入足量的盐酸中,铁完全反应。
计算:(1)参加反应盐酸的物质的量;(2)生成氢气的体积(标准状况)【分析】根据题中所给条件,可直接应用化学方程式中各物质的计量数之比等于物质的量之比,计算出参加反应盐酸的物质的量和生成氢气的体积【板书】解: (1)Fe + 2HCl = FeCl 2 + H 2↑56 2 moln(HCl)n(HCl)mol 26.556=g n(HCl)= mol (2) Fe + 2HCl = FeCl 2 + H 2↑56g V(H 2))v(H 4.226.5562L g = V(H 2)= 答:(1)参加反应盐酸的物质的量是 mol(2)生成氢气在标准状况下体积是【课堂练习】 g 金属钠投入到一定量水中,完全反应后,计算:(1)生成氢氧化钠的物质的量;(2)生成氢气的体积(标准状况)三、【小结】化学方程式的计算主要步骤:(1)正确书写化学方程式;(2)列比例关系,单位要求:上下一致,左右相当四、【布置作业】 p54 8、9【教学后记】多媒体(幻灯):【课堂练习】把克Fe放入足量的盐酸中,铁完全反应。
(第3课时 物质的量在化学方程式计算中的应用)
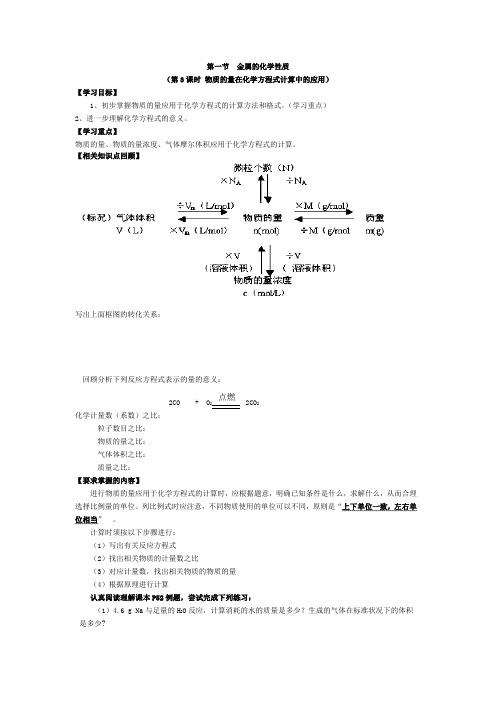
第一节金属的化学性质(第3课时物质的量在化学方程式计算中的应用)【学习目标】1、初步掌握物质的量应用于化学方程式的计算方法和格式。
(学习重点)2、进一步理解化学方程式的意义。
【学习重点】物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算。
【相关知识点回顾】写出上面框图的转化关系:回顾分析下列反应方程式表示的量的意义:点燃2CO + O2 2CO2化学计量数(系数)之比:粒子数目之比:物质的量之比:气体体积之比:质量之比:【要求掌握的内容】进行物质的量应用于化学方程式的计算时,应根据题意,明确已知条件是什么,求解什么,从而合理选择比例量的单位。
列比例式时应注意,不同物质使用的单位可以不同,原则是“上下单位一致,左右单位相当”。
计算时须按以下步骤进行:(1)写出有关反应方程式(2)找出相关物质的计量数之比(3)对应计量数,找出相关物质的物质的量(4)根据原理进行计算认真阅读理解课本P52例题,尝试完成下列练习:(1)4.6 g Na与足量的H2O反应,计算消耗的水的质量是多少?生成的气体在标准状况下的体积是多少?(2)将6.5g锌放入足量的稀硫酸中充分反应,得到80mL溶液。
试计算所得溶液中硫酸锌的物质的量浓度。
一、金属与非金属的反应〖典例解析〗例1、向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应后,计算:(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和原溶液物质的量浓度。
(3)生成标准状况下H2的体积。
例2、把5.1g镁铝合金的粉末放入到过量的盐酸中,得到5.6LH2(标准状况)。
试计算:(1)该合金中铝的质量分数;(2)该合金中铝和镁的物质的量之比。
〖课堂练习〗1、0.16gNaOH恰好与20mL的盐酸完全反应,则盐酸的物质的量浓度为()A.0.1mol·L-1 B.0.2mol·L-1 C.0.5mol·L-1 D.1mol·L-12、足量CaCO3跟40mL 5mol/L的盐酸充分反应后。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
江苏省邳州市第二中学高中化学总复习教学案:物质的量在化学方程式计算中的应用新课指南1.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式计算中的计算方法和格式.2.加深对物质的量、物质的量浓度、气体摩尔体积等概念的理解以及对化学反应规律的认识.3.培养综合运用知识的能力和综合计算能力.本节重点:物质的量、物质的量浓度、气体摩尔体积应用于化学方程式中的计算. 本节难点:物质的量、物质的量浓度、气体摩尔体积应用于化学方程式中的计算.教材解读精华要义相关链接1.化学方程式的意义化学方程式是用化学式表述化学反应事实的化学专业语言,它可以表示什么物质参加反应、反应的条件是什么以及生成了什么物质.它还可以表示反应物和生成物的质量之比、微粒个数之比、气体体积之比等含义.例如: 2H 2+O 2点燃=2H 2O(g)分子个数比 2 : 1 : 2 气体体积比 2 : 1 : 2物质质量比 4 g : 32g : 36 g2.物质(B)的物质的量与其他化学量之间的关系[说明] ①物质的量浓度(c)与溶质的质量分数(w)之间的关系为: c(B)=)()()([/1000B M B w aq B L mL ⨯⨯ρ或w(B)=c(B)×)]([·1000)(1aq B L mL B M ρ⨯- ②重要的转换关系式: a.n =Mm b.n =AN N(N 表示微粒数,N A 表示阿伏加德罗常数) c.n =mV V(V m 表示标准状况下气体摩尔体积) d.c =)(aq V m[V(aq)表示溶液的体积]e.ρ=Vm(ρ表示溶液的密度) f.w=)()(溶液溶质m m ×100%知识详解知识点1 化学计量数及其应用Ⅰ化学计量数化学计量数就是化学方程式(或离子方程式)中各反应物或生成物的化学式前面的数字(若为1时常常省略).对于任意物质B 来说,化学计量数的符号为γ(B),单位为1,通常不需写出.如:化学方程式 2H 2+O 2点燃=2H 2O化学计量数(γ) 2 1 2Ⅱ化学计量数与各物质的物质的量的关系 物质是由原子、分子或离子等粒子组成的,物质之间的化学反应也是这些粒子按一定的数目关系进行的.化学方程式可以明确地表示出化学反应中这些粒子之间的数目关系.这些粒子之间的数目关系,也就是化学计量数γ的关系.如: 2H 2 + O 2 点燃= 2H 2O化学计量数γ之比 2 : 1 : 2扩大6.02×1023倍2×6.02×1023 : 1× 6.02×1023 : 2×6.02×1023物质的量之比 2 mol : 1 mol : 2 mol从这个例子中,我们可以看出,化学方程式中各物质的化学计量数之比,等于各物质的物质的量之比.因此,将物质的量(n)、摩尔质量(M)、摩尔体积(V m )、物质的量浓度(c)等概念应用于化学方程式进行计算时,对于定量研究化学反应中各物质之间的量的关系,会更加方便.知识点2 物质的量应用于化学方程式的计算(重点)Ⅰ化学计算的一般步骤(难点)进行化学计算,一般按以下三步进行:第一步:认真审题,根据题意书写正确的化学方程式.第二步:深入分析题,充分认清已知条件和未知问题,运用概念分析和列化学方程式,找出已知条件和未知问题之间的联系,设计出正确的解题思路.第三步:规范解题,具体完成该题的计算,应该做到解题要有根据,解法正确,书写工整,计算结果准确,要有明确的回答,以及必要的分析和讨论. 在上述三个解题步骤中,设计解题思路最为重要. Ⅱ物质的量用于化学计算的基本方法 物质的量用于化学计算的基本方法是:首先把已知物的物理量转化为物质的量;其次根据化学方程式或关系式,根据已知物的物质的量求出未知物的物质的量;最后把未知物的物质的量转化为未知物的所求物理量.当熟练掌握了物质的量运算的技能技巧时,上述计算过程还可以进一步简化.Ⅲ 物质的量用于化学计算的分类指导 (1)简单的基本计算例如:完全中和0.10 mol NaOH 需要H 2SO 4的物质的量是多少?所需H 2SO 4的质量是多少? 〔分析〕本题可先求H 2SO 4的物质的量,再求H 2SO 4的质量. 解:2NaOH + H 2SO 4=Na 2SO 4+2H 2O2 10.01mol n(H 2SO 4),)()()()(4242SO H n NaOH n SO H NaOH =γγm(H 2SO 4)=,050.0210.01mol mol=⨯m(H 2SO 4)= M(H 2SO 4)×n (H 2SO 4)=0.050mol ×98g/mol=4.9g.答:完全中和0.10 mol NaOH 需要0.050 mol H 2SO 4,所需H 2SO 4的质量为4.9 g. 小结 解题的基本步骤为:①写出有关反应的化学方程式;②建立比例或列出数学方程式;③解方程求出未知量;④答.(2)已知固体质量,求某物质的物质的量例如:将4.35 gMnO 2与足量浓盐酸混合加热反应,求参加反应的HCl 的物质的量. 〔分析〕 MnO 2与浓盐酸加热反应的化学方程式为: MnO 2+4HCl ∆=MnCl 2+Cl 2↑+2H 2O在该反应中,参加反应的MnO 2与HCl 的物质的量之比为: n(MnO 2):n(HCl)=1 mol:4 mol.1 mol MnO 2的质量是87g ,若用87g MnO 2代换1 mol MnO 2,则以下比例式仍然成立: m(MnO 2):n(HCl)=87 g:4 mol.因此,本题可将物质的质量和物质的量直接应用于化学方程式的计算,一步即可求得HCl 的物质的量.解:MnO 2+4HCl(浓) ∆=MnCl 2+Cl 2↑+2H 2O 87 g 4 mol 4.35 g n(HCl),)(35.4487HCl n g mol g =n(HCl)=ggm ol 8735.44⨯=0.2mol. 答:参加反应的HCl 是0.2 mol.(3)已知固体质量,求生成气体的体积例如:将6.525gMnO 2与足量的浓盐酸混合加热反应,求生成的Cl 2在标准状况下的体积是多少?〔分析〕在MnO 2与浓盐酸的反应中,参加反应的MnO 2与生成的Cl 2的物质的量之比为n(MnO 2):n(Cl 2)=1 mol:1 mol.1 mol Cl 2在标准状况下的体积为22.4 L ,l mol MnO 2的质量为87 g ,若用 22.4 L Cl 2代换1 mol Cl 2,用87 g MnO 2代换1 mol MnO 2,则以下比例仍然成立: m(MnO 2):V[Cl 2(g)]=87g:22.4L 因此,本题可将物质的质量和气体的摩尔体积直接应用于化学方程式的计算,直接求得Cl 2的体积.解:MnO 2+4HCl(浓) ∆=MnCl 2+Cl 2↑+2H 2O 87 g 22.4 L 6.525 g V(Cl 2) V(Cl 2)=gLg 874.22525.6⨯=1.68L.答:生成的Cl 2在标准状况下的体积是1.68L.小结 ①在将物质的质量、物质的量、气体的体积中的不同种物理量同时应用于根据化学方程式的计算时,在化学方程式下列出物理量,必须符合“左右数量相当,上下单位相同”的基本原则.左右是否成正比的判断是个难点问题,解决的办法就是看两个物理量之比转化成物质的量之比时,是否等于化学计量数之比.下列几种情况值得参考、借鉴(下表中气体体积均为标准状况下的值).2C + O 2 ∆= 2CO 化学方程式2 1 2 化学计量数 2mol 1mol n(C)与n(O 2)成正比 24g 22.4L m(C)与V (O 2)成正比 1mol 44.8L n (O 2)与V (CO )成正比 22.4L 44.8L V(O 2)与V (CO )成正比 24kg 44.8m 3m (C)与V (CO )成正比 0.024kg 1molm (C)与n(O 2)成正比 24t44.8×106Lm(C)与V (CO )成正比②在建立比例或方程式时,必须以实际反应的纯净物的量进行计算,如溶液中溶质、混合物中的有关物质的质量等.(4)根据化学方程式,挖掘隐含条件进行分析计算在化学反应的计算题中,往往不是直接给出相关的量,而是用其他的量以信息的形式给出,让我们把信息和已学过的知识相联系挖掘新的关系量.如Fe 和CuSO 4溶液反应,我们就可能挖掘出金属增多的质量和溶液减少的质量. Fe+CuSO 4=FeSO 4+Cu △m(金属) △m(溶液) 56g 1 mol 1mol 64g 8g 8g这种方法叫“差量法”.用此法可以挖掘出质量差、物质的量差、标准状况下气体的体积差等变化量,使计算过程简单快捷.当然我们还可以应用其他方法(如平均值法、换元法、等效法、设“1”法等)挖掘新的关系量. 例如:现有KCl 和KBr 的混合物3.87 g ,将混合物全部溶于水中,并加入过量的AgNO 3溶液,充分反应后产生6.63g 沉淀物,则原混合物中钾元素的质量分数为 ( ) A.24.1% B.25.9% C.40.3% D. 48.1% 〔分析〕 如果设KCl 和KBr 的质量分别为一未知数,并根据反应的化学方程式与AgCl 和AgBr 联立解方程,也能求得KCl 和KBr 的质量,进而求得K 元素的质量分数.分析题意知溶质是KCl 和KBr ,而沉淀足AgCl 和AsBr ,而n(KCl)=n(AgCl),n(KBr)=n(AgBr),溶质的质量和沉淀的质量的差为6.63 g-3.87 g=2.76 g ,质量的增加原因是将溶质中的K +换成了沉淀中的Ag +,那么我们就挖掘出 了一个新的关系量.1 mol K +被1 mol Ag +取代后,产物的质量增加69gK +~Ag +△m39 g 108g 69 g Xg 2.76g ∴x=.56.1693976.2g ggg =⨯则混合物中钾元素的质量分数为%.3.40%10087.356.1=⨯gg答案:C(5)综合计算题对于复杂的综合计算题,解题的关键是要理清各种物理量之间的相互关系,此时以摩尔为单位,可以使有关问题变得简捷、明了.即先把已知量转化为物质的量,然后依据化学方程式进行分析计算.例如:硝酸与Zn 反应的化学方程式如下: 5Zn+12HNO 3=5Zn(NO 3)2+N 2↑+6H 2O 当消耗Zn 13g 时,求: (1)消耗硝酸多少摩尔?(2)被还原的硝酸的物质的量为多少? (3)产生氮气多少克? (4)转移电子数为多少?〔分析〕 本题反应属于氧化还原反应,且必须应用物质的量的关系进行计算.首先将已知量“摩尔化”,可以使解题思路清晰、明了. 解:(1)消耗Zn 的物质的量:n(Zn)=.2.0·65131mol mol g g=-5Zn+12HNO 3=5Zn(NO 3)2+N 2↑6H 2O 5mol 12mol 1mol 0.2mol n (HNO 3)总 n(N 2) 5mol:12mol=0.2mol:n(HNO 3)总, n(HNO 3)总=.48.05122.0mol molmolmol =⨯(2)被还原的硝酸的物质的量为: n(HNO 3)=n(HNO 3)总×61=0.48mol ×61=0.08mol. (3)产生氮气的物质的量为n(N 2)=1×0.2 mol/5=0.04 mol , 产生氮气的质量为:m(N 2)=28 g/mol ×0.04 mol =1.12 g.(4)5 mol Zn 完全反应,转移电子的物质的量为5 mol ×2=10 mol ,则 5 mol:10 mol =0.2 mol:n(e -), 转移电子的物质的量: n(e -)=,4.052.010mol molmolmol =⨯转移电子数:0.4 mol ×6.02×1023mol -1=2.408×1023. 答:略.[说明]HNO 3跟Zn 等金属反应时,HNO 3起两个作用:一部分作氧化剂,参与氧化还原反应,生成物中N 2能证明这一点;一部分作酸性 试剂,其特征是生成物中有Zn(NO 3)2.。
