一株产淀粉酶_蛋白酶益生芽孢杆菌的分离与鉴定
产淀粉酶菌株的分离与纯化

产淀粉酶菌株的分离与纯化一、实验目的和内容目的:掌握用平板稀释法分离得到微生物纯种的方法内容:分离产淀粉酶的芽孢杆菌二、实验原理土壤是微生物生活的大本营,因此可以从土壤中分离、纯化有价值的菌株。
从混杂的微生物群体中获得只含有某一种或某一株微生物的过程称为微生物的分离与纯化。
平板分离法是常用的方法,该方法操作简便,普遍用于微生物的分离与纯化。
其基本原理包括两个方面:(1)选择适合于待分离微生物的生长条件,如营养、酸碱度、温度和氧等条件,或加入某种底物、抑制剂造成只利于该微生物生长而一直其他微生物生长的环境,从而淘汰一些不需要的微生物。
(2)微生物在固体培养基上生长形成的单个菌落可以是由一个细胞繁殖而成的集合体。
因此可通过挑取单菌落儿获得一种纯培养,获取单个菌落的方法可通过稀释涂布平板技术来完成。
(3)纯化方法:平板划线法,即将一个平板分成四个不同面积的小区进行划线,第一区(A区)面积最小,作为待分离菌的菌源区,第二和第三区(B、C 区)是逐级稀释的过渡区,第四区(D区),则是关键区,使该区出现大量的单菌落以供挑选纯种用。
为了得到较多的典型单菌落,平板上四区面积的分配应是D﹥C﹥B﹥A。
三、实验材料1.土样2. 牛肉膏蛋白胨培养基:牛肉膏1.5g、蛋白胨15g、NaCl 2.5g、琼脂10g、2%可溶性淀粉10g、无菌水1000ml、PH7.4-7.63.试剂与材料用具:无菌水烧杯、玻璃管、涂布棒、无菌吸管、移液枪、玻璃棒、接种环、无菌培养皿、三角烧瓶、量筒、培养基分装器、天平、药匙、PH试纸、高压蒸汽灭菌锅、酒精灯、棉花、牛皮纸、记号笔,橡皮筋等。
四、实验步骤(一)稀释涂布平板法1.制备培养基2.倒平板将牛肉膏蛋白胨培养基加热融化,待冷至55~60℃时,倒平板。
3.制备土壤菌悬液称取土样10g放入盛有90ml无菌水的烧杯中,搅拌均匀。
用一支无菌吸管从中吸取1ml土壤悬液加入盛有9ml无菌水的试管中充分混匀,然后用无菌吸管从中吸取1ml加入另一支盛有9ml无菌水的试管中,充分混匀,以此类推制成10ˉ1,10ˉ2,10ˉ3,10ˉ4,10ˉ5,10ˉ6不同稀释度的土壤溶液。
产淀粉酶菌株的筛选及生理生化性质的鉴定

产淀粉酶菌株的筛选及生理生化性质的鉴定一实验目的及要求:为了从自然界获得产淀粉酶活力较高的菌株,从面粉、储存面仓、发霉玉米等样品中筛选出1株产淀粉酶活力较强的菌,并对产淀粉酶菌的生理生化进行了探讨。
从面粉中得到的产淀粉酶菌共有三种,颜色有红色和白色。
从其菌体形态初步了解其特征,随后用唯一碳源实验、葡萄糖酵解实验、过氧化氢酶实验等分析并鉴定其生理生化特性。
二名词定义:淀粉酶分离鉴定淀粉酶 amylase,AMY,AMS一般作用于可溶性淀粉、直链淀粉、糖元等α-1,4-葡聚糖,水解α-1,4-糖苷键的酶。
根据酶水解产物异构类型的不同可分为α-淀粉酶(EC3.2.1.1.)与β-淀粉酶(EC3.2.1.2.)。
α-淀粉酶广泛分布于动物(唾液、胰脏等)、植物(麦芽、山萮菜)及微生物。
微生物的酶几乎都是分泌性的。
此酶以Ca2+为必需因子并作为稳定因子,既作用于直链淀粉,亦作用于支链淀粉,无差别地切断α-1,4-链。
因此,其特征是引起底物溶液粘度的急剧下降和碘反应的消失,最终产物在分解直链淀粉时以麦芽糖为主,此外,还有麦芽三糖及少量葡萄糖。
另一方面在分解支链淀粉时,除麦芽糖、葡萄糖外,还生成分支部分具有α-1,6-键的α-极限糊精。
一般分解限度以葡萄糖为准是35-50%,但在细菌的淀粉酶中,亦有呈现高达70%分解限度的(最终游离出葡萄糖)。
β-淀粉酶与α-淀粉酶的不同点在于从非还原性末端逐次以麦芽糖为单位切断α-1,4-葡聚糖链。
主要见于高等植物中(大麦、小麦、甘薯、大豆等),但也有报告在细菌、牛乳、霉菌中存在。
对于象直链淀粉那样没有分支的底物能完全分解得到麦芽糖和少量的葡萄糖。
作用于支链淀粉或葡聚糖的时候,切断至α-1,6-键的前面反应就停止了,因此生成分子量比较大的极限糊精。
从上述的α-淀粉酶和β-淀粉酶的作用方式,分别提出α-1,4-葡聚糖-4-葡萄糖水解酶(α-1,4-glucan 4-glucanohydrolase)和α-1,4-葡聚糖-麦芽糖水解酶(α-1,4-glucan maltohydrolase)的名称等而被使用。
一株产纤维素酶益生芽孢杆菌的筛选与鉴定

株产纤维素酶益生芽孢杆菌的筛选与鉴定
但 言 陈元坤 朱杰 马跃刚
( 重庆市水产科 学研 究所 ,重庆 4 0 1 1 2 1 )
摘
要 :从 健康 大 鳍 鲮 (
)肠 道 菌群 分离 得 到 的2 5 株 细 菌 ,通过 平 板 筛
选 、发酵 液酶活力 测定和菌株 安全性检 测 ,筛选 出一株具有较 高产纤维 素酶能力 的益生 芽孢杆 菌 D Q H Y 一 7 菌株 。通 过 对 D Q H Y 一 7 菌 株 形态 观 察 、生理 生 化 试 验 ,对 D Q H Y 一 7 菌 株进 行 了分 类鉴 定 。结果 显示 :D Q H Y一 7 菌株 具有较 强 的分 泌纤维素 酶能力 ,水解 圈/ 菌落直径 比为 l 2 . 7 7 ,2 0 h 发
3 0 mi n。
1 . 2 . 4安全性试验 取1 0 0 c m ×5 0 c m×6 0 c m的 水族 缸 5 只 ,充 入曝气 自来水 ,每缸 ̄. / N . 2 0 只健康大鳍鲮( 2 0 ±
1 . 2 方 法
0 . 5 ) g ,取4 只缸 进行 动物 毒 性试 验 :将最 符合 益生 菌条件菌株 接种在 营养 肉汤 ,2 8 ℃培养2 4 h 后 ,用0 . 8 5 %无菌生理盐水稀释菌悬液至浓度
度接 种 3 个 平板 ,最 后将 平板 置 于2 8 ℃恒温 培
C F U / E 。将 不 同稀 释度 的 菌悬 液用 无菌 注射 m 器对 每尾 大 鳍鲮 注射 0 . 3 mL 作 为试验 组 。对照
组则注射 同体积 的无菌生理 盐水 。注射后放 回
水族箱 中继续饲 养 ,每 日记录死亡情 况 ,连续
观察7 d 。
《产淀粉酶菌的分离纯化》实验方案设计

产淀粉酶菌株的分离纯化一、实验目的1. 掌握产淀粉酶菌种的分离纯化的原理和方法技术;2. 巩固十倍稀释法。
二、实验原理土壤是微生物生活的大本营,是寻找有重要应用潜力的微生物主要的菌源。
因此本实验选择从土壤中分离出产淀粉酶菌种,再进行纯培养。
主要运用富集培养技术,稀释涂布平板法和平板划线分离法及无菌操作技术获得我们所需要的产淀粉酶菌种。
淀粉酶作用于淀粉时,打开了淀粉分子的糖苷键,从而使淀粉失去粘性,同时使其失去了与碘的显色反应能力,不再与碘结合,从而形成透明圈。
产淀粉酶菌株在选择培养基上培养后,会水解淀粉形成水解圈,加碘液染色后,水解圈尤为明显。
三、实验材料1. 菌种:从自然界筛选获得的淀粉酶产生菌种2. 土壤样品:从栽种土豆的菜园中采集土壤样品3. 培养基:淀粉液体培养基(50mL):蛋白胨0.5g,NaCl 0.25g,牛肉膏0.25g,可溶性淀粉0.1g,蒸溜水50mL。
淀粉琼脂培养基(200mL):蛋白胨2g,NaCl 1g,牛肉膏1g,可溶性淀粉0.4g,蒸溜水200mL,琼脂3-4g。
牛肉膏蛋白胨培养基(200mL):蛋白胨2g,牛肉膏0.6g,NaCl 1g,琼脂3-4g,蒸馏水200mL,pH7.0-7.2。
4.其他用品:酒精灯、移液枪(20-200uL)、接种环、试管架、三角涂布棒(各一个),电子天平、三角烧瓶(5个)、试管(10支)、培养皿(15个)、1mL移液管(10支)、10mL移液管(1支)、无菌水(200mL)、微波炉、卢戈氏碘液。
四、试验方法1.样品采集用无菌报纸,在栽有土豆的菜园里,从不同的采样点采取土样约15g。
(注意应采取距地表2-3cm以下的土样)2.富集培养取土样10g,放入盛90mL无菌水并带有玻璃珠的三角烧瓶中,振动20min,使土样与水充分混合,使微生物分散开。
用一支1mL的移液管移取1mL土样液,加入到盛有50mL淀粉液体培养基的三角瓶中进行富集培养,摇床110r/min,37℃,培养24h。
浙江师范大学微生物实验报告 产淀粉酶芽孢杆菌的分离与初步鉴定
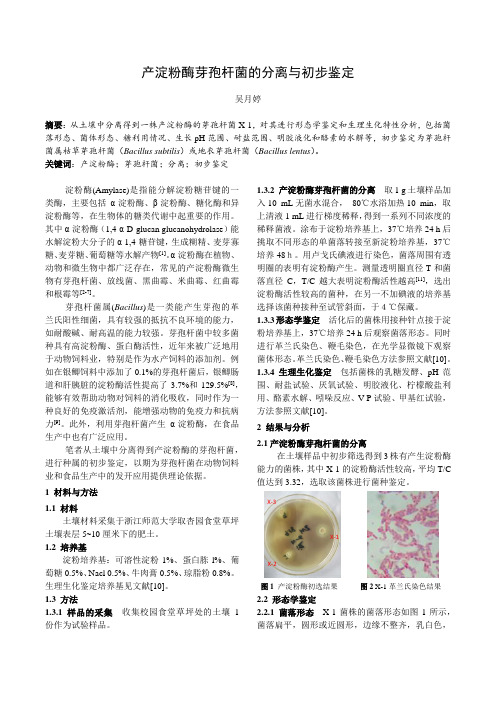
产淀粉酶芽孢杆菌的分离与初步鉴定吴月婷摘要:从土壤中分离得到一株产淀粉酶的芽孢杆菌X-1,对其进行形态学鉴定和生理生化特性分析,包括菌落形态、菌体形态、糖利用情况、生长pH范围、耐盐范围、明胶液化和酪素的水解等,初步鉴定为芽孢杆菌属枯草芽孢杆菌(Bacillus subtilis)或地衣芽孢杆菌(Bacillus lentus)。
关键词:产淀粉酶;芽孢杆菌;分离;初步鉴定淀粉酶(Amylase)是指能分解淀粉糖苷键的一类酶,主要包括α-淀粉酶、β-淀粉酶、糖化酶和异淀粉酶等,在生物体的糖类代谢中起重要的作用。
其中α-淀粉酶(1,4-α-D-glucan glucanohydrolase)能水解淀粉大分子的α-1,4-糖苷键,生成糊精、麦芽寡糖、麦芽糖、葡萄糖等水解产物[1]。
α-淀粉酶在植物、动物和微生物中都广泛存在,常见的产淀粉酶微生物有芽孢杆菌、放线菌、黑曲霉、米曲霉、红曲霉和根霉等[2-7]。
芽孢杆菌属(Bacillus)是一类能产生芽孢的革兰氏阳性细菌,具有较强的抵抗不良环境的能力,如耐酸碱、耐高温的能力较强。
芽孢杆菌中较多菌种具有高淀粉酶、蛋白酶活性,近年来被广泛地用于动物饲料业,特别是作为水产饲料的添加剂。
例如在银鲫饲料中添加了0.1%的芽孢杆菌后,银鲫肠道和肝胰脏的淀粉酶活性提高了3.7%和129.5%[8],能够有效帮助动物对饲料的消化吸收,同时作为一种良好的免疫激活剂,能增强动物的免疫力和抗病力[9]。
此外,利用芽孢杆菌产生α-淀粉酶,在食品生产中也有广泛应用。
笔者从土壤中分离得到产淀粉酶的芽孢杆菌,进行种属的初步鉴定,以期为芽孢杆菌在动物饲料业和食品生产中的发开应用提供理论依据。
1 材料与方法1.1 材料土壤材料采集于浙江师范大学取杏园食堂草坪土壤表层5~10厘米下的肥土。
1.2 培养基淀粉培养基:可溶性淀粉1%、蛋白胨l%、葡萄糖0.5%、Nacl 0.5%、牛肉膏0.5%、琼脂粉0.8%。
从土壤中分离产淀粉酶的芽孢杆菌实验方案

从土壤中分离产淀粉酶的芽孢杆菌实验方案实验方案:从土壤中分离产淀粉酶的芽孢杆菌实验目的:分离产淀粉酶的芽孢杆菌,用于后续淀粉酶相关研究。
实验步骤:1.样品采集:选择含有潜在产淀粉酶的土壤样品,如农田土壤或果园土壤。
2.稀释培养:将采集的土壤样品用无菌PBS缓冲溶液稀释,并进行均匀悬浮。
3.接种装置:将土壤悬浮液均匀涂布在含有淀粉的固体培养基上,使用毛细管或平面接种棒操作,确保样品均匀地接种在培养基上。
4.培养条件:将接种好的培养基培养皿在适宜的培养条件下培养。
适宜的培养条件包括温度、湿度和氧气供应等。
一般来说,菌株生长的适宜温度为30-37摄氏度,湿度为60-70%。
5.纯化分离:通过制备出来的细菌菌落将产酶菌株分离出来。
可以使用毛细管、骨牌、环针等工具,分别挑取单个菌落并将其转移到含有淀粉的培养基上。
6.传代培养:将分离出来的产酶菌株进行传代培养,以确保其菌落的特性稳定。
7.筛选鉴定:通过淀粉酶活性分析等方法,对分离出来的菌株进行筛选鉴定。
一般来说,可采用滴定法或I2-KI法测定淀粉酶活性。
根据颜色变化或者酶活性指标的变化,筛选出淀粉酶产量较高的菌株。
8.鉴定菌株:对产淀粉酶的菌株进行鉴定,确定其属于芽孢杆菌的种属。
可以采用传统的形态学和生理生化特性鉴定方法,如菌落形态观察、革兰染色、氧需气性、形状和运动情况等。
9.鉴定纯化:最后,对鉴定出来的菌株进行纯化培养,以获得纯种淀粉酶产生菌。
实验注意事项:1.采集样品时要避免采集过于含油的土壤,以免对实验造成干扰。
2.在操作过程中要做好防护,戴手套,避免污染样品。
3.在培养过程中注意严格无菌操作,以避免外源菌的污染。
4.在菌株的鉴定过程中,要仔细观察菌株的形态特征,并结合多种鉴定方法综合分析。
5.实验过程中要注意做好记录,包括实验步骤、结果、观察和记录等。
总结:通过上述实验方案,我们可以从土壤中分离出产淀粉酶的芽孢杆菌。
这有助于开展后续淀粉酶相关的研究,包括酶的生物化学性质、作用机制等。
产淀粉酶芽孢杆菌的筛选和分离

碘 原 液 : 1 g 碘 化 钾 2 g 加 水 定 容 至 碘 l, 2,
5 OrL。 0 a
( aiu) B cls 中能 产 生淀粉 酶 的菌 种较 多 ; 次 , 孢 l 其 芽
杆菌 属产 的 淀 粉 酶 有 较 好 的应 用 价 值 , 凝 结 芽 如
孢杆 菌 、 草 芽 孢 杆 菌 、 热 芽 孢 杆 菌 、 衣 芽 孢 枯 嗜 地
成 菌悬液 , 菌悬 液 置 于 8 % 水浴 2 i , 度 稀 将 0 0mn 梯
作 者简 介 : 琛 ( 94 ) 男 , 苏 启 东 人 , 教 徐 18一 , 江 助
总第 17 4 期
释 至 1 ~。 0
齐鲁师范学 院学报
终点 , 录时 间 即为液 化 时间 。 记
取 20. 1 菌 悬 液 涂 布 于 筛 选 培 养 基 上 , 01 0  ̄ L 3 ℃培 养 2 h 7 4 。在 菌落 周 围滴加 卢 戈 氏 碘液 , 察 观 菌 落 周 围是 否 出现 透 明水 解 圈 , 测 定 菌 落 及 水 并
第2 6卷
第 5期
齐 鲁 师 范 学 院 学 报
Jun l f i N r l nvrt o ra o Ql u o U iesy ma i
Vo . 6 1 2 No. 5
0c . t201 1
21 0 1年 1 0月
产 淀 粉 酶 芽 孢 杆 菌 的筛 选 和分 离
徐 琛
关键词 : 芽孢 杆 菌 ; 粉 酶 ; 选 淀 筛
落 形 态观 察 、 兰 氏染 色和 芽孢 染 色初 步 鉴 定 这 2株 菌株 为 芽孢 杆 菌属 。 革
中图分 类号 :9 9 9 Q 3 .
从土壤中分离产淀粉酶的芽孢杆菌实验方案报告

从土壤中分离产淀粉酶的芽孢杆菌实验方案报告实验方案报告:从土壤中分离产淀粉酶的芽孢杆菌一、实验目的:本实验旨在从土壤中分离出产淀粉酶的芽孢杆菌,为进一步研究淀粉酶的性质和应用提供材料基础。
二、实验原理:产淀粉酶的芽孢杆菌主要存在于土壤中,它们具有高效分解淀粉的能力。
本实验通过稀释土壤样品,制备土壤悬浮液,然后采用平板和液体培养基法进行分离纯化。
三、实验步骤:1.土壤样品的采集2.土壤样品制备将土壤样品采样袋中的土壤倒入无菌的研钵中,使用无菌铁锹将土壤表面的杂质去除,然后将土壤样品与等量无菌蒸馏水混合浸泡2小时。
使用无菌玻璃棒搅拌1分钟,然后过滤土壤悬浮液,得到土壤样品的0.1倍稀释液。
3.平板培养基分离将制备好的土壤样品0.1倍稀释液分别取0.1mL均匀涂布在含有淀粉的固体培养基平板上,用无菌的铁锹均匀摊开。
将培养皿倒立放置在培养箱中,以30℃恒温培养。
4.鉴定单菌菌落在培养平板上观察菌落生长情况,挑选形态不同的菌落,并进行分离培养。
将单个菌落挑选到含有淀粉的液体培养基中,用无菌胶头移液管进行吸取和移植。
5.验证淀粉酶活性将挑选分离得到的菌株分别接种在含淀粉的液体培养基中,并进行培养。
通过观察培养基颜色的变化、液体浑浊度的变化以及淀粉浓度的定量检测,判断菌株产淀粉酶的能力。
四、实验结果:根据实验步骤所述,从土壤中成功分离得到了产淀粉酶的芽孢杆菌。
通过观察培养基的颜色变化和液体浑浊度的变化,可以初步判断杆菌产淀粉酶的能力。
五、实验讨论与结论:通过本实验的步骤操作,成功分离出产淀粉酶的芽孢杆菌。
该实验为进一步研究淀粉酶的性质和应用提供了材料基础。
此外,实验中还可以对分离得到的菌株进行基于16SrRNA基因的鉴定,对其进行淀粉酶的基本特性、产酶条件和产酶规律等方面的研究。
这对于我们深入了解淀粉酶功能机制,以及在饲料、食品、生物工程等领域的应用具有重要意义。
六、实验心得:通过本次从土壤中分离产淀粉酶的芽孢杆菌的实验,我学会了土壤样品的制备和分离培养的方法,掌握了菌株的挑选和鉴定技巧,对淀粉酶产生的条件和酶活性的检测有了初步了解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表 3 P-12 菌株的生理生化特征
特征
活性
特征
活性
D- 葡 萄 糖 产 酸
+
生长温度 5 ℃
+
L- 阿 拉 伯 糖 产 酸
-
生长温度 20 ℃
+
D- 木 糖 产 酸
蜡状芽孢杆菌(Bacillus cereus),其 16S rDNA GeneBank 登录号为 GU269268,具有产蛋白酶、淀粉酶活性。
[关键词] 芽孢杆菌;16S rDNA;鉴定
[中图分类号] S811.6
[文献标识码] A
[文章编号] 1004-3314(2010)18-0013-03
[Abstract] According to the biological qualification of Bacillus,a strain P-12 was isolated from cecal contents of the
14
中国饲料
2010 年第 18 期
孵育 10 min,取 0.1 mL 以无菌水稀释成 10-6、10-7 和 10-8 三个浓度梯度, 涂布牛 肉膏蛋白胨 平板, 37 ℃培养 24 h。 挑选菌落进行芽孢染色,染色方 法参 《农业微生物学及实验教程》(袁红莉和王贺 祥,2009)。挑选具有芽孢的菌落,利用牛肉膏蛋白 胨平板划线培养,获得单菌落。 1.4 革兰 氏 染 色 与 镜 检 获 得 的 芽 孢 杆 菌 纯 培 养接种 在牛肉膏蛋 白胨平板 上 ,37 ℃培 养 24 h。 取新鲜菌体进行革兰氏染色并镜检拍照, 染色方 法参考 《农业微生物学及实验教程》(袁红莉和王 贺祥,2009)。 1.5 细菌生理生化测定 菌株糖醇利用、产酸产 气、生长温度、pH 范围、耐盐试验、溶菌酶抗性试 验、V-P 试验、接触酶反应、卵黄反应、吲哚反应、 明胶穿刺、淀粉水解、硝酸盐还原、厌氧生长、柠檬 酸盐利用、苯丙氨酸脱氨酶活性、酪素水解和酪氨 酸水解的测定方法参考《常见细菌系统鉴定手册》 (东秀珠和蔡妙英,2001)。 1.6 16S rDNA 鉴定 1.6.1 细菌总 DNA 提取 参照丁延芹 (2004)的 方法。 1.6.2 16S rDNA 的 PCR 扩增 以 10 ng 纯 化 的 细菌总 DNA 作为模板,扩增 16S rDNA。 所用引物 为大肠杆菌 (Escherich coli)16S rDNA 基因序列 引物 P1 和 P6, 由上海英骏生物技术有限公司合 成,序列如下:
healthy Japanese Quail(Coturnix japonica) using the pour plate method.Biochemical properties and chemotaxonomy,cul-
tural characteristics,morphology,physiological of strain P-12 were studied.The results showed that phylogenetic analysis
正 向 引 物 P1:5′ -AGAGTTTGATCCTGGCTCAGAACGAACGCT-3′;
反 向 引 物 P6:5′ -TACGGCTACCTTGTTACGACTTCACCCC-3′。
以灭菌的 ddH2O 代替模板 DNA 作为阴性对 照 ,PCR 扩 增 体 系 (25 μL)的 具 体 反 应 体 系 见 表 1,PCR 反应程序见表 2。
表 2 PCR 反应程序
过程 95 ℃预变性
94 ℃变性 58 ℃退火 72 ℃延伸 72 ℃最终延伸
时间 5 min 30 s 30 s 2.0 min 5.0 min
×30 个循环
比对分析(丁延芹,2004)。 1.7 系统发育树的构建 所测细菌 16S rDNA 全 序 列 与 GeneBank 中 已 知 芽 孢 杆 菌 模 式 菌 的 16S rDNA 全序列一起, 利用 MEGA 3.0 软件,绘 制系统发育树,并计算遗传距离。发育树中芽孢杆 菌 属 (Bacillus)菌 株 分 别 为 : 附 琼 脂 芽 孢 杆 菌 (B.agaradhaerens)、 嗜 碱 芽 孢 杆 菌 (B.alcalophilus)、 解 淀 粉 芽 孢 杆 菌 (B.amyloliquefaciens)、产 氮 芽 孢 杆 菌 (B.azotoformans)、栗 褐 芽 孢 杆 菌 (B.badius)、 蜡 状芽孢杆 菌 (B.cereus)、 环 状 芽 孢 杆 菌 (B.circulans)、克氏 芽孢杆菌(B.clarkii)、克 劳氏芽孢杆 菌 (B.clausii)、 凝 结 芽 孢 杆 菌 (B.coagulans)、 苛 求 芽 孢 杆 菌 (B.fastidiosus)、坚 强 芽 孢 杆 菌 (B.firmus)、 霍氏芽孢杆菌 (B.horikoshii)、 缓病芽孢杆菌(B. lentimorbus)、迟 缓 芽 孢 杆 菌 (B.lentus)、地 衣 芽 孢 杆菌(B.licheniformis)、海洋芽孢杆菌(B.marinus)、 巨 大 芽 孢 杆 菌 (B.megaterium)、蕈 状 芽 孢 杆 菌 (B. mycoides)、巴 氏 芽 孢 杆 菌 (B.pasteurii)、短 小 芽 孢 杆 菌 (B.pumilus)、 球 形 芽 孢 杆 菌 (B.sphaericus)、 枯 草 芽 孢 杆 菌 (B.subtilis)和 苏 云 金 芽 孢 杆 菌 (B. thuringiensis)。 1.8 蛋白酶活性测定 将获得的芽孢杆菌,先经 过 37 ℃培养 24 h 活化, 以牙签点接种于蛋白酶 测定平板上。 37 ℃培养 24 h,测定水解透明圈直 径(H)与菌落直径(C),计算 H/C 值。
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!"
Байду номын сангаас
[摘 要] 本 试 验 根 据 芽 孢 杆 菌 生 理 特 点 ,采 取 稀 释 平 板 法 从 健 康 日 本 鹌 鹑 (Coturnix japonica)盲 肠 内 容 物 中 分 离
获得一株芽孢杆菌 P-12,结合细菌生理生化鉴定、16S rDNA 测序和系统发育树对其进行分析。 研究表明,该菌种为
基金项目:“十一五”国家技术支撑 计 划 (2006BAD12B05); 动物营养学国家重点实验室自主研究课题 (2004DA125184G0811) * 通讯作者
益生菌的开发提供了理论依据。 1 试验材料与方法 1.1 菌株来源 芽孢杆菌 P-12 分离于健康成年 日本鹌鹑(Coturnix japonica)盲肠内容物。 1.2 培养基 1.2.1 牛肉膏蛋白胨液体培养基 牛肉膏 3.0 g, 蛋 白 胨 10.0 g,NaCl 5.0 g, 蒸 馏 水 1000 mL,pH 7.0 ~ 7.2。 1×105 Pa 灭菌 20 min。 1.2.2 牛肉膏蛋白胨固体培养基 牛肉膏 3.0 g, 蛋 白 胨 10.0 g,NaCl 5.0 g, 琼 脂 粉 20.0 g, 蒸 馏 水 1000 mL,pH 7.0 ~ 7.2。 1×105 Pa 灭菌 20 min。 1.2.3 蛋白酶测定培养基 10 %脱脂牛奶 113 ℃ 灭菌 30 min, 与牛肉膏蛋白胨固体培养基以 1∶9 混匀,铺成平板备用。 1.2.4 淀粉酶活性测定培养基 淀粉 10 g, 蛋白 胨 10 g,酵母 5 g,NaCl 10 g,琼脂粉 20.0 g,蒸 馏 水 1000 mL,pH 7.0 ~ 7.2。 1×105 Pa 灭菌 20 min。 1.3 菌株分离与纯培养 肠道内容物 0.5 g 置于 50 mL 牛肉膏蛋白胨液体培养基内,37 ℃、150 r/min 富集培养 24 h。 将获得的菌悬液在 90 ℃水浴中
based on 16S rDNA sequence demonstrated that it was closely related to the genus Bacillus cereus.The accession num-
bers of its 16S rDNA sequence in GeneBank is GU269268.The bacterium had protease and amylase activity,and could
表 1 PCR 扩增体系(25 μL)
试剂 Taq 酶(0.5 U/mL) 10×Reaction buffer
dNTP Mixture 模板 DNA
正向引物(10 μmol/L) 反向引物(10 μmol/L)
ddH2O Total
添 加 量 /μL 0.25 2.5 2.0 1.0 1.0 1.0 17.25 25.0
2010 年第 18 期
中国饲料
15
1.9 淀粉酶活性测定 将获得的芽孢杆菌,先经 过 37 ℃培养 24 h 活化, 以牙签点接种于淀粉酶 测定平板上。 37 ℃培养 24 h,取出后在平板上滴 加卢哥氏碘液, 显色后测定水解透明圈直径(H) 与菌落直径(C),计算 H/C 值。 2 结果与分析 2.1 细菌形态及菌落特征 P-12 菌株在牛肉膏 蛋白胨平板上 37 ℃培养 24 h,菌落扁平、成圆形 或近圆形,表面略粗糙,乳白色(近似蜡烛颜色), 稍带光泽,不产色素。在光学显微镜下,菌体杆状, 末端钝圆,(1.0 ~ 1.2)μm×(3.0 ~ 5.0)μm,成短链 状。革兰氏阳性,产芽孢,芽孢圆形或柱形,中生或 近中生,1.0 ~ 1.5 μm。 2.2 细菌生理生化测定 P-12 菌株的生理生化 特征见表 3。 根据《常见细菌系统鉴定手册》和《伯 杰氏细菌鉴定手册》(第八版)芽孢杆菌属特征,初 步鉴定 P-12 菌株为蜡状芽孢杆菌。
