初三化学专题(有关溶解度计算题)
中考化学溶液 溶解度20篇(附带答案解析)经典
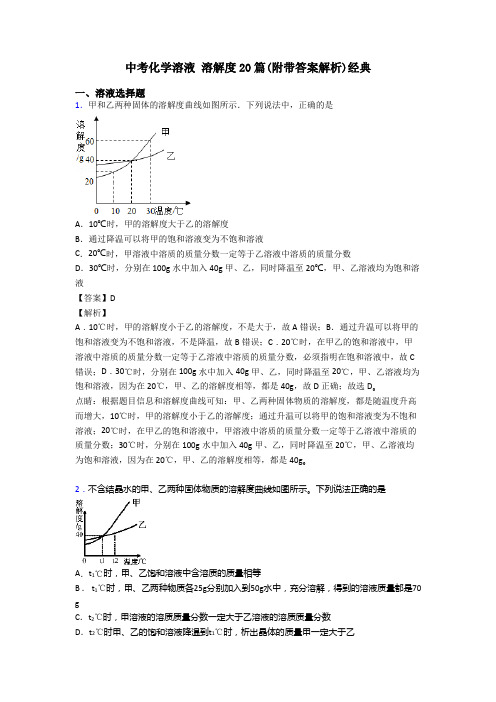
中考化学溶液溶解度20篇(附带答案解析)经典一、溶液选择题1.甲和乙两种固体的溶解度曲线如图所示.下列说法中,正确的是A.10℃时,甲的溶解度大于乙的溶解度B.通过降温可以将甲的饱和溶液变为不饱和溶液C.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数D.30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液【答案】D【解析】A.10℃时,甲的溶解度小于乙的溶解度,不是大于,故A错误;B.通过升温可以将甲的饱和溶液变为不饱和溶液,不是降温,故B错误;C.20℃时,在甲乙的饱和溶液中,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数,必须指明在饱和溶液中,故C 错误;D.30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液,因为在20℃,甲、乙的溶解度相等,都是40g,故D正确;故选D。
点睛:根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,10℃时,甲的溶解度小于乙的溶解度;通过升温可以将甲的饱和溶液变为不饱和溶液;20℃时,在甲乙的饱和溶液中,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数;30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液,因为在20℃,甲、乙的溶解度相等,都是40g。
2.不含结晶水的甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是A.t1℃时,甲、乙饱和溶液中含溶质的质量相等B.t1℃时,甲、乙两种物质各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70 gC.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数D.t2℃时甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙【答案】B【解析】A、t1℃时,甲、乙溶解度相等,所以等质量的饱和溶液中含溶质的质量相等,故A错误;B、t1℃时,甲、乙两种物质的溶解度是40g,所以各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70g,故B正确;C、t2℃时,溶液的饱和状态不确定,所以甲溶液的溶质质量分数不一定大于乙溶液的溶质质量分数,故C错误;D、t2℃时甲、乙的饱和溶液的质量不确定,所以降温到t1℃时,析出晶体的质量甲不一定大于乙,故D错误。
初三化学溶解度试题

初三化学溶解度试题1. 在一定温度下,一定量的溶剂里,可继续溶解某种溶质的溶液叫做_____________________;不能继续溶解某种溶质的溶液叫做______________。
【答案】这种溶质的不饱和溶液 这种溶质的饱和溶液【解析】考点定位分析:本题的考点是饱和溶液和不饱和溶液。
饱和溶液是指在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液。
解答过程分析:根据饱和溶液与不饱和溶液的定义考虑、解答本题。
饱和溶液与不饱和溶液区别就是在一定温度下,一定量的溶剂里能否继续溶解某种溶质。
试题总结评价:饱和溶液与不饱和溶液的本质区别是否能继续溶解,不能就是饱和溶液,能就是不饱和溶液。
要想解答好这类题目,就要熟记和理解饱和溶液和不饱和溶液的概念、特点和区分方法。
2. 烧开水时,加热不久在锅底会出现许多气泡,这说明气体的溶解度随温度的升高而_________。
打开汽水瓶盖时,有大量气泡由瓶口逸出,这是因为______________________。
【答案】减小 在一定温度下,气体溶解度随压强减小而减小【解析】考点定位分析:本题的考点是气体溶解度的影响因素。
气体溶解度的影响因素主要是指温度和压强。
具体的变化规律是:气体的溶解度随温度的升高而减小(随温度的降低而增大),随压强的增大而增大(随压强的减小而减小)。
可以简记为4个字,即“温反压正”;其含义是气体的溶解度与温度成反比关系,与压强成正比关系。
解答过程分析:利用气体的溶解度随温度的升高而降低,随着压强的增大而增大,结合事实进行分析解答。
烧开水时,加热不久在锅底出现许多气泡,这是因为随着温度升高,原本水中溶有的气体的溶解度减小,因此有气泡逸出。
汽水是将二氧化碳气体加压之后制成的,打开汽水瓶盖,压强变小,二氧化碳的溶解度减小,故有大量气泡从瓶口逸出,说明了气体的溶解度随压强的减小而减小,气体的溶解度随压强的增大而增大。
初三化学溶解度试题答案及解析

初三化学溶解度试题答案及解析1. A 、B 、C 三种物质的溶解度曲线如图所示.(1)P 点表示t 2℃时完全溶解30gA 物质至少需 g 水.(2)t 2℃时等质量的A 、B 、C 三种饱和溶液中所含溶剂质量最多的是 (序号下同) (3)现有A 、B 、C 三种物质的浓溶液,适用于海水晒盐原理进行结晶的是(4)将t 1℃时A 、B 、C 三种物质的饱和溶液分别升温至t 2℃时,所得溶液的溶质质量分数由大到小的顺序是【答案】(1)100;(2)C ; (3)B;(4) B >C >A【解析】 根据ABC 的溶解度曲线可知,(1)P 点表示t 2℃时完全溶解30gA 物质至少需100g 水;(2)t 2℃时等质量的A 、B 、C 三种饱和溶液中所含溶剂质量最多的是应该为该温度下溶解度最小的物质C ;(3)现有A 、B 、C 三种物质的浓溶液,适用于海水晒盐原理进行结晶的是B ,因为蒸发结晶是溶解度受温度影响不大的物质;(4)将t 1℃时A 、B 、C 三种物质的饱和溶液分别升温至t 2℃时,所得溶液的溶质质量分数由大到小的顺序是B >C >A ,综合起始温度和终了温度的溶解度的数值可知答案。
【考点】溶解度曲线2. a 、b 、c 三种物质的溶解度曲线如下图所示。
取t 2℃的a 、b 、c 三种物质的饱和溶液,分别蒸发等质量的水后恢复至t 2℃,再降温到t 1℃。
下列说法不正确的是A .降温至t 2℃时,三种溶液一定都是饱和溶液B .原饱和溶液中,溶质的质量分数一定是a>b=cC .恢复至t 2℃时,析出溶质的质量一定是a>b=cD .降温至t 1℃, 三种溶液中溶质的质量分数一定a=c>b【答案】D【解析】A .由题意可知,将饱和溶液恒温蒸发水,析出晶体,剩余的溶液仍为饱和溶液.故A 说法正确;B .由a 、b 、c 三种物质的溶解度曲线可知,在t 2℃时的a 、b 、c 三种物质的溶解度的大小是:a >b=c ,由饱和溶液溶质的质量分数为×100%可知,溶质的质量分数是a >b=c ,故B说法正确; C .由于在t 2℃时的a 、b 、c 三种物质的溶解度的大小是:a >b=c .所以,分别蒸发等量水恢复至t 2℃时,析出溶质的质量a >b=c .故C 说法正确; D .由a 、b 、c 三种物质的溶解度曲线可知,a 、b 的溶解度随温度的降低而减小,在降温时析出晶体,得到t 1℃的溶液仍是饱和溶液;由于c 的溶解度随温度的降低而增大,降温时得到的是不饱和溶液,由于t 1℃,a 的溶解度大于b 的溶解度,都大于c 在t 2℃时的溶解度,所以,降温至t 1℃,三种溶液中溶质的质量分数一定a >b >c ,故D 说法不正确.【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液;晶体和结晶的概念与现象3. (6分)下表是Ca(OH)2和NaOH 的溶解度数据。
初三化学化学溶解度的专项培优练习题(含答案)含答案

初三化学化学溶解度的专项培优练习题(含答案)含答案一、初中化学溶解度1.甲、乙两种固体物质(不含结晶水)的溶解度曲线如下图。
下列说法不正确的是()A.甲物质的溶解度可能大于乙物质的溶解度B.t1℃时,60克甲的饱和溶液中加入10克乙物质,溶液质量可能仍为60gC.t2℃时,甲、乙饱和溶液分别降温至t1℃,析出甲的质量可能比乙大D.t2℃时,甲溶液的溶质质量分数可能大于乙溶液的溶质质量分数【答案】B【解析】【详解】A、由溶解度曲线可知,甲物质的溶解度可能大于乙物质的溶解度,说法正确;故不符合题意;B、t1℃时,60克甲的饱和溶液中加入10克乙物质,全部溶解,故溶液质量是70g,说法错误;故符合题意;C、甲的溶解度随温度的升高增大明显,故t2℃时,等质量的甲、乙饱和溶液分别降温至t1℃,甲析出晶体的质量比乙多,说法正确;故不符合题意;D、t2℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数,若不是饱和则有可能乙溶液的溶质质量分数大于甲溶液的溶质质量分数,说法正确;故不符合题意;故选B【点睛】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
2.如图为甲、乙两种固体物质(不含结晶水)的溶解度曲线。
下列说法错误的是A.t2℃时,甲的溶解度大于乙B.t1℃时,甲、乙各25g加到50g水中,均得70g溶液C.t1℃时,甲、乙两种物质的溶液中溶质质量分数相等D.t2℃时,将溶剂均为100g的甲、乙的饱和溶液分别降温到t1℃时,析出晶体的质量甲>乙【答案】C【解析】【分析】【详解】A.由图像可知,t2℃时,甲的溶解度大于乙,正确;B、t1℃时,甲、乙两种物质的溶解度是40g,所以各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70g,故B正确;C、t1℃时,溶液的饱和状态不确定,所以甲溶液的溶质质量分数不一定等于乙溶液的溶质质量分数,故C错误;D. t2℃时,甲的溶解度大于乙,将溶剂均为100g的甲、乙的饱和溶液分别降温到t1℃时,析出晶体的质量甲>乙,正确;故选C。
初中化学溶解度与反应速率精选计算题

初中化学溶解度与反应速率精选计算题溶解度和反应速率是化学中重要的概念。
通过计算题可以帮助我们更好地理解这两个概念的含义和计算方法。
溶解度计算题问题1:某化学实验中,向100毫升水中加入30克NaCl,求NaCl在水中的溶解度。
某化学实验中,向100毫升水中加入30克NaCl,求NaCl在水中的溶解度。
解答:溶解度是指单位溶剂中能溶解的物质的质量。
我们可以使用以下公式计算NaCl在水中的溶解度:溶解度 = 溶质质量 / 溶剂体积在这个问题中,NaCl的质量为30克,水的体积为100毫升。
将数值代入公式得:溶解度 = 30克 / 100毫升 = 0.3克/毫升所以,NaCl在水中的溶解度为0.3克/毫升。
反应速率计算题问题2:某化学反应的速率方程式为:2A + 3B → C + D。
已知反应开始时A的浓度为0.1摩尔/升,B的浓度为0.2摩尔/升,反应经过10秒后,A的浓度减少到0.05摩尔/升,求反应速率。
某化学反应的速率方程式为:2A + 3B → C + D。
已知反应开始时A的浓度为0.1摩尔/升,B的浓度为0.2摩尔/升,反应经过10秒后,A 的浓度减少到0.05摩尔/升,求反应速率。
解答:反应速率是指单位时间内反应物浓度的变化量。
根据速率方程式中反应物的系数,我们可以得到以下关系:速率 = 反应物浓度变化量 / 反应时间在这个问题中,反应物A的浓度从0.1摩尔/升减少到0.05摩尔/升,反应时间为10秒。
将数值代入公式得:速率 = (0.05摩尔/升 - 0.1摩尔/升) / 10秒速率 = -0.05摩尔/升 / 10秒所以,反应速率为-0.005摩尔/升/秒。
总结通过以上的计算题,我们可以看到溶解度和反应速率的计算方法是基于一些简单的公式和关系。
理解这些概念的计算方法可以帮助我们更好地解决化学中涉及溶解度和反应速率的问题。
初三化学溶解度练习题

初三化学溶解度练习题1. 溶解度是指在特定温度下,溶质在溶剂中能够溶解的最大量。
溶解度与温度、压力等因素有关。
下面是一些化学溶解度相关的练习题,大家可以通过解答来巩固对溶解度的理解。
题目一:某种物质在水的溶解度为80g/100ml,如果将20g该物质加入200ml水中,问是否能完全溶解?解答:溶解度为80g/100ml,即1ml水最多能溶解80/100=0.8g该物质。
而现在20g该物质加入200ml水中,相当于每1ml水中有20/200=0.1g该物质。
因此,每1ml水中的物质量小于溶解度,所以无法完全溶解。
题目二:某种物质在80℃时的溶解度为40g/100ml,若将30g该物质加入100ml水中,温度保持在80℃不变,问该物质是否能完全溶解?解答:溶解度为40g/100ml,在80℃下,如果将30g该物质加入100ml水中,相当于每1ml水中有30/100=0.3g该物质。
每1ml水中的物质量小于溶解度,所以无法完全溶解。
题目三:某种物质在20℃时的溶解度为60g/100ml,若将40g该物质加入150ml水中,温度保持在20℃不变,问该物质是否能完全溶解?解答:溶解度为60g/100ml,在20℃下,如果将40g该物质加入150ml水中,相当于每1ml水中有40/150=0.267g该物质。
每1ml水中的物质量小于溶解度,所以无法完全溶解。
题目四:某种物质在30℃时的溶解度为100g/100ml,若将20g该物质加入100ml水中,温度保持在30℃不变,问该物质是否能完全溶解?解答:溶解度为100g/100ml,在30℃下,如果将20g该物质加入100ml水中,相当于每1ml水中有20/100=0.2g该物质。
每1ml水中的物质量小于溶解度,所以无法完全溶解。
通过以上习题的解答,我们可以看出溶解度与溶质的质量、溶剂的数量、温度等因素密切相关。
只有在溶质的质量小于溶解度的情况下,溶质才能完全溶解。
溶解度计算

初三化学练习(溶解度)班级:姓名:1、60℃时,硝酸钾的溶解度为110g,则60℃时,将70g硝酸钾放入50g水中充分溶解后所得溶液的质量为g2、已知某温度时,硝酸钾的溶解度为20g,则在该温度时,将50g硝酸钾放入200g水中形成硝酸钾溶液的质量为 g,所得硝酸钾溶液中溶质的质量分数为 g。
3、20℃时,将38gNaCl放入100g水中搅拌以后,烧杯底部仍有2g固体,则该溶液中溶质为 g,溶剂为 g,溶液为 g,该溶液(是不是)饱和溶液。
4、t℃时,将500g硝酸钾溶液蒸发掉10g水后析出晶体4g,又蒸发10g水后析出晶体6g,再蒸发20g水析出晶体的质量是_________,硝酸钾在t℃时的溶解度为________。
5、一定温度下,某物质的溶解度为25g,现欲配制200g该物质的饱和溶液,需要水多少克?所得溶液的溶质质量分数是多少?6、在20℃时,将102g饱和的食盐水蒸干,得到27g食盐。
求:①该饱和食盐水的溶质质量分数;② 20℃时氯化钠的溶解度。
7、100g40%的氯化铵溶液不饱和溶液,从50℃降温至10℃时,溶质质量分数变为25%。
问:从50℃降至10℃的过程中有无氯化铵晶体析出?若能析出晶体,则晶体的质量为多少?8、已知NH4NO3在不同温度下的溶解度如下表20℃时,把70 g NH4NO3溶解在50 g水中。
回答下列问题:(1)上述所得溶液是否饱和?(要求写出判断依据)(2)若上述溶液不饱和,用哪些方法可使溶液转化为饱和溶液?9、在一定温度下将240g15%的硝酸钾溶液蒸发掉150g 水,然后冷却至原来的温度,结果析出了22.5g 硝酸钾。
求:(1)蒸发后的硝酸钾溶液中溶质质量分数。
(2)该温度下硝酸钾的溶解度。
10、在一定温度下,将240g15%的某溶液蒸发掉150g 水,然后冷却至原来的温度,恰好得到饱和溶液。
求:(1)蒸发后的硝酸钾溶液中溶质质量分数。
(2)该温度下硝酸钾的溶解度。
初三化学溶解度试题答案及解析

初三化学溶解度试题答案及解析1. A 、B 是不含结晶水的两种固体物质,溶解度曲线如图所示,请回答下列问题: (1)溶解度随温度升高而降低的是 (填字母序号); (2)温度为 (填“t 1℃”或“t 2℃”)时,A 、B 溶解度相等;(3)t 2℃时,A 的饱和溶液中溶质A 的质量分数为 (精确至0.1%);(4)t 1℃时,用固体A 配制溶质质量分数为5%的A 溶液的步骤是:计算、 、量取、 、转移装瓶等操作.【答案】(1)B ;(2)t 1℃;(3)16.7%;(4)称量;溶解.【解析】 (1)溶解度随温度升高而降低的是B ;(2)温度为t 1℃时,A 、B 溶解度曲线交于一点,二者的溶解度相等;(3)t 2℃时,A 的溶解度是20g ,据饱和溶液中溶质的质量分数=×100%可知:饱和溶液中溶质A 的质量分数为×100%≈16.7%;(4)t 1℃时,用固体A 配制溶质质量分数为5%的A 溶液的步骤是:计算需要的A 和水的质量,然后称量固体的质量,用量筒量取水的体积,在烧杯中溶解,然后装瓶贴签;【考点】固体溶解度曲线及其作用;一定溶质质量分数的溶液的配制;溶质的质量分数、溶解性和溶解度的关系.2. 如图为甲、乙两种固体物质的溶解度曲线。
下列说法错误的是( )A .甲物质的溶解度随温度的升高而增大B .在t 1℃时,甲、乙两物质的溶解度相等C .在t 2℃时,N 点表示甲物质的不饱和溶液D .在t 1℃时,100g 乙物质的饱和溶液中溶质的质量是25g【答案】A【解析】A 、根据溶解度曲线图可看出,甲物质的溶解度随温度的升高而增大,正确,B 、根据溶解度曲线图,在t 1℃时,甲、乙两物质的溶解度相等,正确,C 、根据溶解度曲线图,在t 2℃时,N 点处在曲线的下方一点,故表示甲物质的不饱和溶液,正确,D 、根据溶解度曲线图,在t 1℃时,乙的溶解度为25g ,表示的是在100g 水中达到饱和状态所溶解溶质的质量是25g ,而不是100g 的饱和溶液,错误,故选A 【考点】溶解度曲线意义3. 右图为硝酸钾和氯化钠两种物质的饱和溶液的质量分数随温度变化的曲线,M 、N 分别是50℃时硝酸钾和氯化钠质量分数随温度变化曲线上的点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学专题------有关溶解度计算题
关于溶解度计算的关键就是将一定温度下溶液中溶质、溶剂、溶液的质量关系一一对应,列出正确的比例式求算。
一. 已知一定温度下,饱和溶液中溶质的质量和溶剂的质量。
求该温度下的溶解度。
1.把50克20℃时的硝酸钾饱和溶液蒸干,得到12克硝酸钾。
求20℃时硝酸钾的溶解度。
2.20℃时,把4克氯化钠固体放入11克水中,恰好形成饱和溶液。
求20℃时,氯化钠的溶解度?
二. 已知某温度时物质的溶解度,求此温度下饱和溶液中的溶质或溶剂的质量。
1.把100克20℃时硝酸钾的饱和溶液蒸干,得到24克硝酸钾。
则:
(1)若配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水各多少克?
(2)若将78克硝酸钾配成20℃时的饱和溶液,需水多少克?
2.已知氯化铵在30℃时的溶解度为45.8克。
30℃时将68.7克氯化铵配制成400克的溶液,通过计算:
(1)溶液是否饱和?
(2)若不饱和,为了使其饱和,可用下面的方法:
①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?
②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?
练习巩固:
1. 将两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出的食盐晶体的质量()
A. 甲=乙
B. 甲<乙
C. 甲>乙
D. 无法判断
2.t℃时,NaNO3的溶解度是25g,现向盛有200g 10%NaNO3溶液的烧杯中,加入30g NaNO3固体,则此时烧杯中()
A. 溶液质量是230g
B. 溶质质量是50g
C. 溶剂质量是170g
D. 溶质质量是45g
3. 20℃时,将一定质量的NH4NO3完全溶解于100g水中,将所得溶液分成两等份,其中一份蒸发18.75g 水,可使溶液饱和,另一份加入36g NH4NO3也达饱和,求⑴20℃时,NH4NO3的溶解度。
⑵原溶液中NH4NO3的质量。
课后练习:
1. 40℃时,25g水中溶解16 g硝酸钾恰好形成饱和溶液。
下列说法正确的是()
A. 硝酸钾的溶解度是16 g
B. 40℃时硝酸钾的溶解度是16g
C. 硝酸钾的溶解度是64 g
D. 40℃时硝酸钾的溶解度是64g
2. 下列接近饱和的溶液升高温度后能达到饱和的是()
A. NaCl溶液
B. KNO3溶液
C. Ca(OH)2溶液
D. NH4Cl溶液
3. 要增大硝酸钾的溶解度,可采用的措施是()
A. 增大溶剂量
B. 充分振荡
C. 降低温度
D. 升高温度
4. 在20℃时,食盐的溶解度是36 g,将5 g食盐放入10 g 水中,在20℃时,所得食盐饱和溶液()
A. 15 g
B. 14 g
C. 13.6 g
D. 12.5 g
5. 下列关于溶解度的说法正确的是()
A. 表示在一定温度下,100 g溶剂与某固体物质制成的饱和溶液中,固体物质的质量
B. 表示在指定温度下,某物质在溶剂中所能溶解的最多克数
C. 表示在一定温度下,100 g溶剂与某固体物质制成的溶液中,固体物质的质量
D. 表示某物质在100 g溶剂中所溶解的最多克数
6. 20℃时,25g水中溶解0.1g某物质即达到饱和,该物质的溶解性是()
A. 难溶
B. 易溶
C. 可溶
D. 微溶
7. 下列因素中,对固体物质的溶解度有影响的是()
A. 溶液的质量
B. 溶液的浓度
C. 溶液的温度
D. 溶液体积
8. 在t℃时,向一瓶某溶质的饱和溶液,加入一些该溶质的晶体(设不含结晶水),则()
A. 晶体质量减少
B. 溶质的质量分数增大
C. 晶体质量不变
D. 溶质的溶解度变化
9. 25℃时,80g水中最多能溶解8gM晶体,50℃时,100g水中最多能溶解10 g N晶体,则M和N的溶解度相比()
A. M>N
B. M<N
C. M=N
D. 无法比较
10. 20℃时,100 g A物质的溶液,温度不变,蒸发掉10 g水后有2 g A析出,又蒸发掉10 g水有4 g A 析出,则:20℃时A物质的溶解度为()
A. 20g
B. 40 g
C. 30 g
D. 无法计算
二. 计算题
11. 现有500g20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5gA 析出,若再蒸发掉20g水后,又有7gA 析出,则在20℃时A物质的溶解度是________。
12.已知氯化铵在100℃时的溶解度为75 g,现将100℃的氯化铵的饱和溶液50 g,经加热蒸发结晶后剩余饱和溶液32.5g(100℃),求蒸发掉多少克水?
现有20℃时硝酸钾饱和溶液100g,若将其升温至60℃,还需加入多少克硝酸钾才能饱和?若降温至10℃,可得饱和溶液多少克?
14. 在加热情况下,300 g水中溶解了231.9 g氯化铵,如果把这种溶液冷却到10℃,会有多少克氯化铵析出?如果把析出的氯化铵在10℃又配成饱和溶液,需加水多少克(10℃时氯化铵溶解度为33.3 g)。
