甲型流感病毒抗原检测方法
甲型流感的分子诊断技术与实验室检测方法

甲型流感的分子诊断技术与实验室检测方法甲型流感是一种由甲型流感病毒引起的急性呼吸道传染病,其传播迅速且易感染大量人群。
为了准确诊断和及时干预,科学家们开发出了多种分子诊断技术和实验室检测方法。
本文将介绍几种常用的技术与方法,以提高对甲型流感的检测效率和诊断准确性。
一、聚合酶链式反应(PCR)技术PCR技术是一种灵敏度高、特异性强的分子诊断技术,已被广泛应用于甲型流感的检测中。
该技术通过放大甲型流感病毒基因组中特定的DNA片段,从而使其能够被检测到。
PCR技术可在短时间内,从患者的样本中检测到甲型流感病毒的存在,并确定其亚型。
此外,PCR 技术还能够对病毒的基因组进行序列分析,从而确定其突变情况和传播途径。
二、实时荧光定量PCR(qPCR)技术实时荧光定量PCR技术是PCR技术的一种改进版本,其主要优势在于可实现对病毒数量的精确测量和即时定量。
该技术结合了PCR和荧光探针技术,使得可以在PCR反应过程中实时监测目标序列的扩增情况。
实时荧光定量PCR技术能够快速检测出甲型流感病毒的数量,并对病毒载量进行准确测量,帮助医生判断病情的严重程度,指导治疗决策。
三、免疫荧光技术免疫荧光技术是一种通过特定的抗体和荧光探针对病毒进行检测的技术。
在甲型流感的实验室检测中,科学家们通常采用免疫荧光技术检测病毒的抗原。
该技术的原理是将含有甲型流感病毒的标本与特异性荧光标记的抗体结合,然后通过荧光显微镜观察是否有荧光信号出现。
免疫荧光技术能够准确、快速地检测出甲型流感病毒的存在,并且可以对其亚型进行鉴定。
四、核酸测序技术核酸测序技术是一种可以解析病毒基因组序列的方法,可以帮助科学家们了解甲型流感病毒的基因组结构和功能。
通过高通量测序技术,科学家们可以在较短的时间内获取大量的病毒基因组序列信息。
这些信息有助于了解甲型流感病毒的变异情况,筛选药物治疗靶点,并指导疫苗的设计与开发。
五、免疫学检测方法除了分子诊断技术,免疫学检测方法也发挥着重要作用。
人甲型H1N1流感病例标本采集和实验室检测指南

人甲型H1N1流感病例标本采集和实验室检测指南(暂行)甲型H1N1流感病毒的检测所有甲型H1N1流感疑似病例应该采集上呼吸道标本来检测甲型H1N1流感病毒。
推荐采集的呼吸道标本:疾病发病后应尽快采集如下标本:鼻咽拭子/吸取物或者鼻腔冲洗液/吸取物。
如果不能收集这些标本,可合并鼻拭子与口咽拭子。
气管插管的病人也应收集气管吸取物。
标本应置于无菌病毒运输液( VTM ),并立即用冰块或冰排保存或置于4 ℃(冰箱),并马上运送至实验室。
临床样品收集人员及实验室人员的感染控制指导请见相关文件。
理想的情况下,标本应使用头部为合成纤维的拭子(例如,聚酯纤维),用铝或塑料做杆。
不推荐棉拭子和木杆。
不能用海藻酸钙做的拭子收集标本。
标本采集管应包含3毫升病毒运输液(例如,含有蛋白质稳定剂,阻止细菌和真菌生长的抗生素,缓冲液)。
临床标本储存所有呼吸道标本应保存在4℃,并尽快放置在-70℃。
如果没有-70℃度冰箱,标本应保存在4℃,但不应超过4天。
临床标本运输临床标本应按照A类包装要求运送,并用干冰运输。
所有标本应标示清楚。
疑似病例标本运送应包含的信息请参照禽流感标本运输。
检测程序呼吸道标本应首先应用real time RT-PCR方法检测A型流感病毒的M基因、Swine ( H1N1)的HA基因和NP基因,以及质控对照RNP基因。
同时,接种MDCK细胞或SPF 鸡胚进行病毒分离,并测定病毒的全基因组序列。
推荐的检测方法用Real-time RT-PCR方法检测甲型H1N1流感病毒。
其他检测方法快速流感抗原检测一些商用快速检测可以区分A和B型流感病毒。
快速检测实验A型流感阳性的病例符合可能病例的标准(见上文)。
这些实验对检测人感染猪流行性感冒( H1N1病毒)病毒临床标本的敏感性和特异性未知,而且检测季节性流感病毒的灵敏度不佳。
因此,快速检测阴性结果可能是假阴性,不能作为甲型H1N1流感感染的最后诊断。
免疫荧光法(或装配的IFA )免疫荧光试验可以区分A和B型流感病毒。
甲型乙型流感病毒抗原检测试剂盒(胶体金法)说明书

甲型/乙型流感病毒抗原检测试剂盒(胶体金法)说明书【产品名称】甲型/乙型流感病毒抗原检测试剂盒(胶体金法)【包装规格】20人份/盒【预期用途】甲型/乙型流感病毒抗原检测试剂盒(胶体金法)(以下简称为:Flu检测试剂)用于定性检测人体鼻腔抽洗液、鼻腔拭子、咽喉拭子样本中的甲乙型流感病毒(Influenza viruses,Flu)抗原。
流行性感冒病毒(Influenza viruses, Flu)简称流感病毒,是引起流行性感冒的病原体,流行性感冒是由甲(A)、乙(B)、丙(C)三型流感病毒分别引起的急性呼吸道传染病,它传染性强、传播快、潜伏期短、发病率高。
A型流感病毒常以流行形式出现,能引起世界性流感大流行,它在动物中广泛分布,并也能在动物中引起流感流行和造成大量动物死亡。
B型流感病毒常常引起局部暴发,不引起世界性流感大流行。
C型流感病毒主要以散在形式出现,主要侵袭婴幼儿,一般不引起流行。
因此对于A型和B型流感病毒的检测有相对较大的临床意义。
【检验原理】Flu检测试剂运用胶体金标记和免疫层析技术,检测临床样本中的Flu抗原并以可视信号的方式直接显示结果。
加入充分裂解的临床样本后,Flu抗原在试剂条的前段与胶体金标记的Flu抗体结合,形成抗原-抗体复合物,该复合物在试剂膜上层析流动,经Flu单克隆抗体条带(Flu A或Flu B测试线)时再次结合Flu单克隆抗体,形成双抗体夹心,并显现紫红色条带,此条带的出现表明样本中存在Flu抗原。
当复合物继续层析流动至吸附区,在控制区(C线)与包被羊抗鼠多克隆抗体的条带结合,此条带作为试剂合格和正确操作的质控线,不论样本中是否存在Flu抗原,此条带都应当出现。
【主要组成成份】本试剂主要原材料包括鼠抗Flu单克隆抗体、羊抗鼠多克隆抗体、硝酸纤维素膜、玻璃纤维膜和无纺布。
Flu裂解液的主要成分为:三羟甲基氨基甲烷、叠氮化钠和牛血清白蛋白。
检测需要已提供的材料Flu检测试剂20人份样本抽提管20只Flu裂解液1瓶说明书1份工作台1只【储存条件及有效期】原包装储存在室温条件下(4o C-30o C),阴凉避光干燥处储存,忌冷冻。
甲型乙型流感病毒抗原检测试剂盒(免疫层析法)说明书
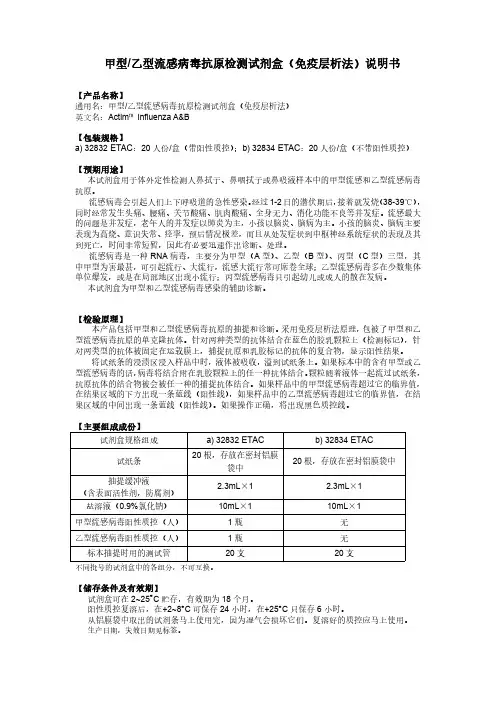
【主要组成成份】
试剂盒规格组成
a) 32832 ETAC
试纸条
20 根,存放在密封铝膜 袋中
抽提缓冲液 (含表面活性剂,防腐剂)
2.3mL×1
盐溶液(0.9%氯化钠)
10mL×1
甲型流感病毒阳性质控(人)
1瓶
乙型流感病毒阳性质控(人)
1瓶
标本抽提时用的测试管
20 支
不同批号的试剂盒中的各组分,不可互换。
A. 滴加抽提缓冲液
B.浸入并注意液体前端
C. 阴 A B A 性型型型 流流和 感感 B 型 流 感
【阳性判断值】
1. 实验操作正确 出现黑色的质控线,表明实验操作正确。
2. 甲型流感病毒阳性 如果,除了黑色质控线外,在结果区的下方出现 1 条蓝线,表明甲型流感病毒阳性。
3. 乙型流感病毒阳性 如果,除了黑色质控线外,在结果区的中部出现 1 条蓝线,表明乙型流感病毒阳性。
【检验原理】 本产品包括甲型和乙型流感病毒抗原的抽提和诊断。采用免疫层析法原理,包被了甲型和乙
型流感病毒抗原的单克隆抗体。针对两种类型的抗体结合在蓝色的胶乳颗粒上(检测标记),针 对两类型的抗体被固定在运载膜上,捕捉抗原和乳胶标记的抗体的复合物,显示阳性结果。
甲型流感病毒抗原检测试剂使用说明-Alere

【产品名称】通用名称:甲型/乙型流感病毒抗原检测试剂盒(胶体金法)英文名称:Alere BinaxNOW® Influenza A&B Card【包装规格】22人份/盒。
【预期用途】甲型/乙型流感病毒抗原检测试剂盒(胶体金法)是一种体外免疫层析试验,用于定性检测鼻咽拭子样本中的甲、乙型流感病毒核蛋白抗原,可快速地对甲、乙型流感病毒感染做出辅助鉴别诊断。
试验简介流感是发生在呼吸道的具有高度传染性的急性病毒感染,它属于传染病范畴,可通过咳嗽或打喷嚏时排出的带有活病毒的气溶胶而在人与人之间传播。
每年的秋季和冬季都可爆发流感1.甲型流感病毒的流行性比乙型流感病毒流行性要强,造成的病情也更严重,并且大多数严重的流感也都是由它引起的,而乙型流感则相对比较缓和。
针对甲、乙型流感的快速诊断试验对获取有效的抗病毒治疗是很有意义的。
对流感做出快速诊断不但可减少病人住院的天数,减少抗菌素的使用,而且可减少病人的住院费用1。
甲型/乙型流感病毒抗原检测试剂盒(胶体金法)提供了一种用鼻咽拭子标本对甲型和乙型流感进行简便快速诊断的方法,使用方便,结果快速,在急诊检验中提供的信息可帮助医生选择治疗方案并做出是否需要收住院的决定。
甲型流感病毒有许多亚型,有些亚型可在鸟类中发现3。
1997年首次报道人类甲型禽流感(H5N1,主要发生于鸟类的一种流感病毒亚型),此后,在人群中出现了H5N1病例,使人们对H5N1关注起来,H5N1的变异使得它更易在人群间传播4,由于备案的禽流感感染病人比例很低,快速试验在该类病人治疗中利用度尚不得知。
【检验原理】甲型/乙型流感病毒抗原检测试剂盒(胶体金法)使用的是薄膜免疫层析技术,它利用具有高度敏感性的单克隆抗体来检测鼻咽拭子标本中的甲型和乙型流感病毒的核蛋白抗原这些单克隆抗体连同一种对照抗体分别被固定到膜支持物上,形成三条独特的线。
膜支持物跟其他试剂/垫结合在一起构成检测条。
检测条位于一个称作检测卡的书型铰链状的纸板中。
流感病毒检验及相关方法

流感是因流感病毒造成的一种常见的人类呼吸道感染疾病,具有流行范围广、发病率高等特点,其不仅极易对儿童、老年人及免疫力低下的人群造成不可估量的危害,也给社会公共卫生的维持带来一定负担。
我国是流感病毒高发区,近年来,流感发生率不断升高,直接威胁人类生命健康。
目前临床对流感病毒诊断方法主要包括病毒分离、免疫学检测以及核酸检测等。
为了快速、准确诊断出流感病毒,并给予其特异抗病毒治疗,进而有效控制疫情,对降低疾病发病率及病死率,本人根据自身实际的工作经验,结合一些相关的理论知识。
就流感病毒检验及相关方法阐述意见。
①酶联免疫吸附试验:免疫学检测是检测流感病毒常用方式之一,其主要依据抗原抗体反应进行检验,一般需要对血清中的抗原或者抗体进行检测,而酶具有较高的催化频率,可在较大程度上放大其作用,提高测定结果的灵敏度。
在检测抗原与抗体时,可运用不同的酶联免疫吸附试验,具有方便快捷、灵敏度及特异度高等优点,是当前临床较为常用的免疫测定方式之一。
此外,在不同流感病毒亚型间,不同病毒之间均不存在交叉反应现象;根据部分研究的结果可发现,酶联免疫吸附法操作简单,具有较高灵敏度及特异度,可广泛应用于流感病毒实验室检测。
②聚合酶链反应 (PCR):聚合酶链反应(PCR)是核酸检测的一种,其通过分子生物学检测技术实现经 PCR 检测流感病毒,其技术原理在于可以在较短时间内添加大量特异性 DNA片段完成病毒检测,具体检测过程中仅需要少量样品即可完成检测工作的一项生物学技术,具有敏感性、特异性高、可重复操作、速度快等特点,可在较短时间内完成收集样本并获得最终的检测结果工作,对早期诊断流感病毒感染具有较高价值。
PCR 方法包括实时荧光定量方法、RT-PCR 方法、多重 RT-PCR 方法。
其中 RTPCR 方法包括检测 HA 基因片段、NA基因片段,目前检测未知流感,通过合并引物扩增病毒的基因片段完成分型。
研究显示,PCR技术用于病原体的确定,可有效检测出早期感染患者,与病毒分离法比,其敏感性是其500倍,同时可更加直观的检测荧光因子,有效降低检测假阳性可能性,但一般的PCR技术具有一定污染。
甲型流感病毒抗原检测试剂使用说明(胶体金)-alerebinaxnow
甲型/乙型流感病毒抗原检测试剂盒(胶体金法)使用说明书【产品名称】通用名称:甲型/乙型流感病毒抗原检测试剂盒(胶体金法)英文名称:Alere BinaxNOW® Influenza A&B Card【包装规格】22人份/盒。
【预期用途】甲型/乙型流感病毒抗原检测试剂盒(胶体金法)是一种体外免疫层析试验,用于定性检测鼻咽拭子样本中的甲、乙型流感病毒核蛋白抗原,可快速地对甲、乙型流感病毒感染做出辅助鉴别诊断。
试验简介流感是发生在呼吸道的具有高度传染性的急性病毒感染,它属于传染病范畴,可通过咳嗽或打喷嚏时排出的带有活病毒的气溶胶而在人与人之间传播。
每年的秋季和冬季都可爆发流感1.甲型流感病毒的流行性比乙型流感病毒流行性要强,造成的病情也更严重,并且大多数严重的流感也都是由它引起的,而乙型流感则相对比较缓和。
针对甲、乙型流感的快速诊断试验对获取有效的抗病毒治疗是很有意义的。
对流感做出快速诊断不但可减少病人住院的天数,减少抗菌素的使用,而且可减少病人的住院费用1。
甲型/乙型流感病毒抗原检测试剂盒(胶体金法)提供了一种用鼻咽拭子标本对甲型和乙型流感进行简便快速诊断的方法,使用方便,结果快速,在急诊检验中提供的信息可帮助医生选择治疗方案并做出是否需要收住院的决定。
甲型流感病毒有许多亚型,有些亚型可在鸟类中发现3。
1997年首次报道人类甲型禽流感(H5N1,主要发生于鸟类的一种流感病毒亚型),此后,在人群中出现了H5N1病例,使人们对H5N1关注起来,H5N1的变异使得它更易在人群间传播4,由于备案的禽流感感染病人比例很低,快速试验在该类病人治疗中利用度尚不得知。
【检验原理】甲型/乙型流感病毒抗原检测试剂盒(胶体金法)使用的是薄膜免疫层析技术,它利用具有高度敏感性的单克隆抗体来检测鼻咽拭子标本中的甲型和乙型流感病毒的核蛋白抗原这些单克隆抗体连同一种对照抗体分别被固定到膜支持物上,形成三条独特的线。
膜支持物跟其他试剂/垫结合在一起构成检测条。
流感病毒两种快速抗原检测方法的对比分析
流感病毒两种快速抗原检测方法的对比分析陈晨;范清琪;陈刚;朱梦琪;吴晶;张文宏;金嘉琳【摘要】目的分析比较两种流感病毒抗原检测试剂盒(胶体金免疫层析法)检测的一致性,评价新型的基于银盐扩增技术的流感病毒抗原检测试剂盒在临床中的应用.方法选择2015年1月1日―2月28日在复旦大学附属华山医院就诊的体温>37.5℃,且具有流感样症状的患者,同时采集双份鼻拭子标本.采用IMMUNO AG Cartridge Flu AB试剂盒(简称AG1法)与甲型/乙型流感病毒抗原检测试剂盒(简称CV法)同时检测,并作PCR检测以确证.结果共检测患者91例,AG1法测定甲型流感病毒阳性7例,乙型流感病毒阳性53例;CV法测定甲型流感病毒阳性7例,其中弱阳性3例,乙型流感病毒阳性50例,其中弱阳性4例;PCR法检测甲型流感病毒阳性8例,乙型流感病毒阳性60例.AG1法检测甲型流感病毒灵敏度87.5%,特异度100%,乙型流感病毒灵敏度88.3%,特异度100%.CV法检测甲型流感病毒灵敏度87.5%,特异度100%,乙型流感病毒灵敏度83.3%,特异度100%.AG1法与CV法两种抗原快速检测甲型流感病毒检测的阳性符合率100%,乙型流感病毒的阳性符合率94.3%.结论两种流感病毒快速抗原检测方法一致性较好,AG1检测法可以减少针对弱阳性标本的人为判读误差,可应用于流感早期诊断.%Objective To analyze the consistency of two rapid antigen assays for the diagnosis of influenza A and B. We evaluated the clinical usefulness of silver amplification immunochromatography influenza virus detectionkit.Methods Nasopharyngeal swab samples were collected from patients who were suspected of influenza at Huashan Hospital between January and February 2015. Two samples were collected from the same one patient. The samples were tested simultaneously by using IMMUNO AG CartridgeFlu AB kit (AG1) and commercial immunochromatographic assay kit, Clearview exact influenza A&B (CV). PCR method was used as reference.Results A total of 91 samples were tested, of which 7 were positive for influenza A and 53 positive for influenza B by AG1 system; 7 positive for influenza A and 50 positive for influenza B by CV system; and 8 positive for influenza A and 60 positive for influenza B by PCR. The sensitivity and specificity of the AG1 system were 87.5 % and 100 % for influenza A, and 88.3 % and 100 % for influenza B; while the CV system showed sensitivity and specficity of 87.5 % and 100 % for influenza A, 83.3 % and 100 % for influenza B. The AG1 system was 100 % consistent with the CV system in the positive rate of influenza A, and 94.3 % consistent withthe CV system in the positive rate of influenza B.Conclusions The AG1 system is well consistent with the conventional immunochromatography-based diagnostic tests in diagnosis of influenza. The AG1 system is usefulin earlier diagnosis of influenza due to fewer human error in result interpretation.【期刊名称】《中国感染与化疗杂志》【年(卷),期】2017(017)001【总页数】4页(P29-32)【关键词】流感;快速抗原检测;免疫层析法【作者】陈晨;范清琪;陈刚;朱梦琪;吴晶;张文宏;金嘉琳【作者单位】复旦大学附属华山医院感染科,上海 200040;复旦大学附属华山医院感染科,上海 200040;复旦大学附属华山医院感染科,上海 200040;复旦大学附属华山医院感染科,上海 200040;复旦大学附属华山医院感染科,上海 200040;复旦大学附属华山医院感染科,上海 200040;复旦大学附属华山医院感染科,上海 200040【正文语种】中文【中图分类】R373.13近年来流感的疫情频繁出现,2005年H5N1人禽流感,2009年新甲型H1N1流感,2013年的H7N9禽流感疫情,引起了人们对流感更多的认识与关注。
不同甲型流感病毒抗原检测方法的对比分析
不同甲型流感病毒抗原检测方法的对比分析发表时间:2019-03-19T17:31:57.893Z 来源:《医师在线》2018年10月19期作者:许毅[导读] 可用于大样本筛查检测,免疫渗滤法的灵敏度较高,可用于临床疾病诊断。
(西安航天总医院;710100)【摘要】目的:对比分析不同甲型流感病毒抗原检测方法。
方法:取200例流感样患者的鼻咽部史拭子,分别经胶体金法、免疫渗滤法甲型流感病毒抗原检测试剂盒检测,检测结果对照甲型流感病毒核酸检测结果比较,评价不同检测方法诊断效能。
结果:免疫渗滤法的阳性检出率、灵敏度明显高于胶体金法(P<0.05)。
结论:甲型流感病毒抗原的两种检测方法各有优势,胶体金法操作简单方便,可用于大样本筛查检测,免疫渗滤法的灵敏度较高,可用于临床疾病诊断。
【关键词】甲型流感病毒;抗原;胶体金法;免疫渗滤法[ 中图分类号 ]R2 [ 文献标号 ]A [ 文章编号 ]2095-7165(2018)19-0297-02随着流感疫情频繁发生,人们对流感的关注与认知程度不断加深,该疾病为当前唯一全球性监测疾病,威胁着人们生命健康,尤其是儿童、免疫力低下者与老年人群[1]。
当前临床并无特效药物治愈流感,但疾病早期应用对应的抗病毒药物,可缩短病情持续时间,改善患者症状,减少并发症发生[2]。
因此,加强病情监测,快速准确诊断疑似病例,对于及早控制病情发展,具有积极的意义。
本次研究中,以甲型流感病毒核酸检测结果为标准,对比分析胶体金法、免疫渗滤法检测试剂临床诊断价值,总结如下。
1资料与方法1.1一般资料研究对象为2016年1月到2017年5月不明原因的发热且合并呼吸道症状的200例患者,符合体温>37.5℃。
合并以下症状之一:流涕乏力、喉咙痛、咳嗽、关节疼痛、头痛等全身症状,患者获得知情权,签署同意书。
1.2试剂与仪器甲型流感病毒抗原快速检测试剂分别为甲型流感病毒抗原检测试剂盒(dot-ELISA 法)、甲型流感病毒检测试剂盒(胶体金法)。
甲型流感病毒感染病毒检测的方法有哪些?
甲型流感病毒感染病毒检测的方法有哪些?甲型流感是一种由甲型流感病毒引起的呼吸道传染病。
与其他呼吸道感染相比,甲型流感的病毒传播能力较强,而且症状也比较严重。
在预防、治疗和后期恢复中,正确的检测方法是非常重要的。
本文将介绍甲型流感病毒感染的检测方法以及预防、治疗和后期恢复的注意事项。
甲型流感病毒感染的检测方法1.核酸检测(RT-PCR):核酸检测是目前甲型流感病毒感染的主要检测方法。
这种方法通过采集患者的呼吸道标本,如咽拭子、鼻咽拭子或痰液,提取其中的病毒核酸,然后利用反转录聚合酶链反应(RT-PCR)技术进行检测。
核酸检测的优点是准确度高,能够检测出病毒的存在,但需要在实验室条件下进行,耗时较长。
2.快速抗原检测(Rapid Antigen Test):快速抗原检测是一种简便、迅速的甲型流感病毒感染检测方法。
该方法通过检测标本中的特定病毒抗原,可以在数分钟内快速筛查出感染情况。
然而,与核酸检测相比,快速抗原检测的准确性略低,有时会出现假阴性结果。
因此,如果快速抗原检测结果为阴性,但临床症状明显,仍然需要进行核酸检测以排除感染。
3.血清学检测(Serologic Test):血清学检测通过检测患者血液中的特定抗体来判断是否感染甲型流感病毒。
这种检测方法主要用于疫情调查和流行病学研究,对于早期感染的诊断准确性较低。
以上三种检测方法各有优劣,医生会根据病情和实际需要选择合适的方法进行检测。
预防甲型流感病毒感染的注意事项预防甲型流感病毒感染是非常重要的,可以采取以下措施:1.接种疫苗:甲型流感病毒感染的最有效预防方法是接种相关的流感疫苗。
每年秋季接种疫苗可以有效提高免疫力,减少感染的风险。
接种疫苗还可以降低患者的病情严重程度,减少并发症的发生。
2.保持良好的个人卫生:勤洗手、使用洗手液消毒、避免接触口鼻眼等黏膜部位,是预防病毒传播的简单有效措施。
此外,尽量避免与感染者密切接触,特别是在流感高发季节。
3.注意健康状况:保持良好的生活习惯,均衡饮食,增强体质,提高免疫力,可以降低感染甲型流感病毒的风险。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
谢谢大家!
鼻咽拭子样本检测结果与核酸检测结果比较, 灵敏度达到91.3%,特异性达到99.65%。 咽拭子样本检测结果与核酸检测结果比较,灵 敏度达到71.13%,特异性达到100%。 样本采集不当可能导致阴性结果。 对于进行了抗病毒药物治疗的患者,其体内病 毒含量大为下降,会造成阴性结果。建议在使 用抗病毒药物前检测。
H7N9核酸检测标本采集、运输 及注意事项
标本的保存 用于病毒分离和核酸检测的标本应尽快进行检测 。 24小时内能检测的标本,置于4℃保存;不能于 24小时内检测的标本,置于-70℃或以下保存。 (如无-70℃保存条件,则于-20℃冰箱暂存)。 血清可在4℃存放3天、-20℃以下长期保存。 注 意:标本运送期间应避免反复冻融。
1.将样品充分混匀后,取样200ul,加 入样品处理瓶中
滴加14滴裂解液(约400ul)到样品 处理瓶中。充分混匀。
滴加5滴(约200ul)酶标试剂到反应 膜上
等待酶标试剂完全渗入后,再等待2-3 分钟,让其完全反应
每次滴加12滴洗涤液洗涤2次
加2滴显色液显色,待显色液完全渗员会印发的 《人感染H7N9禽流感医院感染预防与控制 技术指南》的要求:医务人员接触患者的 血液、体液、分泌物、排泄物、呕吐物及 污染物品时应戴清洁手套,脱手套后洗手。
甲型流感病毒抗原检测盒
甲型流感病毒抗原检测
样本采集及送检注意事项
采集拭子应使用检验科提供的专用微生物 拭子(切勿使用普通棉签)。 标本采集及检测应严格按照相关防护要求 进行防护,避免感染。本试验使用鼻咽拭 子标本进行检测。 采集样本用品共两种,分别是:鼻咽拭子 和样品保存液,临床需要时到检验科领取。
加1滴终止液,3分钟内判断结果。终 止5分钟后的结果无临床意义
由于阳性样品的强度不同,检测点的显色 可能出现颜色深浅的现象。在规定的观
察时间内,不论颜色深浅,即使非 常弱的显色也应判定为阳性结果。
渗滤装置从包装中取出后请在20分钟内使 用。 样品处理瓶盖必须拧紧防止样品漏出,滴 加时应使瓶中液体全部滴到加样孔中。 滴加试剂时瓶口应垂直对准加样孔,保证 液滴体积的准确性。
注意事项
样本采集不当、样本储存不当、标本不新鲜或样本反复冻融均会影响 检测结果。
采集的样本若存在个别高浓度药物(如鼻腔喷雾药剂)会影响检测结 果。 检测试剂仅对样本中的A型流感病毒抗原提供定性检测。 阳性结果仅表示样本中A型流感病毒抗原的存在,而不等作为机体感 染A型流感病毒的唯一标准。 阴性结果并不能完全排除感染A型流感病毒的可能性。结果阴性但有 临床症状存在,建议使用其他临床方法进行测试。
甲型流感病毒抗原检测
鼻腔分泌物采集: 收集鼻腔分泌物 时,将拭子插入 鼻腔中分泌物最 多处,轻轻转动 并向鼻腔内部推 动拭子,直至鼻 甲(离鼻孔 2.0cm-2.5cm)受 阻处,贴鼻腔壁 转动拭子三次, 取出拭子。
甲型流感病毒抗原检测
•咽喉分泌物采集: 将拭子从口腔完 全插入咽喉中, 以咽后壁、上颚 扁桃的发红部位 为中心,适度用 力擦拭双侧咽扁 桃体及咽后壁, 应避免触及舌部, 取出拭子。
样品处理
采集完毕的微生物拭子插入检验科提供的 专用样品保存液中,紧靠管子内壁旋转多 次使样品尽可能溶解在溶液中,最后把拭 子头留于瓶中,旋紧盖子(避免液体漏出) 后送检。见下图:
处理后的样品应及时送检,也可暂存与28℃(不超过12小时),中午、夜间采集 的标本送到急诊化验室2-8℃密封保存, 正常上班后检测。 检测方法如下图:
甲型流感病毒抗原检测方法
2013-04-29
预期用途
流感是由流感病毒引起的急性呼吸道传染 病,潜伏期为1-3天,患者发病突然,主要 症状有畏寒、头痛、浑身肌肉疼痛、无力、 干咳等。
万泰生物甲流感病毒抗原诊断试剂盒
采用免疫渗滤技术,定性检测人鼻咽拭子或咽拭 子样本中的甲流感病毒抗原。 原理:采用双抗体夹心法原理检测甲流感病毒核 蛋白抗原。硝酸纤维膜上预包被抗-FluA NP的单 克隆抗体,若待测样品中存在FluA NP抗原,经 裂解液处理后,抗原可与包被抗体结合,形成抗 原-抗体复合物(Ag-Ab),随后加入抗-Flu A NP酶标试剂(Ab-HRP),形成抗体-抗原-酶标抗 体复合物(Ab-Ag-Ab-HRP),最后通过酶催化底物 显色,生成蓝色产物,若样品中无FluA NP抗原, 不显色。
