13..4理想气体的等温过程和绝热过程
热力学理想气体的等温过程

热力学理想气体的等温过程热力学理想气体的等温过程是指在恒定温度下进行的过程。
在这个过程中,气体的温度保持不变,但压力和体积却有所变化。
热力学理想气体等温过程是理解气体性质和热力学定律的重要基础。
本文将介绍热力学理想气体的等温过程的基本原理和特点。
一、基本原理根据热力学定律,热力学理想气体的等温过程遵循以下基本原理:1. 温度不变:在等温过程中,气体的温度保持恒定。
这是因为外界对气体做功或从气体中吸收的热量正好能够抵消系统放出的热量,使得气体的温度保持不变。
2. 理想气体状态方程:根据理想气体状态方程PV = nRT(其中P为气体的压力,V为气体的体积,n为物质的摩尔数,R为气体常数,T为温度),在等温过程中,气体的压力和体积成反比。
当气体的体积增大时,压力减小;反之,当气体的体积减小时,压力增大。
3. 绝热过程:在等温过程中,外界对气体所做的功可看做绝热过程。
绝热过程是指在无热量交换的情况下,仅通过气体本身内部的压缩或膨胀来做功。
在绝热过程中,气体的温度和压力同时发生变化。
二、特点和实例热力学理想气体的等温过程具有以下特点:1. 压强随体积变化:根据理想气体状态方程,在等温过程中,气体的压强与体积成反比。
当气体体积增大时,气体的压强减小;反之,当气体体积减小时,气体的压强增大。
2. 外界对气体做的功:在等温过程中,外界对气体所做的功等于负的热力学定量。
即外界所做的功正好能够和气体放出的热量相互抵消,使气体的温度保持恒定。
3. 等量热量交换:在等温过程中,系统和外界之间存在等量的热量交换。
当气体的体积发生变化时,外界对气体做的功与系统放出的热量大小相等,从而使得气体内部的能量保持不变。
以下是一个等温过程的实例来说明热力学理想气体的等温过程:考虑一个容器中的理想气体,在恒定温度下进行等温过程。
一开始,气体的压力为P1,体积为V1,温度为T。
外界对气体进行压缩,使得气体体积减小为V2。
根据理想气体状态方程PV = nRT,当体积减小时,气体的压力会增大。
理想气体的等温与绝热过程

理想气体的等温与绝热过程理想气体是物理学中一个重要的理想化模型,它假设气体的分子之间没有相互作用,体积可以忽略不计。
在实际的等温与绝热过程中,理想气体表现出了不同的特性和行为。
本文将深入探讨理想气体在等温与绝热过程中的特点和数学表达方式。
等温过程是指气体在恒定温度条件下发生的过程。
在等温过程中,理想气体的温度保持不变,因此根据理想气体状态方程PV=nRT,压强和体积成反比。
也就是说,当体积增大时,压强会相应减小,反之亦然。
这种关系可以用数学表达式PV=常数来表示,其中常数等于nRT。
绝热过程是指气体在没有热量交换的情况下发生的过程。
在绝热过程中,理想气体的内部能量保持不变,因此根据理想气体状态方程PV=nRT,压强和体积的乘积保持不变。
也就是说,当体积减小时,压强会相应增大,反之亦然。
这种关系可以用数学表达式P₁V₁^γ=P₂V₂^γ来表示,其中γ是气体的绝热指数,对于大多数单原子气体而言,γ≈5/3。
在等温过程中,理想气体的温度保持恒定,因此内能的增加和对外做功相互抵消。
根据气体内能的公式(因为内能只与温度有关),ΔU=nCvΔT,其中ΔU表示内能的变化,n表示物质的摩尔数,Cv表示摩尔定容热容,ΔT表示温度变化。
由于等温过程中温度不变,因此ΔT=0,所以ΔU=0。
这意味着在等温过程中,理想气体的内能保持不变。
在绝热过程中,理想气体没有热量交换,因此热量的增加全都被用于对外做功。
根据绝热过程中的热力学第一定律,Q-W=ΔU,其中Q 表示吸收的热量,W表示对外做的功,ΔU表示内能的变化。
由于绝热过程中没有热量交换,因此Q=0,所以W=ΔU。
这意味着在绝热过程中,理想气体的内能变化全部用于对外做功。
绝热过程和等温过程的比较可以看出,等温过程中理想气体对外做的功为零,内能的变化为零;而绝热过程中理想气体对外做的功不为零,内能的变化全部用于对外做功。
这两个过程都是理想气体在不同条件下的特性,对于理论研究和实际应用都有着重要的意义。
大学物理第 13 章 第 2 次课 -- 理想气体的等温过程和绝热过程..
p1
2'
T C
V2 V2' V1 10
T1 1
V1 V
负号表示外界对气体做功. 2)绝热过程做的功
o
氢气为双原子气体, 表查13-1得 =1.41, CV,m= 20.44 J· mol-1· K-1 . 由绝热过程方程 由此可得,
TV
1
常数c'
得
T1V1
1
T2V2
1
上海师范大学
3 /12
§13.4
理想气体的等温过程和绝热过程
二、绝热过程
绝热过程: 理想气体状态发生变化的过程中, 气体与外界没有热量传递. 绝热过程是一种理想过程, 实际的过程不可能是真正的绝热过程. 但在状态的变化过程中, 如果系统与外界的热传递很小, 以致可以忽略, 则这
种过程可以近似地视为绝热过程. 如汽车发动机气缸中气体的膨胀就可以近 p ( p1 ,V1 , T1 ) 似地看成是绝热过程.
6 /12
上海师范大学
将
Cp,m R CV ,m , C p,m / CV ,m 代入上式, 简得
C p ,m dV dp CV, m V p
§13.4 理想气体的等温过程和绝热过程 (CV ,m R) dV dp CV, m V p
dV dp 0 V p
上海师范大学
(14)
5 /12
§13.4 2. 绝热过程的物态方程 理想气体的物态方程:
理想气体的等温过程和绝热过程
pV RT
V R 常数 等压过程: T p
p R 常数 等体过程: T V 等温过程: pV 常数
绝热过程中, 状态参量p,V,T都发生变化, 能否写出两个量之间的变化关系? 对理想气体的物态方程
理想气体中的等温过程与绝热过程

理想气体中的等温过程与绝热过程在研究理想气体的性质和行为时,等温过程和绝热过程是两个重要的概念。
它们描述了气体在外界条件改变下的变化规律,是热力学和物理学中的基础概念之一。
本文将详细介绍等温过程和绝热过程的定义、特点和数学表达,以及它们在实际应用中的意义和重要性。
一、等温过程等温过程是指在气体与外界保持恒定温度的条件下,体积和压力发生变化的过程。
根据理想气体状态方程PV=nRT,当温度保持不变时,压力和体积成反比关系。
也就是说,当压力增加时,体积减小;压力减小时,体积增加,以保持气体的温度不变。
以一定量的理想气体为例,假设其体积从V₁变化到V₂,对应的压力由P₁变化到P₂。
根据等温过程的特点,我们可以得到以下数学表达式:P₁V₁ = P₂V₂这个表达式被称为爱德华·博伯定律,也是描述等温过程中气体性质的重要公式之一。
从公式中可以看出,当气体的温度不变时,压力和体积之间存在一个不变的乘积关系。
等温过程在实际应用中有着重要的意义。
在工程领域中,等温过程常常用于设计和优化热机、制冷设备等。
在化学实验中,等温过程也是调整反应条件和控制反应速率的基础。
二、绝热过程绝热过程是指在理想气体与外界没有热量交换的条件下,体积和温度发生变化的过程。
在绝热过程中,气体与外界之间没有能量的转移,因此其内能保持不变。
根据内能守恒定律,绝热过程中气体的温度变化与体积变化呈反比关系。
同样以一定量的理想气体为例,假设其体积从V₁变化到V₂,对应的温度由T₁变化到T₂。
根据绝热过程的特点,我们可以得到以下数学表达式:T₁V₁^(γ-1) = T₂V₂^(γ-1)其中,γ为气体的绝热指数,表示气体热容比。
对于单原子分子气体,γ约等于5/3;对于双原子分子气体,γ约等于7/5。
从上述公式中可以看出,当气体的体积增加时,温度会降低,反之亦然。
绝热过程的应用也非常广泛。
例如,在内燃机中,汽缸中的气体在燃烧过程中发生绝热膨胀,从而驱动活塞运动,产生功。
热学练习题理想气体的等温过程与绝热过程的比较

热学练习题理想气体的等温过程与绝热过程的比较在热学中,理想气体的等温过程和绝热过程是两个重要的概念。
虽然它们都涉及气体的热力学性质,但是两者之间存在着明显的区别。
本文将就理想气体的等温过程和绝热过程展开比较和分析。
一、理想气体的等温过程理想气体的等温过程是指在恒温条件下进行的过程。
在这个过程中,系统的温度保持不变,而气体的压力和体积会相应地发生变化。
根据理想气体的状态方程PV=nRT(式中P为气体的压力,V为体积,n为物质的量,R为气体常数,T为温度),我们可以得到等温过程的数学表达式为PV=常数。
在等温过程中,当气体的体积减小时,压力会增加,反之亦然。
这符合气体的玻意耳定律,即在恒温条件下,气体的压力和体积成反比。
在理想气体的等温过程中,工作与热量的转化也是平衡的,即所吸收的热量等于所做的功。
二、理想气体的绝热过程理想气体的绝热过程是指在没有热量交换的情况下进行的过程。
在这个过程中,气体的内能发生改变,但是温度保持不变。
根据绝热条件下的理想气体状态方程,我们可以得到绝热过程的数学表达式为PV^γ=常数。
在绝热过程中,当气体的体积减小时,压力会增加,但是由于没有热量交换,所以气体的温度也不会发生变化。
这符合绝热条件下的理想气体的关系,即压力和体积不再成反比,而是与体积的幂指数γ有关。
这个指数γ被称为绝热指数,对于单原子理想气体,γ=5/3;对于双原子理想气体,γ=7/5。
在绝热过程中,工作与热量的转化是不平衡的,即所吸收的热量不等于所做的功。
三、等温过程与绝热过程的比较1. 温度变化:等温过程中,气体的温度保持不变;绝热过程中,气体的温度也保持不变。
2. 压力变化:等温过程中,气体的压力和体积成反比;绝热过程中,气体的压力和体积不再成反比,而与体积的幂指数γ有关。
3. 热量交换:等温过程中,热量和功的转化是平衡的;绝热过程中,热量和功的转化是不平衡的。
4. 内能变化:等温过程中,气体的内能不变;绝热过程中,气体的内能发生改变。
气体主要热力过程的基本公式

气体主要热力过程的基本公式1.等容过程(isochoric process)在等容过程中,气体体积保持不变。
根据理想气体状态方程PV=nRT,结合理想气体的内能U=C_vT(其中C_v表示摩尔定容热容量),可以得到气体的内能和温度的关系为U2-U1=C_v(T2-T1)2.等压过程(isobaric process)在等压过程中,气体的压强保持不变。
根据理想气体状态方程PV=nRT,结合理想气体的焓H=U+PV(其中H表示焓),可以得到气体的焓和温度的关系为H2-H1=C_p(T2-T1)其中C_p表示摩尔定压热容量。
3. 绝热过程(adiabatic process)在绝热过程中,气体在没有与外界交换热量的情况下发生压缩、膨胀等过程。
根据绝热条件PV^γ=常数,可以得到气体压强和体积的关系为P2V2^γ=P1V1^γ其中γ=C_p/C_v表示绝热指数。
4.等温过程(isothermal process)在等温过程中,气体的温度保持不变。
根据理想气体状态方程PV=nRT,可以得到气体的压强和体积的关系为P1V1=P2V2综合以上各种过程,可以得到气体的理想热力方程为C_p(T2 - T1) - R(ln(V2/V1)) = 0其中 R 表示气体常数,对于摩尔气体,R = 8.314 J/(mol·K)。
另外,对于理想气体的内能和焓,还可以利用摩尔定热容量和摩尔焓的定义进行计算:U=nC_vTH=nC_pT其中C_v和C_p分别为摩尔定容热容量和摩尔定压热容量,n表示气体的物质量。
需要注意的是,以上公式都是在理想气体的情况下推导得到的,在实际情况下可能需要考虑相对论效应、分子间相互作用等因素。
此外,还有其他一些非常特殊的热力过程,如绝热绝热过程、多孔气体的热力过程等,其公式推导及应用较为复杂,对于一般的热力学应用来说已经足够。
13-4理想气体的等温过程和绝热过程
13
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
后为P 例1,一定量的理想气体 1,V1,T1,后为 2,V2, ,一定量的理想气体P T2, 已知 V2>V1, T2=T1 以下说法哪种正确? 以下说法哪种正确? (A)不论经历什么过程,气体对外净作功一定为正值 )不论经历什么过程, (B)不论经历什么过程,气体对外界净吸热一定为正值 )不论经历什么过程, (C)若是等温过程,气体吸的热量最少 )若是等温过程, (D)若不知什么过程,则A,Q的正负无法判断 )若不知什么过程, , 的正负无法判断 [D]
第十三章 热力学基础
14
物理学
第五版
1313-4 理想气体的等温过程和绝热过程 态到b态 例2,一定量的理想气体从 态到 态,这个过程 ,一定量的理想气体从a态到 是什么过程? 是什么过程?
P
b
a
T
(A)绝热压缩(B)等容吸热 )绝热压缩( ) (C)吸热压缩(D)吸热膨胀 )吸热压缩( )
第十三章 热力学基础
γ
E
0
p1V1 p 2V2 γ 1
νcV T
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
P
T
D
A
B
C
T
图中曲线为等 温线.问A, B,C,D状态 时系统的温度 关系.
V
T
PV = νRT
等压过程中,体积越大温度越高;等体过程 中,压强越大温度越大. 在PV图中,等温线上方温度较高,等温线 下方温度较低.
第十三章 热力学基础
8
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
理想气体的等温过程与绝热过程
理想气体的等温过程与绝热过程理想气体是指在一定温度下,气体分子之间完全没有相互作用的气体模型。
在理想气体的热力学过程中,等温过程和绝热过程是两个重要的概念。
本文将分别介绍理想气体的等温过程和绝热过程,并探讨它们的特点和应用。
一、理想气体的等温过程等温过程是指在气体发生变化的过程中,温度保持不变。
对于理想气体而言,等温过程可以用以下方程来描述:PV = 常数(1)式中,P表示气体的压强,V表示气体的体积。
根据理想气体状态方程,PV = nRT,式中,n表示气体的物质的量,R是气体常数,T是气体的绝对温度。
结合方程(1)和PV = nRT,我们可以得到:nRT = 常数(2)由方程(2)可知,在等温过程中,气体的物质的量n和体积V是成反比的关系。
也就是说,在体积增大的同时,物质的量会减少,反之亦然。
这说明了在等温过程中,气体分子会随着体积的改变而发生数量的变化。
等温过程还有一个重要的特点是气体对外做功。
根据热力学的能量守恒定律,气体所做的功等于外界对气体做的功。
在等温过程中,气体扩大或收缩的功可以通过以下公式计算:W = - nRT * ln(V2/V1) (3)式中,W表示气体所做的功,V1和V2分别表示气体的初始体积和最终体积。
二、理想气体的绝热过程绝热过程是指在气体发生变化的过程中,没有热量的交换。
绝热过程的特点是温度和压强同时变化。
对于理想气体而言,绝热过程可以用以下方程来描述:PV^γ = 常数(4)式中,γ表示气体的绝热指数,对于大多数单原子理想气体而言,γ约等于5/3。
根据理想气体状态方程,PV = nRT,我们可以推导出绝热过程中,温度和压强的关系:T = (Pv^(γ-1))/(nR) (5)式中,Tv表示绝热过程中气体的温度。
由方程(5)可知,在绝热过程中,随着气体体积的减小,气体的温度也会随之降低。
反之,体积的增大会导致温度的升高。
这与等温过程中温度保持不变的特点形成了鲜明的对比。
热力学理想气体的绝热过程
热力学理想气体的绝热过程热力学是研究能量转化和传递规律的学科,而理想气体则是热力学中的重要概念。
理想气体在绝热过程中的行为是热力学中的一个经典问题。
本文将介绍热力学理想气体的绝热过程,并且分析绝热过程对气体性质的影响。
1. 绝热过程的定义绝热过程是指气体在与外界无换热的情况下进行的过程。
在绝热过程中,气体系统不与外界交换热量,但压强和体积可能发生变化。
绝热过程中气体能量的转化只通过气体内部的分子间相互作用来实现。
2. 理想气体的特性理想气体是指在宏观情况下,气体分子之间不具有吸引力和排斥力,分子之间的碰撞是完全弹性的,体积可以忽略不计。
理想气体的状态方程为PV=nRT,其中P为压强,V为体积,n为物质的物质的摩尔数,R为气体常量,T为温度。
3. 理想气体绝热过程的基本方程绝热过程中,理想气体的内能U和体积V的关系可以通过以下公式描述:P1V1^γ = P2V2^γ其中,P1和P2分别为绝热过程前后的压强,V1和V2分别为绝热过程前后的体积,γ为气体的绝热指数。
4. 绝热指数的计算绝热指数γ可以通过以下公式计算:γ = C p/Cv其中,Cp为气体在定压过程中的摩尔定压热容,Cv为气体在定容过程中的摩尔定容热容。
5. 绝热过程对气体性质的影响在绝热过程中,气体的温度、压强和体积之间存在着确定的关系。
当气体发生绝热膨胀(体积增大)时,气体的温度降低,压强下降;当气体发生绝热压缩(体积减小)时,气体的温度升高,压强增加。
6. 绝热过程中的熵变由于绝热过程中没有热量交换,因此熵的变化也受到限制。
绝热膨胀过程中,熵的变化为ΔS = 0,即熵保持不变;而绝热压缩过程中,熵的变化为ΔS = 0,即熵同样保持不变。
7. 绝热过程的实际应用绝热过程在实际中有许多应用,比如内燃机的工作过程和空气压缩机的工作过程等。
绝热过程的特性使得气体在压力和体积的变化下能够进行能量的转化,从而实现机械功的输出。
总结:热力学理想气体的绝热过程是热力学中的一个重要问题。
理想气体的等温过程与绝热过程
理想气体的等温过程与绝热过程理想气体在不同的过程中表现出不同的特性,其中等温过程和绝热过程是两种常见的气体过程。
本文将对理想气体的等温过程和绝热过程进行详细介绍。
一、理想气体的等温过程等温过程是指气体在温度恒定的情况下发生的过程。
在等温过程中,气体内部的分子运动速度仍在改变,但总体来说,分子碰撞所产生的压强和分子间的引力相互抵消,使得气体保持恒定的温度。
这是因为等温过程中热量的加入与放出相等,保持热平衡。
在等温过程中,根据理想气体的状态方程PV=nRT(其中P为气体的压强,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度),可以得到以下关系式:P1V1=P2V2其中P1和V1表示初始状态下的压强和体积,P2和V2表示最终状态下的压强和体积。
从上式可以看出,在等温过程中,气体的压强和体积呈反比关系。
等温过程的特点是气体对外界做功。
由于气体的体积发生改变,气体向外界提供了一定的功。
在等温过程中,由于气体分子的运动速度和分子间的引力相互抵消,气体没有温度差,故不会产生热量的传递。
二、理想气体的绝热过程绝热过程是指气体与外界没有热量交换的过程。
在绝热过程中,气体受到的外界影响只有气体的压强和体积的改变,而没有温度的改变。
绝热过程中气体内部的分子速度会发生改变,但总体来说,分子的动能和势能保持恒定。
绝热过程中,根据理想气体的状态方程PV^γ=常数(其中γ为气体的绝热指数,在单原子分子中为5/3,在双原子分子中为7/5,例如空气中的氮氧化合物),可以推导出以下关系式:P1V1^γ=P2V2^γ其中P1和V1表示初始状态下的压强和体积,P2和V2表示最终状态下的压强和体积。
从上式可以看出,在绝热过程中,气体的压强和体积的幂函数关系。
绝热过程的特点是气体做功和温度变化。
由于没有热量传递,气体对外界做功时从内部获取能量,导致气体的温度下降。
绝热过程的常见应用是气体膨胀和压缩的过程。
综上所述,理想气体的等温过程和绝热过程在气体状态变化和能量交换方面具有不同的特点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
摩尔定体热容 摩尔定体热容: 1mol 理想气体在等体 定体热容 过程中吸收热量 dQV ,使温度升高 dT , 其 摩尔定体热容为 定体热容为: 摩尔定体热容为
CV ,m
d QV = dT
−1 −1
dQV = CV ,mdT
单位 J ⋅ mol ⋅ K
pV = νRT
RT ν dV = −νCV ,m dT V
p2
o
第十三章 热力学基础
22
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
CV ,m dT dV =− 分离变量得 V R T
dV 1 dT ∫ V = −∫ γ − 1 T
绝
V
γ −1
T=
量
−1 热 V γ −1T = 方 pV γ = 程 γ −1 −γ
第十三章 热力学基础
4
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
Q = E2 − E1 + W = ∆E + W
第一定律的符号规定
Q
∆E
内能增加 内能减少
W
系统对外界做功 外界对系统做功
+
系统吸热 系统放热
第十三章 热力学基础
5
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
计算各等值过程的热量、 计算各等值过程的热量、功和内能的 理论基础. 理论基础 (1) )
dE = 0
由热力学第一定律
o
dV
V2 V
dQT = dW = pdV
第十三章 热力学基础
16
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
QT = W =
∫V
V2
1
pdV
RT p =ν V
RT V2 QT = W = ∫ ν dV = ν RT ln V1 V V1
V2
p1 = νRT ln p2
第十三章 热力学基础
30
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
氮气可视为理想气体, 解 氮气可视为理想气体, 其液化过 程为绝热过程. 程为绝热过程
p1 = 50 × 1.01×10 Pa
5
T1 = 300K
p2 = 1.01×10 Pa
5
氮气为双原子气体由表查得 γ = 1.40 p2 (γ −1) / γ T2 = T1 ( ) = 98.0K p1
W
p1V1 − p 2V2 = γ −1
第十三章 热力学基础
21
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
绝热过程方程的推导
∵ dQ = 0 , ∴ dW = − dE
pdV = −ν CV , m dT
p
p1
1( p1 , V1 , T1 )
Q=0
( p2 ,V2 ,T2 ) 2
V1 V2 V
系统从外界吸收的热 系统从外界吸收的热 量,一部分使系统的内能 增加, 增加,另一部分使系统对 外界做功 .
o
V1
V2 V
Q = E2 − E1 + W = ∆E + W
第十三章 热力学基础
3
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
准静态过程
Q = ∆E +
微变过程
∫V
V2
1
pdV
dQ = dE + d W = dE + pdV
四 比热容
dQ 热容 C = d T
比热容
dQ C c= = m′dT m′
第十三章 热力学基础
15
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
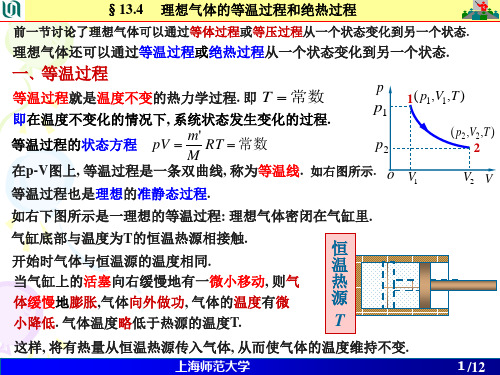
一 等温过程
T = 常量 过程方程 pV = 常量
特征
p p1
1 ( p1 ,V1 , T )
( p2,V2,T )
p2
恒 温 热 源 T
2
V1
QT
E
W
QT
E
W
第十三章 热力学基础
18
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
二
绝热过程
dQ = 0
p
p1
1( p1 ,V1 , T1 )
( p2,V2,T2 )
与外界无热量交换的过程 特征 由热力学 dW + dE = 0 第一定律 dW = −dE
p2
2
V2 V
o V1 dV
dE = νCV ,m dT
pV = νRT (理想气体的共性) 理想气体的共性) 共性
d Q = d E + pd V
解决过程中能
(2) )
Q = ∆E + ∫ pdV 量转换的问题
V1
第十三章 热力学基础
V2
6
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
理想气体的状态函数) (3) E = E (T )(理想气体的状态函数) ) (4) 各等值过程的特性 . )
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
三个量: 三个量:
W = p (V2 − V1 ) = ν R (T2 − T1 )
Q p = νC p,m (T2 − T1 )
E2 − E1 =νCV ,m (T2 − T1)
第十三章 热力学基础
14
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
1313-4 理想气体的等温过程和绝热过程
等温过程曲线的斜率 等温过程曲线的斜率
p
T =常量
Q=0
∆pa∆pT
A C B
pV = 常量
pdV + Vdp = 0
dp pA ( )T = − dV VA
pA
o
V A ∆V V B
V
绝热线的斜率大于等温线的斜率. 绝热线的斜率大于等温线的斜率
第十三章 热力学基础
第十三章 热力学基础
31
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
一汽缸内有一定的水, 例3 一汽缸内有一定的水,缸壁由良导 热材料制成. 热材料制成 作用于活塞上的压强1.013 × 10 5 Pa 摩擦不计. 开始时,活塞与水面接触. 摩擦不计 开始时,活塞与水面接触 若环境 (热源 温度非常缓慢地升高到100 C . 求把单 热源) 热源 位质量的水汽化为水蒸气,内能改变多少? 位质量的水汽化为水蒸气,内能改变多少 已知 汽化热 密度
W12 = −4.70 × 10 4 J
CV ,m = 20.44 J ⋅ mol−1 ⋅ K −1
(3)对等温过程 )
V1 p ′ = p1 ( ) 2 V2 = 1 . 01 × 10
6
p
p2
' p2
Pa
2T 2
2'
对绝热过程, 对绝热过程, 有
V1 γ p2 = p1 ( ) V2 = 2.55 × 10 Pa
d Q p = C p ,m dT = dE + pd V
d E = CV ,m d T
p d V = R dT
可得摩尔定压热容和摩尔定体热容的关系 可得摩尔定压热容和摩尔定体热容的关系 定压热容和摩尔定体
C p,m = CV ,m + R
摩尔热容比
γ = Cp,m CV ,m
第十三章 热力学基础
13
V1 γ −1 T2 = T1 ( ) = 753 K V2
' p2
2T 2
2'
T2' = T1 Q=0
p1
T1
o V =V ' =V 10 V V 2 2 1 1
28
T = 常量
1
第十三章 热力学基础
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
W12 = −νCV ,m (T2 − T1 )
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
状态量) 一 内能 (状态量)
实验证明系统从状态A 变化到状态B, 实验证明系统从状态 变化到状态 , 可以采用做功和传热的方法, 可以采用做功和传热的方法,不管经过 什么过程,只要始末状态确定, 什么过程,只要始末状态确定,做功和 传热之和保持不变. 传热之和保持不变
26
物理学
第五版
1313-4 理想气体的等温过程和绝热过程
的氢气, 例1 设有 5 mol 的氢气,最初温度 20 C , 压强 1.013×105 Pa ,求下列过程中把氢气压缩 需作的功: 为原体积的 1/10 需作的功 (1)等温过程 ) (2)绝热过程 (3)经这两过程后,气体的 ) )经这两过程后, p 2 压强各为多少? 压强各为多少? T T' =T
第十三章 热力学基础
17
物理学
第五版
1313-4 理想气体的等温过程和绝热过程 等温膨胀 等温膨胀 等温压缩 等温压缩
p p1
1 ( p1 , V1 , T )
p p1
2
1 ( p1 , V1 , T )
p2
( p2 ,V2 ,T )
W
V1
p2
( p2 ,V2 ,T )
W
V1
2
o
V2 V
o
V2 V
第十三章 热力学基础
7
物理学
第五版
