等温过程与绝热过程共29页文档
热力学中的等温与绝热过程

热力学中的等温与绝热过程热力学是研究热力学状态、能量传递等问题的学科,其中等温与绝热过程是其中一个非常重要的概念。
一. 热力学基础在探讨等温与绝热过程之前,我们需要先了解一些热力学的基础。
热力学第一定律是关于热的能量守恒的定律。
根据此定律,能量不可能从一个系统中消失,也不可能从外界出现,只能从系统一部分转移到另一部分。
热力学第二定律是关于热力学活动的方向性的定律。
热力学第三定律则是规定了绝对零度是不能达到的这一事实。
二. 等温过程等温过程是在一定的温度下进行的。
在等温过程中,系统的温度保持不变,但是其它一些参数可能会发生变化。
通过等温过程,功可以将热转化为机械能。
换言之,等温过程意味着系统内的能量是平衡的。
一个常见的等温过程是吸热冷却,这是日常生活中非常常见的过程。
三. 绝热过程绝热过程则是在没有任何热交换的情况下进行的过程。
绝热过程中,系统内的热量完全转化为机械能,系统的温度会发生变化。
绝热过程是不可逆的,也就是说,系统内的能量不可能再被转化为热能。
绝热过程中更常见的是压缩和膨胀。
四. 等温和绝热过程的区别在等温过程中,系统内部的温度保持不变,而在绝热过程中,系统内部的温度会发生变化。
等温过程只能用于转换热能,而绝热过程则可以用来转换机械能。
此外,在等温过程中热会从热源传递到冷源,因此等温过程是可逆的。
而在绝热过程中,系统内的能量发生变化,因此这是不可逆的。
五. 结论热力学中的等温与绝热过程是非常重要的概念,尤其是在热机理论中。
等温过程和绝热过程的区别在于温度是否保持不变、能量转化的方向性以及是否可逆。
在日常生活中,我们也可以很容易地观察到等温和绝热过程的一些例子。
了解这些基础的概念有助于我们更好地理解热力学的一些原理。
等温过程和绝热过程

由热力学第一定律 Q E W 0 放热
3.绝热膨胀过程 Q 0
V 0 , W 0
由热力学第一定律
P 1
P1
0 E W
E W 0
T 0
P2 o V1
2 V2 V
4.未知过程与等 温线有两个交点
V 0 , W 0
P 2
等温线
由于1、2点在等 温线上,
变化快于等温过程。
o V1
2 V2 V
例1. 一定量的理想气体从体积 V1 膨胀到 体积 V2 分别经历的过程是:AB 等压过 程; AC 等温过程; AD 绝热过程,其中
吸热最多的过程。
(A)是 A B ; (B)是 A C ; (C)是 A D ; (D)既是 A B 也 是 A C,两过程吸热
T1 T2
T 0 E 0
未知线
o
V2
1 V1 V
由热力学第一定律 Q W 0 放热
例4.温度为 25C、压强为 1 atm 的 1 mol 刚性双原 子分子理想气体,经等温过程体积膨胀至原来的3倍. (1)计算这个过程中气体对外的功. (2)假设气体经绝热过程体积膨胀至原来的3倍,那么气 体对外做的功又是多少? 摩尔气体常数
m' M CPT
m' RT ln V2
M
V1
m' RT ln P1
M
P2
0
摩尔热容
CV
CP
单 双多 3 R 5 R 3R 22 5 R 7 R 4R 22
CT
Ca 0
摩尔热容比
i2
i
5 3
74 53
作业 《大学物理习题精选》P. 36
热力学理想气体的等温过程与绝热过程

热力学理想气体的等温过程与绝热过程热力学是研究物质能量转换和物质性质变化的学科,而热力学理想气体的等温过程与绝热过程是热力学中的两个重要概念。
本文将详细探讨热力学理想气体在等温过程和绝热过程中发生的变化和特性。
一、等温过程等温过程是指气体在恒温条件下发生的过程。
在等温过程中,气体的温度保持不变,但是其他物理量如压强、体积等会发生变化。
热力学理想气体在等温过程中的特点如下:1. 等温膨胀:当气体受热膨胀时,其体积增大,但是温度保持不变。
根据理想气体状态方程PV=RT,可以得到等温膨胀的关系式为P1V1=P2V2,其中P1和V1分别为初始状态下的压强和体积,P2和V2为终态下的压强和体积。
2. 等温压缩:当气体被压缩时,其体积减小,但是温度保持不变。
根据理想气体状态方程PV=RT,可以得到等温压缩的关系式为P1V1=P2V2,其中P1和V1分别为初始状态下的压强和体积,P2和V2为终态下的压强和体积。
3. 等温过程中的能量转化:根据热力学第一定律,等温过程中的能量转化可以表示为Q=W,即等温过程中所吸收的热量等于所做的功。
这是因为在等温过程中,气体通过与外界交换热量来保持温度不变,而这部分热量又可以转化为对外界所做的功。
二、绝热过程绝热过程是指气体在不与外界交换热量的条件下发生的过程。
在绝热过程中,气体的内能发生变化,从而引起其他物理量的变化。
热力学理想气体在绝热过程中的特点如下:1. 绝热膨胀:当气体在没有热量交换的情况下膨胀时,其体积增大,压强减小。
根据理想气体状态方程PV=RT,可以得到绝热膨胀的关系式为P1V1^γ=P2V2^γ,其中γ为气体的绝热指数,取决于气体的性质。
2. 绝热压缩:当气体在没有热量交换的情况下被压缩时,其体积减小,压强增大。
根据理想气体状态方程PV=RT,可以得到绝热压缩的关系式为P1V1^γ=P2V2^γ,其中γ为气体的绝热指数,取决于气体的性质。
3. 绝热过程中的能量转化:在绝热过程中,没有热量交换发生,因此热力学第一定律可以表示为Q=0=W,即绝热过程中没有热量的吸收或放出,所以气体对外界所做的功等于内能的改变。
热学 等温过程和绝热过程分析
p
水蒸气
蒸汽
1
水
)
W pdV pV pm(
E Q W mL pm(
1
蒸汽
1
1
m
)
)
水
水
1
100热源
蒸汽
水
E 1 1 L p( ) 2.09 106 J kg 1 m 蒸汽 水
蒸汽 0.598kg m
3
解 水汽化所需的热量 Q mL
水汽化后体积膨胀为
水蒸气
m
水
V m(
1
蒸汽
1
水
)
100热源
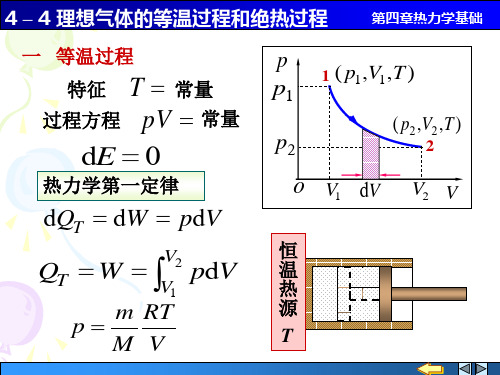
4 – 4 理想气体的等温过程和绝热过程
第四章热力学基础
L 2.26 10 J kg
6
1
水 1040kg m
3
3
蒸汽 0.598kg m
Q0
( p2 ,V2 , T2 ) 2
p2
o
绝 热 方 程
V1
1
V2 V
V T 常量 pV 常量
p T
1
常量
4 – 4 理想气体的等温过程和绝热过程 绝热膨胀
第四章热力学基础
绝热压缩
p
p1
1( p1,V1, T1 )
p
p2
2( p2 ,V2 ,T2 )
p2
W
( p2 ,V2 ,T2 ) 2
1( p1,V1, T1 )
p2
W
( p2 ,V2 , T2 ) 2
o V1
V2 V
p1V1 p2V2 m ) 从 pV RT 可得 W CV ,m ( R R M CV ,m p1V1 p2V2 W ( p1V1 p2V2 ) W 1 C P ,m CV ,m
理想气体的等温与绝热过程

理想气体的等温与绝热过程理想气体是物理学中一个重要的理想化模型,它假设气体的分子之间没有相互作用,体积可以忽略不计。
在实际的等温与绝热过程中,理想气体表现出了不同的特性和行为。
本文将深入探讨理想气体在等温与绝热过程中的特点和数学表达方式。
等温过程是指气体在恒定温度条件下发生的过程。
在等温过程中,理想气体的温度保持不变,因此根据理想气体状态方程PV=nRT,压强和体积成反比。
也就是说,当体积增大时,压强会相应减小,反之亦然。
这种关系可以用数学表达式PV=常数来表示,其中常数等于nRT。
绝热过程是指气体在没有热量交换的情况下发生的过程。
在绝热过程中,理想气体的内部能量保持不变,因此根据理想气体状态方程PV=nRT,压强和体积的乘积保持不变。
也就是说,当体积减小时,压强会相应增大,反之亦然。
这种关系可以用数学表达式P₁V₁^γ=P₂V₂^γ来表示,其中γ是气体的绝热指数,对于大多数单原子气体而言,γ≈5/3。
在等温过程中,理想气体的温度保持恒定,因此内能的增加和对外做功相互抵消。
根据气体内能的公式(因为内能只与温度有关),ΔU=nCvΔT,其中ΔU表示内能的变化,n表示物质的摩尔数,Cv表示摩尔定容热容,ΔT表示温度变化。
由于等温过程中温度不变,因此ΔT=0,所以ΔU=0。
这意味着在等温过程中,理想气体的内能保持不变。
在绝热过程中,理想气体没有热量交换,因此热量的增加全都被用于对外做功。
根据绝热过程中的热力学第一定律,Q-W=ΔU,其中Q 表示吸收的热量,W表示对外做的功,ΔU表示内能的变化。
由于绝热过程中没有热量交换,因此Q=0,所以W=ΔU。
这意味着在绝热过程中,理想气体的内能变化全部用于对外做功。
绝热过程和等温过程的比较可以看出,等温过程中理想气体对外做的功为零,内能的变化为零;而绝热过程中理想气体对外做的功不为零,内能的变化全部用于对外做功。
这两个过程都是理想气体在不同条件下的特性,对于理论研究和实际应用都有着重要的意义。
大学物理第 13 章 第 2 次课 -- 理想气体的等温过程和绝热过程..
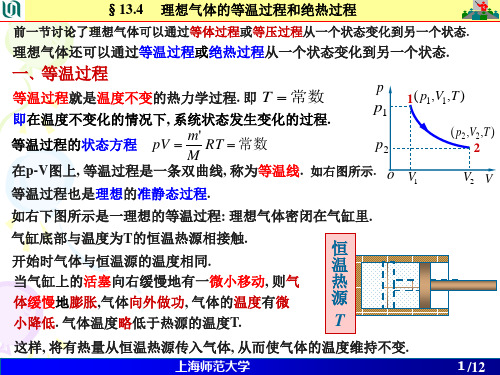
p1
2'
T C
V2 V2' V1 10
T1 1
V1 V
负号表示外界对气体做功. 2)绝热过程做的功
o
氢气为双原子气体, 表查13-1得 =1.41, CV,m= 20.44 J· mol-1· K-1 . 由绝热过程方程 由此可得,
TV
1
常数c'
得
T1V1
1
T2V2
1
上海师范大学
3 /12
§13.4
理想气体的等温过程和绝热过程
二、绝热过程
绝热过程: 理想气体状态发生变化的过程中, 气体与外界没有热量传递. 绝热过程是一种理想过程, 实际的过程不可能是真正的绝热过程. 但在状态的变化过程中, 如果系统与外界的热传递很小, 以致可以忽略, 则这
种过程可以近似地视为绝热过程. 如汽车发动机气缸中气体的膨胀就可以近 p ( p1 ,V1 , T1 ) 似地看成是绝热过程.
6 /12
上海师范大学
将
Cp,m R CV ,m , C p,m / CV ,m 代入上式, 简得
C p ,m dV dp CV, m V p
§13.4 理想气体的等温过程和绝热过程 (CV ,m R) dV dp CV, m V p
dV dp 0 V p
上海师范大学
(14)
5 /12
§13.4 2. 绝热过程的物态方程 理想气体的物态方程:
理想气体的等温过程和绝热过程
pV RT
V R 常数 等压过程: T p
p R 常数 等体过程: T V 等温过程: pV 常数
绝热过程中, 状态参量p,V,T都发生变化, 能否写出两个量之间的变化关系? 对理想气体的物态方程
理想气体中的等温过程与绝热过程
理想气体中的等温过程与绝热过程在研究理想气体的性质和行为时,等温过程和绝热过程是两个重要的概念。
它们描述了气体在外界条件改变下的变化规律,是热力学和物理学中的基础概念之一。
本文将详细介绍等温过程和绝热过程的定义、特点和数学表达,以及它们在实际应用中的意义和重要性。
一、等温过程等温过程是指在气体与外界保持恒定温度的条件下,体积和压力发生变化的过程。
根据理想气体状态方程PV=nRT,当温度保持不变时,压力和体积成反比关系。
也就是说,当压力增加时,体积减小;压力减小时,体积增加,以保持气体的温度不变。
以一定量的理想气体为例,假设其体积从V₁变化到V₂,对应的压力由P₁变化到P₂。
根据等温过程的特点,我们可以得到以下数学表达式:P₁V₁ = P₂V₂这个表达式被称为爱德华·博伯定律,也是描述等温过程中气体性质的重要公式之一。
从公式中可以看出,当气体的温度不变时,压力和体积之间存在一个不变的乘积关系。
等温过程在实际应用中有着重要的意义。
在工程领域中,等温过程常常用于设计和优化热机、制冷设备等。
在化学实验中,等温过程也是调整反应条件和控制反应速率的基础。
二、绝热过程绝热过程是指在理想气体与外界没有热量交换的条件下,体积和温度发生变化的过程。
在绝热过程中,气体与外界之间没有能量的转移,因此其内能保持不变。
根据内能守恒定律,绝热过程中气体的温度变化与体积变化呈反比关系。
同样以一定量的理想气体为例,假设其体积从V₁变化到V₂,对应的温度由T₁变化到T₂。
根据绝热过程的特点,我们可以得到以下数学表达式:T₁V₁^(γ-1) = T₂V₂^(γ-1)其中,γ为气体的绝热指数,表示气体热容比。
对于单原子分子气体,γ约等于5/3;对于双原子分子气体,γ约等于7/5。
从上述公式中可以看出,当气体的体积增加时,温度会降低,反之亦然。
绝热过程的应用也非常广泛。
例如,在内燃机中,汽缸中的气体在燃烧过程中发生绝热膨胀,从而驱动活塞运动,产生功。
等温过程与绝热过程的理论分析
等温过程与绝热过程的理论分析等温过程和绝热过程是热力学中的两个重要概念,它们在理论分析中具有特殊的意义。
本文将对等温过程和绝热过程的理论进行分析,探讨它们在热力学中的应用和特点。
一、等温过程的理论分析等温过程是指系统在受热的同时温度保持不变的过程。
在等温过程中,系统与外界之间的热交换会导致系统内部的能量发生变化,但温度始终保持恒定。
根据热力学第一定律,等温过程中系统所吸收的热量与系统所做的功相等。
等温过程可以用理想气体的等温膨胀和等温压缩来进行分析。
以理想气体的等温膨胀为例,根据理想气体状态方程PV=nRT,气体体积的增加导致气体压强的减小。
而根据热力学第一定律,系统吸收的热量等于所做的功,即nRTln(V2/V1)。
可以看出,在等温过程中,系统吸收的热量与体积的自然对数成正比。
二、绝热过程的理论分析绝热过程是指系统与外界之间完全隔绝,没有任何热交换的过程。
在绝热过程中,系统内部的能量只能通过做功的方式进行改变。
绝热过程可以用理想气体的绝热膨胀和绝热压缩来进行分析。
以理想气体的绝热膨胀为例,根据理想气体状态方程PV^n=常数,气体体积的增加导致气体压强的减小。
在绝热过程中,由于没有热交换,系统吸收的热量为零,即Q=0。
根据热力学第一定律,系统所做的功等于内能的减少,即nCv(T2-T1)。
可以看出,在绝热过程中,系统所做的功与温度差成正比。
三、等温过程与绝热过程的区别与应用1. 区别:等温过程和绝热过程在物理特性和过程条件上存在明显的区别。
等温过程中,温度保持恒定,系统与外界进行热交换;而绝热过程中,系统与外界完全隔绝,没有热交换。
另外,等温过程中熵的变化为零,而绝热过程中熵的变化不为零。
2. 应用:等温过程和绝热过程在热力学中具有广泛的应用。
等温过程常用于理想气体的等温膨胀和等温压缩的分析,以及化学反应中的恒温条件。
而绝热过程常用于理想气体的绝热膨胀和绝热压缩的分析,以及热工学中的绝热变换。
同时,等温过程和绝热过程也存在一定的相互关系。
理想气体的等温过程与绝热过程
理想气体的等温过程与绝热过程理想气体是指在一定温度下,气体分子之间完全没有相互作用的气体模型。
在理想气体的热力学过程中,等温过程和绝热过程是两个重要的概念。
本文将分别介绍理想气体的等温过程和绝热过程,并探讨它们的特点和应用。
一、理想气体的等温过程等温过程是指在气体发生变化的过程中,温度保持不变。
对于理想气体而言,等温过程可以用以下方程来描述:PV = 常数(1)式中,P表示气体的压强,V表示气体的体积。
根据理想气体状态方程,PV = nRT,式中,n表示气体的物质的量,R是气体常数,T是气体的绝对温度。
结合方程(1)和PV = nRT,我们可以得到:nRT = 常数(2)由方程(2)可知,在等温过程中,气体的物质的量n和体积V是成反比的关系。
也就是说,在体积增大的同时,物质的量会减少,反之亦然。
这说明了在等温过程中,气体分子会随着体积的改变而发生数量的变化。
等温过程还有一个重要的特点是气体对外做功。
根据热力学的能量守恒定律,气体所做的功等于外界对气体做的功。
在等温过程中,气体扩大或收缩的功可以通过以下公式计算:W = - nRT * ln(V2/V1) (3)式中,W表示气体所做的功,V1和V2分别表示气体的初始体积和最终体积。
二、理想气体的绝热过程绝热过程是指在气体发生变化的过程中,没有热量的交换。
绝热过程的特点是温度和压强同时变化。
对于理想气体而言,绝热过程可以用以下方程来描述:PV^γ = 常数(4)式中,γ表示气体的绝热指数,对于大多数单原子理想气体而言,γ约等于5/3。
根据理想气体状态方程,PV = nRT,我们可以推导出绝热过程中,温度和压强的关系:T = (Pv^(γ-1))/(nR) (5)式中,Tv表示绝热过程中气体的温度。
由方程(5)可知,在绝热过程中,随着气体体积的减小,气体的温度也会随之降低。
反之,体积的增大会导致温度的升高。
这与等温过程中温度保持不变的特点形成了鲜明的对比。
等温过程和绝热过程
T T
• 例如压缩空气从喷嘴中急速喷出,气体绝热膨胀,温度下降, 甚至液化。
• 再如气缸活塞急速压缩,温度升高,使易燃物燃烧。
单原子分子气体
CP
CV
5 1.67
3
双原子刚性分子气体
7 1.4
5
多原子刚性分子气体
4 1.33
3
第九页
思考题1
当打开一瓶装有香槟、苏打水饮 料或者任何其它碳酸饮料瓶时,在开 瓶瞬间,为什么瓶口的周围会形成一 团白雾,或者看见瓶口突然冒出白烟?
QP E PV
E
m' M
CV
T
等温 dT 0 PV C QT W
0
绝热
dQ 0
PV C1
V 1T C2 Wa E
P 1T C3
第二十七页
E
m' M
CV
T
过程 功W
等容
0
等压 PV
等温 绝热
m' RT ln V2
M
V1
m' RT ln P1
M
P2
m' M
CV
T
P1V1 P2V2
由Q E W ,
知Q
E
m M
CV
(T
2
T
)
1
632 J
第二十三页
(2)定压过程, P 常量
Q
m M
CP
(T
2
T
)
1
1.04 103 J
E 与(1)相同
W Q E 417J
系统对外作功
(3)Q 0,
E 与(1)相同,
W E 623 J. (外界对系统做功)
