电解质溶液的离子强度
溶液中离子的电导率与电解质强度

溶液中离子的电导率与电解质强度在化学中,电解质是指在溶液或熔融状态下能够产生电离的物质。
当电解质溶解在溶剂中时,会形成离子,这些离子在溶液中会导电。
溶液中离子的电导率与电解质的强度有着密切的关系。
1. 电解质强度的定义电解质强度是指一个电解质溶液中离子的产生能力。
一般来说,电解质强度越高,溶液中离子的浓度越高,电导率也会相应增加。
2. 影响电解质强度的因素电解质强度受多种因素的影响,其中包括溶质的浓度、温度和溶剂性质等。
2.1 溶液中离子浓度溶液中离子的电导率与溶液中离子浓度成正比。
当一个电解质溶解在溶剂中时,会发生电离反应,产生正负离子。
如果溶液中离子浓度较高,离子之间的碰撞频率也会增加,导致溶液的电导率增加。
2.2 温度温度对溶液中离子电导率的影响是复杂的。
一般来说,溶液中离子的电导率随温度的升高而增加。
这是因为在较高温度下,溶剂的运动速度加快,离子之间的碰撞频率增加,电导率增加。
同时,在较高温度下离子的电动迁移率也会增加,促进了电导率的提高。
2.3 溶剂性质不同溶剂对电解质的溶解性和电导率有着显著的影响。
一般来说,极性溶剂如水能够更好地溶解离子,从而提高溶液的电导率。
而非极性溶剂如石油醚对电解质的溶解性较差,导致溶液的电导率较低。
3. 离子的电导率离子的电导率取决于离子的电荷量、电荷密度和电动迁移率等因素。
一般来说,电荷量越大的离子,其电导率也会更高。
同样,电荷密度越大的离子,其电导率也会更高。
此外,电动迁移率也可以影响离子的电导率,电动迁移率越大,离子在单位时间内移动的距离越远,导电能力越强。
4. 应用溶液中离子的电导率与电解质强度的研究对于许多领域具有重要的应用价值。
例如,在环境监测和水处理中,通过测定水样中离子的电导率,可以了解水质的好坏和污染程度。
此外,在电化学领域,电解质强度与电导率的研究对于电池和燃料电池等能源存储和转换装置的设计和优化具有重要意义。
总结:溶液中离子的电导率与电解质强度密切相关,电解质强度越高,溶液中离子的浓度越高,电导率也会相应增加。
电解质溶液的离子强度-丽水学院

即有2mol的阴离子和2 mol的阳离子互为逆 向通过AA平面和BB平面。 结果 ①中间区,阴、阳离子均是进2mol,出2mol, 所以溶液的浓度不变;
②阴极区, 阳离子进入了 2 mol ,阴离子走 出了2 mol,且反应悼4 mol的阳离子,与原 溶液比,阴、阳离子各少了2 mol;
③阳极区,阳离子走出了2 mol,阴离子走 入了2 mol,并且反应悼4 mol的阴离子,与 原溶液比,阴、阳离子各少了2 mol。
注:阴、阳区物质的量下降;正、负离子所承担的导电 量,正负离子的迁移速率。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
移数(mol)。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
人们把在数值上等于1 mol元电荷的电量 称为Faraday常数。 因一个元电荷电量为一个电子 e的电量, 为: 1.6022×10-19(C), 则1mol电子(元电荷电量) 电量: 6.022×1023(mol-1)×1.6022×10-19(C)
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
结论:当阴、阳离子迁移速率不同时,阴 极区与阳极区离子浓度下降程度不同。 当迁移速率为: r+> r-时, 则C阳↓>C阴↓ 注:↓表示浓度下降程度。 反之,当 r+ < r-时,则C阳↓ < C阴↓ 并且符合如下关系: n阳↓ Q+ r+ ——— = —— = —— n阴↓ Q- r-
4.正、负极与阴、阳极的概念 正极:电势高的极称为正极,电流从正极 流向负极。 负极:电势低的极称为负极,电子从负极 流向正极。 阴极(Cathode): 发生还原作用的极称为阴极。 阳极(Anode) :
发生氧化作用的极称为阳极。
《物理化学教学资料》电化学选择填空练习-2012.5(化学工程专业10级1-6班)

电化学选择、填空题课外补充练习(选自《物理化学例题与习题》)一、填空题1.对离子导体,当温度升高时,导电能力 。
(填增加、减小或不变)2.用同一电导池分别测定浓度为0.01mol · dm -3和0.1 mol · dm -3的1-1型电解质溶液,其电阻分别为1000Ω及600Ω,则它们的摩尔电导率之比 。
3.浓度为b 的AB 电解质水溶液,其平均浓度b ± = ,若电解质为A 2B 型,则平均浓度b ± = ,若电解质为AB 3型,则平均浓度b ± = 。
4.已知298K 时,NH 4Cl ,NaOH ,NaCl 的无限稀释时的摩尔电导率分别为: 1.499× 10∞Λm -2、2.487× 10-2、1.265× 10-2S · m 2· mol -1。
则NH 3· H 2O 的无限稀释时的摩尔电导率( NH ∞Λm 3· H 2O)为 S · m 2· mol -1。
5.当某电解质溶液通过2法拉第电量时,在阴、阳极上各发生 摩尔的化学反应,若阴、阳离子运动速度相同,阴、阳离子分别向阳阴极迁移 法拉第电量。
6.用0.5法拉第的电量,可以从CuSO 4溶液中沉淀出 克Cu 。
7.已知Λm (MgCl 2)=0.02588S ·m 2· mol -1,则Λm (21MgCl 2)= 。
8.已知25℃时,AgNO 3无限稀释的摩尔电导率=A ∞∧m 1、NaCl 无限稀释的电导率=A ∞∧m 2、NaNO 3无限稀释的电导率=A ∞∧m 3,则AgCl 无限稀释的摩尔电导率为 ∞∧m 。
9.有一AB 2水溶液,b =0.002mol · kg -1,γ± =0.83,则a ± = 。
10.温度T 时,浓度均为0.01mol · kg -1的NaCl,CaCl 2,LaCl 3三种电解质水溶液,离子平均活度系数最小的是 。
电解质溶液的离子强度与离子活度的关系研究

电解质溶液的离子强度与离子活度的关系研究电解质溶液是由离子和非离子组成的。
其中,离子强度和离子活度是描述溶液中离子含量和活跃度的两个重要参数。
本文将研究电解质溶液的离子强度与离子活度的关系,并探讨其在化学反应和生物体系中的应用。
一、电解质溶液的离子强度离子强度是衡量电解质溶液中离子数量的度量标准。
在溶液中,电解质溶解后会自动解离为离子,包括阳离子和阴离子。
离子强度可以通过对每种离子的浓度进行加权求和得到,其计算公式为:I = 1/2 ∑(zi2ci)其中,I表示离子强度,zi为离子的电荷数,ci为离子的浓度。
该公式中的加权求和是为了考虑到不同离子的电荷量和浓度对离子强度的贡献。
二、离子活度的定义和计算离子活度是描述溶液中离子活跃度的参数。
离子活度和离子浓度有一定的关系,可以通过离子活度系数来计算。
离子的活度系数(gi)是考虑到溶液中离子相互作用对离子活度的修正因子。
离子活度(ai)可以通过下式计算:ai = gi · ci其中,gi是离子的活度系数,ci是离子的浓度。
离子的活度系数与离子之间的相互作用、离子溶解度以及溶液组成有关,它反映了离子的活动状态。
三、离子强度与离子活度的关系离子强度和离子活度存在一定的关系。
根据表达式:gi = fi · λi可以看出,离子活度系数(gi)与电解质的活度系数(fi)和离子的摩尔电导率(λi)有关。
其中,电解质的活度系数(fi)是描述电解质溶液中离子活跃度的参数,而离子的摩尔电导率(λi)则与离子的浓度有关。
离子活度系数的计算方法很多,其中比较常用的是黄斯菲尔德方程、戴维斯方程和德拜方程等。
这些方程都是通过考虑离子间相互作用和溶液特性来估算离子活度系数,从而进一步计算离子活度。
离子活度与离子强度之间存在一定的关联。
一般来说,离子强度越高,离子间相互作用越强烈,离子的活度系数越小。
因此,离子强度的增加会降低溶液中离子的活化程度。
四、离子强度和离子活度的应用离子强度和离子活度在化学反应和生物体系中具有重要的应用价值。
物理化学试题
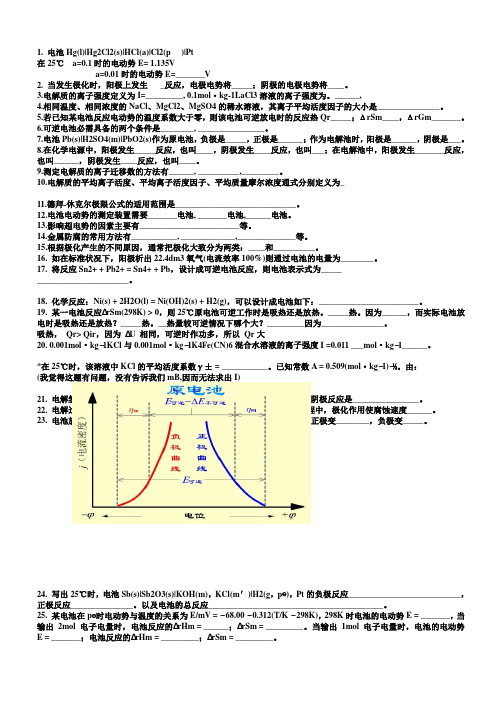
1. 电池Hg(l)|Hg2Cl2(s)|HCl(a)|Cl2(p )|Pt在25℃a=0.1时的电动势E= 1.135Va=0.01时的电动势E=_______V2. 当发生极化时,阳极上发生_反应,电极电势将_____;阴极的电极电势将____。
3.电解质的离子强度定义为I=_________, 0.1mol·kg-1LaCl3溶液的离子强度为。
______,4.相同温度、相同浓度的NaCl、MgCl2、MgSO4的稀水溶液,其离子平均活度因子的大小是_______________。
5.若已知某电池反应电动势的温度系数大于零,则该电池可逆放电时的反应热Qr_____;ΔrSm____,ΔrGm_______。
6.可逆电池必需具备的两个条件是________, ________________。
7.电池Pb(s)|H2SO4(m)|PbO2(s)作为原电池,负极是_____,正极是______;作为电解池时,阳极是______,阴极是___。
8.在化学电源中,阳极发生_____反应,也叫____,阴极发生____反应,也叫___;在电解池中,阳极发生_______反应,也叫______,阴极发生____反应,也叫____。
9.测定电解质的离子迁移数的方法有______, __________,_________。
10.电解质的平均离子活度、平均离子活度因子、平均质量摩尔浓度通式分别定义为_11.德拜-休克尔极限公式的适用范围是_____________________________。
12.电池电动势的测定装置需要_______电池, _______电池,______电池。
13.影响超电势的因素主要有________________________等。
14.金属防腐的常用方法有___________, _____________,______________等。
15.根据极化产生的不同原因,通常把极化大致分为两类:____和__________。
电解质溶液的电导性与离子强度的关系

电解质溶液的电导性与离
子强度的关系
汇报人:XX
目录
01 02 03 04 05
添加目录项标题
电解质溶液的电导率
离子强度对电导率的影响
电导率与离子强度的实际应用 研究电解质溶液电导性与离子强度
的实验方法
01
添加目录项标题
02
电解质溶液的电导率
电导率的定义
电导率是衡量电解质溶液导电能力的物理量 电导率的大小与溶液中离子的浓度和迁移速率有关 电导率的单位是S/m或S•m-1 电导率是电解质溶液的重要性质之一,在化工、电子、电力等领域有广泛应用
来研究
离子强度与电解质溶液性质的关系
离子强度是电解质溶液中离子浓度的量度,对电导率产生影响。 随着离子强度的增加,离子的迁移速率减小,导致电导率下降。 在低离子强度范围内,电导率随离子强度的增加而增加,这是由于离子的协同效应所致。 离子强度对电解质溶液的性质产生多种影响,如渗透压、粘度、密度等。
04
实验注意事项与误差分析
实验前需检查仪器是否正常,确保实验结果的准确性。 实验过程中要保持恒温,避免温度变化对实验结果产生影响。 实验操作要规范,避免因操作不当导致误差。 对实验数据进行处理时,应采用合适的统计方法,以减小误差对结果的影响。
感谢观看
汇报人:XX
05
研究电解质溶液电导性与离子强度的实验 方法
实验原理
电解质溶液的电 导率与离子强度 有关,离子强度 越高,电导率越 大。
通过测量不同离 子强度的电解质 溶液的电导率, 可以研究电导率 与离子强度的关 系。
实验中需要使用 电导率计来测量 溶液的电导率。
实验结果可以用 来解释电解质溶 液中离子的迁移 行为和离子间的 相互作用。
电解质溶液的离子强度效应

电解质溶液的离子强度效应电解质溶液是由电解质溶解在水或其他溶剂中得到的。
其中,电解质是指在溶液中可以分离出离子的物质,例如酸、碱、盐等。
而电解质溶液的离子强度效应则是指当溶液中离子的浓度改变时,对该溶液物理和化学性质造成的影响。
本文将探讨电解质溶液的离子强度效应,以及这种效应对实际应用的重要意义。
1. 离子强度的定义和影响离子强度是指在溶液中离子的浓度与电荷绝对值之积的总和。
离子强度的大小决定了电解质溶液的物理和化学性质,离子强度越高,溶液的电导率越大,溶解度变化也更加明显。
在化学反应中,离子强度对反应速率、反应平衡和化学反应的特异性等方面也有着重要的影响。
离子强度的影响不仅体现在电解质溶液的溶解度上,还体现在电解质与其他溶质相互作用的过程中。
电解质的离子强度越高,会大大影响电解质与其他亚稳态物质的化学平衡,同时影响化学反应速率。
以生物化学中的蛋白质溶液为例,酶活性即可受离子强度影响而发生改变。
2. 离子强度对不同离子种类的影响溶液中离子的种类可以分为阳离子、阴离子和复合离子等。
在不同的离子种类中,离子强度对于这些离子的影响也是不同的。
在一些化学反应中,如果一个离子种类的浓度很低,而另一个离子种类的浓度很高,则离子强度对这个离子种类的影响会更明显。
比如说,在盐酸溶液中,由于氯离子的浓度很高,而汞离子的浓度很低,所以离子强度对氯离子的影响会更大。
而在氢氧化钠溶液中,由于钠离子和氢离子浓度一样,离子强度对这些离子种类的影响也是相同的。
3. 离子强度效应的应用离子强度效应在科学研究和实际应用中有着广泛的应用。
在生物方面,离子强度的调节在细胞内的新陈代谢和生化反应中扮演着重要的角色。
在环境科学中,离子强度可以用来衡量大气和水体污染的程度以及对生态系统的影响程度。
在化学反应中,离子强度效应可以用来预测反应速率并估计反应平衡常数,从而优化反应条件。
同时,离子强度效应还可以作为化学反应和工程过程中调控催化剂活性的一种方式。
电解质溶液的离子强度与电导率的关系研究

电解质溶液的离子强度与电导率的关系研究电解质溶液的离子强度与电导率密切相关,其研究对于理解溶液中离子的运动规律以及溶液的电导性质具有重要意义。
本文将探讨电解质溶液中离子强度与电导率之间的关系,并通过实验结果验证这一关系。
1. 引言电解质溶液是指在溶液中完全或部分被电离的化合物,其中的阴离子和阳离子具有电荷,能够导电。
离子强度是描述溶液中离子的浓度和电荷情况的物理量,用以衡量离子在溶液中的活动能力。
而电导率则是衡量溶液导电性的指标,它描述了溶液中电流通过的能力。
2. 理论基础电解质溶液中的离子在电场作用下运动,导致溶液中的电流。
离子强度与电导率之间的关系可以通过以下公式表示:电导率 = 离子迁移率 ×离子浓度 ×离子电荷其中离子迁移率是离子在单位电场下的移动速率,离子浓度是溶液中离子的总浓度,离子电荷是离子的电荷量。
3. 实验设计与结果为了验证离子强度与电导率之间的关系,我们进行了一系列实验。
首先,我们准备了一组电解质溶液样品,分别是A、B、C和D。
我们根据溶液中离子的浓度调整了每个样品中的离子浓度。
然后,我们测量了每个溶液的电导率,并得到了如下实验数据:样品A:离子浓度为1 mol/L,电导率为10 S/cm样品B:离子浓度为0.5 mol/L,电导率为5 S/cm样品C:离子浓度为0.2 mol/L,电导率为2 S/cm样品D:离子浓度为0.1 mol/L,电导率为1 S/cm从实验数据可以看出,离子浓度越高,电导率也越高。
这与我们的理论基础相吻合。
4. 结果分析通过实验结果,我们可以得出结论:电解质溶液的离子强度与电导率呈正相关关系。
当离子浓度增加时,溶液中离子数量增多,电流通过能力增强,导致电导率提高。
因此,离子强度越高,电导率也越高。
需要注意的是,除了离子浓度之外,离子迁移率和离子电荷也会对电导率产生影响。
离子迁移率越大,离子的运动速率越快,电导率也会增加。
而离子电荷越大,电导率也会增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
例题:已知 I=0.025A,电解液为Au(NO3)3, 当阴极析出1.20g的Au(s)时,求通过的电 量?通电的时间?阳极上放出多少O2气(换 算成标准状况下体积)? 分析:电极反应:1/3Au3++e-→1/3Au(阴极)
1/2H2O-e-→1/4O2+H+ (阳极)
3.电解池外电源消耗的电功: W=QV (电量乘电压,环境对系统作功为正) 电解过程,系统 ΔGT , p 是大于零的,所以 是非自发过程。
原电池是系统对环境作电功,为:
W= Q E
(电ቤተ መጻሕፍቲ ባይዱ乘电动势,电动势单位是电压单位)
放电过程系统 ΔGT , p 是小于零的,所以是 自发过程。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
升高,电阻也升高; D. 导电总量全部由电
子承担。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
第二类导体又称离子导体,如电解质溶 液、熔融电解质等。 特点:
A. 正、负离子作反向移动而导电;
B. 导电过程中有化学反应发生;
C. 温度升高,电阻下降;
D. 导电总量分别由正、负离子分担;
移数(mol)。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
人们把在数值上等于1 mol元电荷的电量 称为Faraday常数。 因一个元电荷电量为一个电子 e的电量, 为: 1.6022×10-19(C), 则1mol电子(元电荷电量) 电量: 6.022×1023(mol-1)×1.6022×10-19(C)
按电流的流向来分,电流总是从电势高的 正极流向电势低的负极。另外电子的流向 与电流的流向是相反的。
阴、阳极的区分:无论是电解池还是原 电池 都可根据电极上发生的反应来区分: 发生氧化反应的电极称为阳极,发生还原 反应的电极称为阴极。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
原电池与电解池电极对比
阴极(Cathode) :发生还原作用(得电子)的极。 在原电池中,阴极是正极; 在电解池中,阴极是负极。 阳极(Anode) :发生氧化作用(失电子)的极。
在原电池中,阳极是负极; 在电解池中,阳极是正极。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
电解池中电极作
用与离子的流向
阳离子迁向阴极,在阴
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
第八章 电解质溶液
(电化学部分) §1 电化学的基本概念和法拉弟定律 §2 离子的电迁移和离子迁移数
§3 电解质溶液的电导
§4 强电解质溶液理论简介
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
电化学研究的主要内容: (1)电解质溶液理论。包括离子的互吸、离 子的水合、离子的缔合、电导理论、电离 平衡等。 (2)电化学平衡。包括可逆电池、电极电势、 电动势以及可逆电池的电动势与热力学函 数之间的关系。
根据Q=I t 电流强度(C· s-1)×时间(s)
和 Q = n F = (m/M) F
即: I t = (m/M) F
(∵m = n M)
计算略
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
法拉第定律的正确性是已被实验所证实 了的。 因此我们可以 通过 电解过程中 电极上析 出或溶解的物质的量 来 精确推算 所 通过的 电量。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
第二种情况 见P8下图 当正、负离子的迁移速率不相同。 如正离 子的迁移速率是负离子迁移速率的 三倍 。 则导电任务阳离子是阴离子的三倍。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
结果
① 中间区: 阴离子进 1mol ,出 1mol 、阳离 子是进 3mol,出3mol,∴溶液的浓度不变; ②阴极区:阳离子进3 mol,阴离子出1 mol, 并且反应悼4 mol的阳离子,与原溶液比, 阴、阳离子各少了1 mol; ③阳极区:阳离子出了3 mol,阴离子进了 1 mol,并且反应悼4 mol的阴离子,同样 与原溶液比,阴、阳离子各少了3 mol。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
如图所示:
平面AA 和 BB将电解池分成三部分, 阳极区、阴极区、中间区。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
假定在未通电前,各区的一价阴、阳离子 的物质的量各为5mol。 通过4mol电子(4F)的电量后,
在阳极上有4 mol的阴离子发生氧化反应;
极上发生还原作用
-
电源 +
阴 极
e
-
+
阳 极
e-
Cation Cathode
阳离子 阴极
阴离子迁向阳极,在 阳极上发生氧化作用
电解质溶液
电解池
Anion Anode
阴离子 阳极
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
电解反应实例
阳极上发生氧化作用
-
电源 +
阴 极
e
-
+
阳 极
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
或一定的电量,实际得到的产品质量与 理论上应得产品的质量之比。 数学表达式为: 实际产品质量 电流效率= ————————×100% 理论产品的质量
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
§2 离子的电迁移和离子迁移数 一、离子的电迁移现象 通电于电解质溶液后,溶液中承担导电 任务的是溶液中的阴、阳离子。 阴离子向阳极移动,并在阳极上发生氧 化反应; 阳离子向阴极移动,并在阴极上发生还 原反应。 其结果是二极附近的溶液浓度将发生变 化。
e-
2Cl aq Cl2 (g) 2e
阴极上发生还原作用
CuCl2
电解池
Cu
2
aq 2e
Cu(s)
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
在原电池中电极作
用与离子的流向
负 极 负载电阻
阳离子迁向阴极
在阴极上发生还原
Zn
e-
正 极
Cu
e
-
Cu2 aq 2e Cu(s)
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
2.电解质溶液的连续导电过程必须在电 化学装置中才能实现。伴有电化学反应和 电能与化学能相互转换过程。如图 电解池
电能
原电池
化学能
在电极与溶液界面处发生了氧化(失电
子)或还原(得电子)。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
(3)电极过程。主要从动力学的角度阐明电 极上所发生反应的细节。 (4)实用电化学。介绍电化学的应用。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
电化学 ⒈电解 精炼和冶炼有色和稀有金属 的用途 电解制备各种化工原料、金属复 合材料和表面特种材料。 电镀法保护和精饰金属 阳极钝化和氧化着色等 ⒉ 电池:汽车、宇宙飞船、照明、 通讯、生化和医学等方面都要用不 同类型的化学电源。
4.正、负极与阴、阳极的概念 正极:电势高的极称为正极,电流从正极 流向负极。 负极:电势低的极称为负极,电子从负极 流向正极。 阴极(Cathode): 发生还原作用的极称为阴极。 阳极(Anode) :
发生氧化作用的极称为阳极。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
[ 电极区分原则 ]按电势的高低来分: 无 论是电解池还是原电池,总是将电势低的 称为负极;将电势高的称为正极。
测量电量所用的装置就是建立在法拉第 定律基础上的。常用的有铜电量计、银电 量计和气体电量计。
另外法拉第定律在任何温度和压力下均 可适用,没有使用条件的限制。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
三、电流效率 实际电解时,电极上常常发生副反应。 所以当一定的电流通过电解质溶液时,一 部分电量用于得到产品,一部分电量用在 得到副产品上,因此如果有副反应时,要 得到 一定数量的产品,实际所消耗的电量 要比 按 法拉第定律计算所需的电量 (可称 理论电量) 要多 ,我们定义二者之比为 电 流效率。数学表达式为: 理论电量 电流效率 = —————— ×100% 实际电量
同时在阴极上有4 mol的阳离子发生还原反 应。
其变化规律可分二种情况讨论:
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
第一种情况:见P8上图 当正、负离子的迁移速率相等,则导电任 务由阴、阳离子各承担一半。 即4 mol的电量由阴、阳离子各承担一半。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
前者对应于ξ=1,后者对应ξ= nM 。 则电子转移数为: nM ×z+ mol z+ 为出现在电极反应中的 电子计量数 。也 为金属离子所带的电荷数。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
如果通过电解质溶液的电量为Q时,则沉 积或溶解金属的物质的量nM为: nM =Q/ zF 或 Q = nM z F (此处 z 为离子所带电荷数) 换算为沉积金属的质量为: m =(Q/ zF)M (M为金属的摩尔质量) 注:如果以元电荷所荷电量的电解质为基 本单元。则1molH+、1/2Cu2+、1/2SO42-等 所带的电量与1(mol)电子所带的电量相 当。
