2018届中考化学专题复习课件:中和反应 (共13张PPT)
合集下载
2018届中考化学专题复习课件:第17讲 中和反应、溶液的pH (共78张PPT)

【例3】(2017·兰州)某校化学兴趣小组在学完碱的化学性质后 ,做了
澄清石灰水和稀盐酸反应的实验,并将废液倒入一洁净的废液缸中,进
行了如下探究。
探究Ⅰ:甲同学在做该实验时没有观察到明显现象 ,于是对澄清石灰
水和稀盐酸能否发生反应表示怀疑。乙同学认为,甲同学实验时应先向 澄清石灰水中滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到溶液的 红色逐渐褪去时,就可以说明两种物质能发生反应。 探究Ⅱ:废液中溶质的成分是什么?
【作出猜想】猜想一:CaCl2 猜想二:CaCl2、 HCl
猜想三:CaCl2、HCl、Ca(OH)2
你的猜想:CaCl2、Ca(OH)2
丙 同 学 认 为 猜 想 三 是 错 误 的 , 理 由 是 Ca(OH)2 + 2HCl===CaCl2 +
定义: 酸 和 碱 作用生成 盐 和 水
+ -
的
2
【知识拓展】
1.判断中和反应的方法
中和反应属于复分解反应中的一种 ,判断一个反应是中和反应 ,既要 满足反应物必须是酸和碱,又要满足生成物必须是盐和水。 2.(1)中和反应与复分解反应的关系:
(2)中和反应同氧化反应、还原反应一样是特征反应,属于四大基本反
改良酸性土壤要用Ca(OH)2、胃酸过多的病人应吃含碱性的食物。
酸碱中和反应(高频考点)
1.实验操作:在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞
溶液,用玻璃棒搅拌,然后用胶头滴管慢慢滴加稀盐酸,并不停搅拌溶 液,至溶液恰好变为无色为止。
逐渐变浅 ,最后变 2.实验现象:滴加盐酸的过程中,溶液的颜色____________ 无色 。 成__________ 3.实验分析:氢氧化钠能使酚酞__________ 变红 ,盐酸不能使酚酞变红色, 逐渐变浅 滴加稀盐酸的过程中溶液颜色 _____________, 最后变成_________,说 无色 明氢氧化钠被滴入的盐酸中和了。 4.实验结论:氢氧化钠能与盐酸反应,反应的化学方程式为 NaOH+HCl===NaCl+H2O ____________________________________ 。
人教版九年级化学课件: 10.2酸和碱的中和反应 (共14张PPT)
谈谈本节课的收获。
作用与用途: 具有制酸、收敛与促进
溃疡愈合的作用。适用于胃溃疡、十二 指肠溃疡、急慢性胃炎、胃酸过多、胃 痉挛所致的胃痛。
3HCl+Al(OH)3====AlCl3+3H2O
二、中和反应在实际中的运用
3.农业上:改良土壤的酸碱性
二、中和反应在实际中的运用
4.工业上: 处理工厂的废水
处理硫酸厂生产中形成的含硫酸的污水。
课堂练习
2、下列反应,要借助酸碱指示剂,才能判断二者发生
反应的是( B )
A、大理石和稀盐酸
B、石灰水和稀盐酸
C、铁锈与稀盐酸
D、镁和稀硫酸
3、下列物质中,属于盐类的是(
A、Fe(OH)2 C、Na2CO3
B、Al2O3 D、H2SO4
C)
二、中和反应的运用
1.在实际生活中的运用
利用熟石灰加工的皮蛋
被蚊虫叮咬后,叮咬处很快会肿成大包, 这是因为蚊虫能在人的皮肤内分泌出蚁酸,从 而使皮肤肿痛。如果涂一些含有碱性肥皂可减 轻痛痒。
化学与生活
吃碱面时,放点醋,味道会更鲜美。
化学与生活
利用熟石灰加工 的皮蛋
二、中和反应在实际中的应用
2.医学上:中和胃酸,制成含碱性药水。
说明书 成份:氢氧化铝、碘甲基蛋氨酸、颠茄。
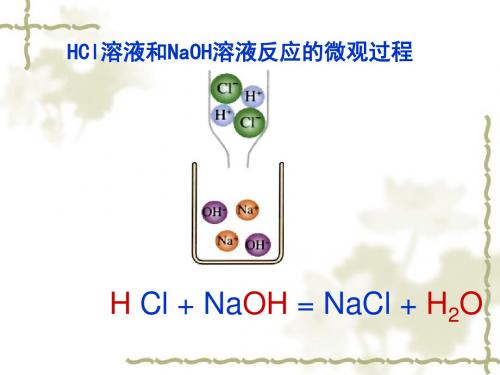
HCl溶液和NaOH溶液反应的微观过程
H Cl + NaOH = NaCl + H2O
HCl + NaOH == NaCl + H2O 2HCl + Ca(OH)2 == CaCl2 + 2H2O H2SO4 + 2NaOH == Na2SO4 + 2H2O H2SO4 + Ca(OH)2== CaSO4 + 2H2O
中和反应ppt课件

溶液颜色的变化过程为
Ba(OH)2+2HNO3
由红色变为无色
;反应的化学方程式为
Ba(NO3)2+2H2O ;反应过程中溶液的pH 变小 (填
“变大”“变小”或“不变”)。
8. 取稀盐酸与氢氧化钠反应后的溶液进行实验,下列能说明两者恰好完全
反应的是
( C )
A. 加Fe(OH)3生成黄色溶液
B. 加入镁粉,无气体生成
再进行过滤,将剩余的Cu(OH)2滤去,选项D所用方法能除去杂质且没有引
入新的杂质,符合除杂原则,选项D所用方法可行。因此,本题应选D。
5. 中和反应在生产、生活中有广泛的应用。
(1) 向盛有一定量稀盐酸的密闭隔热容器中,加入氢氧化钠
固体,利用数字传感器测出反应时间与溶液温度变化的图像
如图所示。
第5题
化钠溶液的反应后,分别结合自己在实验室中所做的实验,从不同方面对其
进行图像描述。图A是实际操作图,图B是反应过程中溶液的酸碱度变化
图,图C是微观粒子结合过程的示意图。请回答下列问题:
(1) 依据图A、图B可知,该实验是将 硫酸溶液 滴加到另一种溶液中。
(2) 图B中b点溶液中的溶质是 NaOH、Na2SO4 。
① 甲同学得出结论:稀盐酸和氢氧化钠反应过程中放热。乙同学不同意他
的观点,乙同学的理由是 氢氧化钠固体溶于水放热,也能使温度升高 。
② 丙同学取少量反应后的溶液于试管中,加入无色酚酞试液,无明显现象,
于是三名同学对反应后溶液中溶质的成分作出猜想。
猜想一:NaCl;猜想二:NaCl和NaOH;猜想三:
色
为止,说明氢氧化钠和稀硝酸恰好完全反应,该反应的化学方程式为
NaOH+HNO3
Ba(OH)2+2HNO3
由红色变为无色
;反应的化学方程式为
Ba(NO3)2+2H2O ;反应过程中溶液的pH 变小 (填
“变大”“变小”或“不变”)。
8. 取稀盐酸与氢氧化钠反应后的溶液进行实验,下列能说明两者恰好完全
反应的是
( C )
A. 加Fe(OH)3生成黄色溶液
B. 加入镁粉,无气体生成
再进行过滤,将剩余的Cu(OH)2滤去,选项D所用方法能除去杂质且没有引
入新的杂质,符合除杂原则,选项D所用方法可行。因此,本题应选D。
5. 中和反应在生产、生活中有广泛的应用。
(1) 向盛有一定量稀盐酸的密闭隔热容器中,加入氢氧化钠
固体,利用数字传感器测出反应时间与溶液温度变化的图像
如图所示。
第5题
化钠溶液的反应后,分别结合自己在实验室中所做的实验,从不同方面对其
进行图像描述。图A是实际操作图,图B是反应过程中溶液的酸碱度变化
图,图C是微观粒子结合过程的示意图。请回答下列问题:
(1) 依据图A、图B可知,该实验是将 硫酸溶液 滴加到另一种溶液中。
(2) 图B中b点溶液中的溶质是 NaOH、Na2SO4 。
① 甲同学得出结论:稀盐酸和氢氧化钠反应过程中放热。乙同学不同意他
的观点,乙同学的理由是 氢氧化钠固体溶于水放热,也能使温度升高 。
② 丙同学取少量反应后的溶液于试管中,加入无色酚酞试液,无明显现象,
于是三名同学对反应后溶液中溶质的成分作出猜想。
猜想一:NaCl;猜想二:NaCl和NaOH;猜想三:
色
为止,说明氢氧化钠和稀硝酸恰好完全反应,该反应的化学方程式为
NaOH+HNO3
人教版九年级化学下册10.2酸和碱的中和反应复习课课件共13张PPT

酸滴定碱时检验酸是否过量的方法 小松同学在进行酸碱中和反应的实验时, 向烧杯中的氢氧化钠溶液中滴加稀盐酸 一会儿后,发现忘记了滴加指示剂。为 了确定盐酸与氢氧化钠是否恰好完全反 应,小松同学从烧杯中取少量反应后的 溶液于一支试管中,并向试管中滴加几 滴无色酚酞试液,振荡,观察到酚酞试 液不变色。于是他得出“两种物质已恰 好完全中和”的结论。
结论:HCl + NaOH NaCl + H2O
中和反应: 酸 + 碱来自盐+ 水定义:酸跟碱作用生成盐和水的反应, 叫做中和反应。
中和反应中的图像变化 1、酸加入碱中 当把酸加进碱的时候 ,碱的性质逐渐改变。 当全部碱刚好被中和时,溶液的pH值很快地转变至 pH=7,如果将更多的酸加入时,酸碱度便会降至 pH=7以下。
实验操作: 无色
NaOH溶液 滴入(酚酞 )溶液 溶液为( 红 )色
再滴入( 盐酸)溶液 溶液为( 无 )色
实验分析:
讨论: 1. 酚酞在实验中起什么作用? 答:起指示作用。 因为NaOH与HCl反应无明显的现象发生,根据酚酞溶 液由红色变为无色来判断NaOH和HCl是否反应完全。
2. 为什么在操作中必须逐滴滴入稀盐酸? 答:防止稀盐酸滴加过量。
(中和过程pH的变化)
2、碱加入酸中
请思考碱加入酸中pH怎 样变化?
谢谢观看
①由图示可知,稀盐酸与氢氧化钠溶
液发生的中和反应是
(填“吸
热”、“放热”或“无热量变化”)
的反应。
②反应的化学方程式为 ,B点表
示的含义是
。
③从A到B过程中,烧杯中溶液的pH逐
渐
。
④减小C处溶液中溶质是
。
酸碱恰好完全反应的判断方法:
2018年中考化学复习第19讲中和反应课件新人教版

第19讲 中和反应
中和反应及其作用
定义 实质 原理
酸与碱作用生成盐和水的反应 (酸+碱→盐+水)
酸中的H+与碱中的OH-结合成H2O (即:H++OH-===H2O)
中和反应过程中往往没有明显现象,无法确定 是否发生反应或反应是否完全。因此可采用借 助指示剂、温度变化,及pH变化等方法来判断
操作 判断方法
3.测定溶液pH的方法 用玻璃棒蘸取待测溶液滴在 pH试纸 上,将试纸呈现的颜色 与 标准比色卡 对照,就可以粗略地确定溶液的 酸碱度 。
【注意】(1)用pH试纸测定溶液的酸碱度时,pH试纸不能用水润湿,否则 会使测定结果不准确。
(2)不能将pH试纸直接放入待测溶液中,否则会污染试剂。
中和反应
注意
①中和反应的产物是盐和水,但有盐和水生成的反应不一定是 中和反应,如CO2+2NaOH===Na2CO3+H2O就不是中和反应
②中和反应属于复分解反应,不是基本反应类型 ③中和反应实验中指示剂的选择:一般选用无色酚酞溶液。指 示剂如果选紫色石蕊溶液,紫色石蕊溶液在碱溶液中呈蓝色,
在中性溶液中呈紫色,蓝色与紫色间没有明显的界限
[命题解读]中和反应是化学中考常见的考点,主要在选择题和填空题中以 文字叙述的形式出现。主要命题点有:中和反应的判断、中和反应的应用、 化学方程式的书写等。
【例1】(2017,新疆)中和反应在生活中有广泛应用。下列应用不属于中 和反应的是( A )
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多 C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水 【方法指导】中和反应是指由酸、碱相互作用生成盐和水的反应,据此 来解答。
【进行实验】
【方法指导】做酸和碱的中和反应实验时,常借助酸碱指示剂,通过颜色的 变化来显示中和反应的发生,酚酞溶液遇酸性溶液不变色,做实验时应该控 制药品的用量,酸和碱恰好完全反应的标准是看到红色刚好消失。
中和反应及其作用
定义 实质 原理
酸与碱作用生成盐和水的反应 (酸+碱→盐+水)
酸中的H+与碱中的OH-结合成H2O (即:H++OH-===H2O)
中和反应过程中往往没有明显现象,无法确定 是否发生反应或反应是否完全。因此可采用借 助指示剂、温度变化,及pH变化等方法来判断
操作 判断方法
3.测定溶液pH的方法 用玻璃棒蘸取待测溶液滴在 pH试纸 上,将试纸呈现的颜色 与 标准比色卡 对照,就可以粗略地确定溶液的 酸碱度 。
【注意】(1)用pH试纸测定溶液的酸碱度时,pH试纸不能用水润湿,否则 会使测定结果不准确。
(2)不能将pH试纸直接放入待测溶液中,否则会污染试剂。
中和反应
注意
①中和反应的产物是盐和水,但有盐和水生成的反应不一定是 中和反应,如CO2+2NaOH===Na2CO3+H2O就不是中和反应
②中和反应属于复分解反应,不是基本反应类型 ③中和反应实验中指示剂的选择:一般选用无色酚酞溶液。指 示剂如果选紫色石蕊溶液,紫色石蕊溶液在碱溶液中呈蓝色,
在中性溶液中呈紫色,蓝色与紫色间没有明显的界限
[命题解读]中和反应是化学中考常见的考点,主要在选择题和填空题中以 文字叙述的形式出现。主要命题点有:中和反应的判断、中和反应的应用、 化学方程式的书写等。
【例1】(2017,新疆)中和反应在生活中有广泛应用。下列应用不属于中 和反应的是( A )
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多 C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水 【方法指导】中和反应是指由酸、碱相互作用生成盐和水的反应,据此 来解答。
【进行实验】
【方法指导】做酸和碱的中和反应实验时,常借助酸碱指示剂,通过颜色的 变化来显示中和反应的发生,酚酞溶液遇酸性溶液不变色,做实验时应该控 制药品的用量,酸和碱恰好完全反应的标准是看到红色刚好消失。
中和反应ppt课件

2
重点: 1. 中和反应的实质 2. 化学方程式的书写
难点 : 设计实验证明中和反应的
1、常见的酸有(填化学式)___、_____、___。
HCl
H2SO4
H2CO3
2、常见的碱有(填化学式)___、_______。
3、HCl在水中会解离出__和__;H2SO4在水中会解离出_N_a和O_H____;NCaOa(HO在H)水2 中会解离出___和 ___;Ca(OH)2在水中会解离出___和____。
处理工厂的废水
用于医药
2. 关于中和反应说法不正确的是( )
A
A. 生成盐和水的反应就是中和反应 B. 酸和碱之间发生的作用是中和反应 C. 中和反应中出现的物质都是化合物 D. 中和反应在生产、生活中有广泛应用
22
3.下列反应中属于中和反应的是( )
C
A.Zn + 2HCl
ZnCl2 + H2↑
H++OH-=H2O
中和反应
应用
处理工厂废水
用于医药
21
课堂检测二
1. 中和反应的定义是___________酸_和__碱__作__用__生_成__盐__和_;水中的和反反应
应 实质是______________;中和反应在________________、
H++OH-=H2O
改变土壤的酸碱性
_______________、__________等方面有广泛应用。
写出常见的酸与碱发生反应的化学方程式
HCl + NaOH ==
HCl + Ca(OH) 2 === H2SO4 + NaOH ==
14
HCl + NaOH
重点: 1. 中和反应的实质 2. 化学方程式的书写
难点 : 设计实验证明中和反应的
1、常见的酸有(填化学式)___、_____、___。
HCl
H2SO4
H2CO3
2、常见的碱有(填化学式)___、_______。
3、HCl在水中会解离出__和__;H2SO4在水中会解离出_N_a和O_H____;NCaOa(HO在H)水2 中会解离出___和 ___;Ca(OH)2在水中会解离出___和____。
处理工厂的废水
用于医药
2. 关于中和反应说法不正确的是( )
A
A. 生成盐和水的反应就是中和反应 B. 酸和碱之间发生的作用是中和反应 C. 中和反应中出现的物质都是化合物 D. 中和反应在生产、生活中有广泛应用
22
3.下列反应中属于中和反应的是( )
C
A.Zn + 2HCl
ZnCl2 + H2↑
H++OH-=H2O
中和反应
应用
处理工厂废水
用于医药
21
课堂检测二
1. 中和反应的定义是___________酸_和__碱__作__用__生_成__盐__和_;水中的和反反应
应 实质是______________;中和反应在________________、
H++OH-=H2O
改变土壤的酸碱性
_______________、__________等方面有广泛应用。
写出常见的酸与碱发生反应的化学方程式
HCl + NaOH ==
HCl + Ca(OH) 2 === H2SO4 + NaOH ==
14
HCl + NaOH
人教版九年级化学课件:10.2酸和碱的中和反应(共14张PPT)

蒸馏 水
和CO水2
CO2和 NaOH
成
溶液
果
共
享
重新选择 石蕊 酚酞 稀HCl
CaCl2 溶液 锌粒
石灰石 NaOH溶液
其他
小结
一.验证化学反应的发生
①活液滴加的动稀反一HCl应:→ N验a2C证O3的C存O在→2生和成N新物a质O→H反应溶发生
②滴加CaCl2溶液→ Na2CO3的存在→生成新物质→反应发生
第十单元 酸和碱
课题2 酸和碱的中和反应
(第一课时)
一.验证化学反应的发生
想一想
• 瓶内现在是什么? • 如何验证? • 如何验证没有现象的化学反 应是否发生?
CO2 + H2O == H2CO3 CO2 + 2NaOH == Na2CO3 + H2O
一.验证化学反应的发生 活动一:验证CO2和NaOH溶液的反应
二.中和反应
2. 中和反应的实质:H + + OH - → H2O
交流讨论二
(H1)C反l 应→前,H盐+ 酸+ 和C氢l- 氧化钠溶酸液→中分H别+ 存+ 在酸哪根些离粒子子?
反应后,+生成物+溶液中存在哪些微+粒? +
(N2a) O对H比→反应O前H-后+粒N子a+种类的变碱化→,O你H认- 为+ 上金述属变离aCl晶体 → 生成新物质 → 生
二.中和反应
1. 中和反应:酸 + 碱 == 盐 + 水 盐:金属离子 + 酸根离子 → 盐
交流讨论一
(1) 凡是生成盐和水的反应都是中和反应吗? (2) 如何判断NaOH溶液与稀盐酸之间的反应恰好完全反应? (3) 我们平日所说的调味品盐与化学上的盐是一回事吗?
人教版初中化学九年级下册 10.2.1中和反应(共14张PPT)

4.蛋白质在酶的作用下发生水解反应生成氨基酸,氨基酸分子中含有 氨基(-NH2,具有碱的性质)和羧基(-COOH,具有酸的性质)。请推断氨 基酸分子具有的性质是( C )
A.能与硫酸反应,不能与NaOH反应 B.能与NaOH反应,不能与硫酸反应 C.既能与硫酸反应,又能与NaOH反应 D.既不能与硫酸反应,又不能与NaOH反应
5.要除去CaCl2溶液中的稀盐酸得到纯净的CaCl2溶液,最好的方法是 加入B( )
A.生石灰 B.石灰石 C.熟石灰 D.苛性钠
6.写出下列各物质反应的化学方程式。 (1)向含有盐酸的污水中投入熟石灰 __2HCl+Ca(OH)2===CaCl2+2H2O__ (2)当人体中胃酸过多时服用氢氧化铝 __Al(OH)3+3HCl===AlCl3+3H2O__ (3)将Cu(OH)2放入稀硫酸中溶液变为蓝色 __Cu(OH)2+H2SO4===CuSO4+2H2O__
变式训练 1.在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸至过量,溶液颜 色的变化是( C ) A.红色→蓝色 B.蓝色→红色 C.红色→无色 D.无色→红色 2.下列反应中属于中和反应的是( B ) A.Na2CO3+2HCl===2NaCl+H2O+CO2↑ B.2NaOH+H2SO4===Na2SO4+2H2O C.CO2+2NaOH===Na2CO3+H2O D.Fe+CuSO4===Cu+FeSO4 3.用熟石灰中和一定量的盐酸时,熟石灰与盐酸反应的化学方程式为 _C_a(OH)2+2HCl===CaCl2+2H2O__;当恰好完全反应时,溶液中的溶质为 __ CaCl2 __。
•
10、阅读一切好书如同和过去最杰出 的人谈 话。202 1/8/42 021/8/4 2021/8 /48/4/2 021 2:06:33 PM
A.能与硫酸反应,不能与NaOH反应 B.能与NaOH反应,不能与硫酸反应 C.既能与硫酸反应,又能与NaOH反应 D.既不能与硫酸反应,又不能与NaOH反应
5.要除去CaCl2溶液中的稀盐酸得到纯净的CaCl2溶液,最好的方法是 加入B( )
A.生石灰 B.石灰石 C.熟石灰 D.苛性钠
6.写出下列各物质反应的化学方程式。 (1)向含有盐酸的污水中投入熟石灰 __2HCl+Ca(OH)2===CaCl2+2H2O__ (2)当人体中胃酸过多时服用氢氧化铝 __Al(OH)3+3HCl===AlCl3+3H2O__ (3)将Cu(OH)2放入稀硫酸中溶液变为蓝色 __Cu(OH)2+H2SO4===CuSO4+2H2O__
变式训练 1.在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸至过量,溶液颜 色的变化是( C ) A.红色→蓝色 B.蓝色→红色 C.红色→无色 D.无色→红色 2.下列反应中属于中和反应的是( B ) A.Na2CO3+2HCl===2NaCl+H2O+CO2↑ B.2NaOH+H2SO4===Na2SO4+2H2O C.CO2+2NaOH===Na2CO3+H2O D.Fe+CuSO4===Cu+FeSO4 3.用熟石灰中和一定量的盐酸时,熟石灰与盐酸反应的化学方程式为 _C_a(OH)2+2HCl===CaCl2+2H2O__;当恰好完全反应时,溶液中的溶质为 __ CaCl2 __。
•
10、阅读一切好书如同和过去最杰出 的人谈 话。202 1/8/42 021/8/4 2021/8 /48/4/2 021 2:06:33 PM
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸的通性
碱的通性
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
pH
7
ቤተ መጻሕፍቲ ባይዱpH
7
0
1
V(盐酸)
0
2
V(盐酸)
酸(H+)
碱(OH-)
中和反应:酸和碱反应生成盐和水 中和反应实质:H+和OH-结合成水
熟石灰改良酸性土壤
熟石灰用途:改良酸性土壤
治疗胃酸(盐酸)过多
用熟石灰处理泄露的硫酸
用熟石灰处理工业上的酸性废水
写出下列反应的化学方程式 ⑴盐酸和氢氧化钠 ⑵硫酸和氢氧化钠 ⑶氢氧化镁和盐酸 ⑷盐酸和氢氧化铝 ⑸硫酸和氢氧化钙 ⑹硝酸和氢氧化钙 ⑺盐酸和氢氧化钾 ⑻硫酸和氢氧化钡
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
往氢氧化钠溶液中逐滴加入稀盐酸,并 即刻振荡,那么溶液的pH随滴加稀盐酸的数 量变化曲线正确的是:
碱的通性
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
pH
7
ቤተ መጻሕፍቲ ባይዱpH
7
0
1
V(盐酸)
0
2
V(盐酸)
酸(H+)
碱(OH-)
中和反应:酸和碱反应生成盐和水 中和反应实质:H+和OH-结合成水
熟石灰改良酸性土壤
熟石灰用途:改良酸性土壤
治疗胃酸(盐酸)过多
用熟石灰处理泄露的硫酸
用熟石灰处理工业上的酸性废水
写出下列反应的化学方程式 ⑴盐酸和氢氧化钠 ⑵硫酸和氢氧化钠 ⑶氢氧化镁和盐酸 ⑷盐酸和氢氧化铝 ⑸硫酸和氢氧化钙 ⑹硝酸和氢氧化钙 ⑺盐酸和氢氧化钾 ⑻硫酸和氢氧化钡
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
⒈ 酸的通性;碱的通性。 ⒉ 稀盐酸(溶质HCl)可以与___反应; NaOH溶液可以与___反应。
可选用试剂: ⑴CO2 ⑵Na2CO3溶液 ⑷H2SO4溶液 ⑸Fe2O3 ⑺Cu ⑻CuCl2溶液 ⑽NaOH溶液 ⑾Mg(OH)2
⑶Fe ⑹CuO ⑼CO
往氢氧化钠溶液中逐滴加入稀盐酸,并 即刻振荡,那么溶液的pH随滴加稀盐酸的数 量变化曲线正确的是:
