6热力学第五章
合集下载
热力学第五章

哪个参数才能正确评价能的价值
焓:绝热节流
p1 p2
h1 = h2
等焓节流
w1
w2
w1 > w2
焓相同,但做功不等。 焓相同,但做功不等。
哪个参数才能正确评价能的价值 内能: 内能:绝热膨胀
u1 = u2
p0 w1 w2 p0
w1 > w2
内能相同,但做功不等。 内能相同,但做功不等。
三种不同品质的能量
从可转换成机械能的角度出发能量的组成为环境一定能量中最大可能转换为功的部分500100kjmax293100500414max2931001000707100kj热量温差温差化学化学势差物理温差与压力差物质或物流动能速度差位能位置差扩散浓度差电力电位差水力水位差风力风压差地力压力差波浪压力差与各种不平衡势差有关nq1恒温热源nq卡诺循环的功nqxqxqnqnq微元卡诺循环的功xqnq1q中最大可能转换为功的部分就是exq损失3单热源热机不能作功热ex损失作功能力损失xqt一定qxq51空气由空气由200200经冷却器定压冷却到经冷却器定压冷却到4040试计算空气放出的热量算空气放出的热量火用或空气作出的最大功或空气作出的最大功是是多少
1、可无限转换的能量 、
Ex An
无效能
理论上可以完全转换为功的能量 高级能量 机械能、电能、水能、 如:机械能、电能、水能、风能 2、不能转换的能量 、 理论上不能转换为功的能量 环境(大气、海洋) 如:环境(大气、海洋) 3、可有限转换的能量 Ex + An 、 理论上不能完全转换为功的能量 热能、 如:热能、焓、内能
3、单热源热机不能作功, T =T0, ExQ′=0 、单热源热机不能作功,
冷量的ExQ′与AnQ′的说明
热力学第5章2011

2019/8/31
32/103
34
2.卡诺循环热机效率
t
w q1
q1 q2 1 q2
q1
q1
t,C
1
T2 T1
s2 s2
s1 s1
1
T2 T1
2019/8/31
T1
q1
Rc
w
q2
T2
33/103
卡诺循环热机效率的说明
t,C
1
T2 T1
• t,c只取决于恒温热源T1和T2 ;而与工质
② 自发过程的例子
功和热的转换,摩擦过程:重物下降带动 搅拌器搅动液体
有限温差传热:高温物体向低温物体传热 自由膨胀:气体侧向真空侧膨胀
混合过程:两侧不同气体互相扩散混合
这些过程自发地只朝一个固定的方向发展,
过程进行的深度都有一定限度。
2019/8/31
4/103
Water always flows downhill
第五章 热力学第二定律
(The Second Law of thermodynamics)
2019/8/31
1
第五章 热力学第二定律
§5-1 热力学第二定律 §5-2 卡诺循环 §5-3 状态参数熵的导出 §5-4 熵增原理 §5-5 熵方程及火用
2019/8/31
2/103
§5-1 热力学第二定律
th
Wnet,out Qin
100 %
25/103
So What is the Best You Can Do?
• We know that thermal efficiencies for heat engines must be less than 100%, but how much less?
32/103
34
2.卡诺循环热机效率
t
w q1
q1 q2 1 q2
q1
q1
t,C
1
T2 T1
s2 s2
s1 s1
1
T2 T1
2019/8/31
T1
q1
Rc
w
q2
T2
33/103
卡诺循环热机效率的说明
t,C
1
T2 T1
• t,c只取决于恒温热源T1和T2 ;而与工质
② 自发过程的例子
功和热的转换,摩擦过程:重物下降带动 搅拌器搅动液体
有限温差传热:高温物体向低温物体传热 自由膨胀:气体侧向真空侧膨胀
混合过程:两侧不同气体互相扩散混合
这些过程自发地只朝一个固定的方向发展,
过程进行的深度都有一定限度。
2019/8/31
4/103
Water always flows downhill
第五章 热力学第二定律
(The Second Law of thermodynamics)
2019/8/31
1
第五章 热力学第二定律
§5-1 热力学第二定律 §5-2 卡诺循环 §5-3 状态参数熵的导出 §5-4 熵增原理 §5-5 熵方程及火用
2019/8/31
2/103
§5-1 热力学第二定律
th
Wnet,out Qin
100 %
25/103
So What is the Best You Can Do?
• We know that thermal efficiencies for heat engines must be less than 100%, but how much less?
《工程热力学》热力学第五章第三部分

内能ex:(有用功)
exu w'' p0 v0 v1
u1, s1, T1, p1, v1 p0
w
克服环境压力
q w ’’
exu u1 u0 T0 s1 s0 p0 v1 v0 w ’
anu T0 s1 s0 p0 v1 v0
q'
T0
闭口系统内能的Ex与An的说明 exu u1 u0 T0 s1 s0 p0 v1 v0
Q2 WmaxC
0QT2 0T1TT0T1Q2Q2
TTT0 01S
Q2 Q2
Wmax Q2
T<T0
冷量的Ex与An的说明
ExQ2 T0S Q2 AnQ2 T0S
T T0
冷量Ex可理解为: T<T0,肯定是对其作功才形
成的,而这个功(就是Ex)就
ExQ2 T
Q2
储存在冷量里了。
S
实际上,只要系统状态与环境的状态有差别,
cm Tmax TC cm TA T ' cm TB T '
例1
热一律, 热平衡
cm Tmax TC cm TA T ' cm TB T '
Tmax 2T ' TA TB TC
热二律, 取孤立系
Siso SA SB SC 0
cm ln T ' cm ln T ' cm ln Tmax 0
例2
Qnet 803.2 Wnet Qnet 0.993T
热一律 热二律
随热源温度T不同,无穷多解
m1=4kg/s
p1=2atm T1=500K
Qnet
T
Wnet
T 500K
Qnet 496.5kJ
exu w'' p0 v0 v1
u1, s1, T1, p1, v1 p0
w
克服环境压力
q w ’’
exu u1 u0 T0 s1 s0 p0 v1 v0 w ’
anu T0 s1 s0 p0 v1 v0
q'
T0
闭口系统内能的Ex与An的说明 exu u1 u0 T0 s1 s0 p0 v1 v0
Q2 WmaxC
0QT2 0T1TT0T1Q2Q2
TTT0 01S
Q2 Q2
Wmax Q2
T<T0
冷量的Ex与An的说明
ExQ2 T0S Q2 AnQ2 T0S
T T0
冷量Ex可理解为: T<T0,肯定是对其作功才形
成的,而这个功(就是Ex)就
ExQ2 T
Q2
储存在冷量里了。
S
实际上,只要系统状态与环境的状态有差别,
cm Tmax TC cm TA T ' cm TB T '
例1
热一律, 热平衡
cm Tmax TC cm TA T ' cm TB T '
Tmax 2T ' TA TB TC
热二律, 取孤立系
Siso SA SB SC 0
cm ln T ' cm ln T ' cm ln Tmax 0
例2
Qnet 803.2 Wnet Qnet 0.993T
热一律 热二律
随热源温度T不同,无穷多解
m1=4kg/s
p1=2atm T1=500K
Qnet
T
Wnet
T 500K
Qnet 496.5kJ
(6)第五章水蒸汽热力性质_热工基础 [兼容模式].
![(6)第五章水蒸汽热力性质_热工基础 [兼容模式].](https://img.taocdn.com/s3/m/241e41e39ec3d5bbfd0a7444.png)
饱和湿空气:湿空气中的水蒸气已饱和, 不能再吸收水份。
pv = ps (T )
49
工程热力学 露点
露点:湿空气中的水蒸气分压力pv对应的饱和温度Td 称为露点温度, 简称露点。
pv < ps (T )
结露:定压降温到露点, 湿空气中的水蒸气饱和, 凝结 成水(过程1-2)。 结霜:Td < 0 DC
Ts=85.95 ℃ Ts=113.32 ℃
纯物质的p-T相图
p
液 固
p 流体
临界点
气 三相点
流体
固
液
临气界点 三相点
水
T
一般物质 T
工程热力学 水蒸气的定压发生过程
t < ts 未饱和水
v < v'
t = ts
t = ts
t = ts
t > ts
饱和水 饱和湿蒸汽 饱和干蒸汽 过热蒸汽
v = v' v'< v <v'' v = v'' v > v''
h, v, s
工程热力学
水和水蒸气表
两类
1、饱和水和干饱和蒸汽表 2、未饱和水和过热蒸汽表
工程热力学
34
工程热力学
35
工程热力学
表的出处和零点的规定
表依据1963年第六届国际水和水蒸气会议发表的国际骨架表编 制, IFC(国际公式化委员会)1967、1997和2005年先后发表分段 拟合的水和水蒸气热力性质公式, 但工程上仍会用到图表。 焓、内能、熵零点的规定: 原则上可任取零点, 国际上统一规定。
Thermal Process of Steam
pv = ps (T )
49
工程热力学 露点
露点:湿空气中的水蒸气分压力pv对应的饱和温度Td 称为露点温度, 简称露点。
pv < ps (T )
结露:定压降温到露点, 湿空气中的水蒸气饱和, 凝结 成水(过程1-2)。 结霜:Td < 0 DC
Ts=85.95 ℃ Ts=113.32 ℃
纯物质的p-T相图
p
液 固
p 流体
临界点
气 三相点
流体
固
液
临气界点 三相点
水
T
一般物质 T
工程热力学 水蒸气的定压发生过程
t < ts 未饱和水
v < v'
t = ts
t = ts
t = ts
t > ts
饱和水 饱和湿蒸汽 饱和干蒸汽 过热蒸汽
v = v' v'< v <v'' v = v'' v > v''
h, v, s
工程热力学
水和水蒸气表
两类
1、饱和水和干饱和蒸汽表 2、未饱和水和过热蒸汽表
工程热力学
34
工程热力学
35
工程热力学
表的出处和零点的规定
表依据1963年第六届国际水和水蒸气会议发表的国际骨架表编 制, IFC(国际公式化委员会)1967、1997和2005年先后发表分段 拟合的水和水蒸气热力性质公式, 但工程上仍会用到图表。 焓、内能、熵零点的规定: 原则上可任取零点, 国际上统一规定。
Thermal Process of Steam
热力学第五章6162474页PPT文档
四冲程高速柴油机的理想化
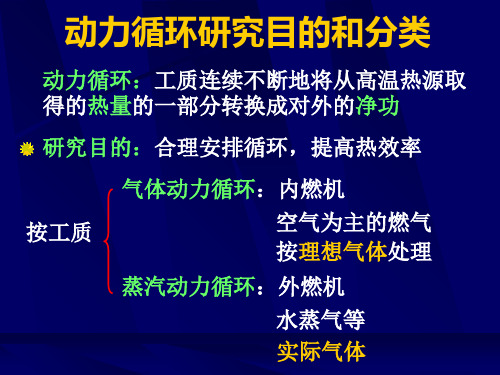
1. 工质
p3 4
定比热理想气体
工质数量不变
2
P-V图p-v图
2’
2. 0—1和1’ —0抵消 开口闭口循环
3. 燃烧外界加热
p0 0
5 1’
1
4. 排气向外界放热
V
5. 多变绝热
6. 不可逆可逆
理想混合加热循环(萨巴德循环)
分析循环吸热量,放热量,热效率和功量
p
3
4
T
4 3
1
2’ 喷柴油
V
2 开始燃烧
2—3 迅速燃烧,近似 V
p↑5~9MPa
四冲程高速柴油机工作过程
3—4 边喷油,边膨胀
p3 4
近似 p 膨胀
t4可达1700~1800℃
2 2’
4 停止喷柴油
5
4—5 多变膨胀
p0
1’
p5=0.3~0.5MPa
0
1
t5500℃
V
5—1’ 开阀排气, V 降压
1’—0 活塞推排气,完成循环
p 3
T
3
2
2
4
4
1
1
v
s
定容加热循环的计算Βιβλιοθήκη 吸热量T3
q1cvT3T2
放热量(取绝对值)
2
4
q2cvT4T1
1
热效率
s
t
wq1q21q21T 4T 1
q1 q1
q1 T 3T 2
定容加热循环的计算
热效率
T
t
1 T4 T3
T1 T2
1
T1
T4 T1
T2
T3 T2
工程热力学:6第五章 热力学第二定律

(5-3)
同样,逆向卡诺循环是最理想、经济性最高,但通常难以实现。
30
三种卡诺循环
T T1
制热
T0
制冷
T2
T1
动力
T2
s
31
四、多热源可逆循环
热源多于两个的可逆循环如 右图所示。要使循环可逆,必须 有无穷个热源和冷源,保持工质 和热源间无温差换热。
此循环的平均吸热温度 T1 和平 均放热温度 T2分别定义为:
属于“天上掉馅饼”,第三类无摩擦。
I.
违背热力学第一定律(热效率大于100%)。20世纪90年
代山东枣庄有人发明了一个“耗电12kW,可发电36kW”的
发电机,即为一例。类似专利申请美国专利局已有数以千计,
但尚无成功报道。
II.
违背热力学第二定律(热效率等于100%)。如果此类机
器能够制造成功,由于太阳能、地热能和海洋热能等的巨大,
汽车停止时摩擦产生热,但热消失时 汽车能否行驶?
4
热力学第一定律
序言
能量之间数量的关系 能量守恒与转换定律
不足之处:未表明能量传递或转化时的 方向、条件和限度。
低温物体会吸热,温度逐渐升高;高温 物体会放热,温度逐渐降低。但热量能 否无条件的由低到高?
5
热力学第一定律
序言
能量之间数量的关系 能量守恒与转换定律
第五章 热力学第二定律
序言 5-1 热力学第二定律 5-2 可逆循环分析及其热效率 5-3 卡诺定理 5-4 熵参数、热过程方向的判据 5-5 熵增原理 5-6 熵方程 5-7 (火用)参数的基本概念 热量(火用) 5-8 工质(火用)及系统(火用)平衡方程 5-9 热力学温标
目录
1
(16)热力学第五章3

孤立系统熵增原理
孤立系统 = 非孤立系统 + 相关外界
Siso 0
=:可逆过程 >:不可逆过程 <:不可能过程
最常用的热二律数学表达式
孤立系统熵增原理的应用
• 选取孤立系统
• 分析计算子系统:热源、冷源、工质、物
质源及环境的熵变 • 所有子系统的熵变之和为孤立系统总熵变 • 根据总熵变判断过程或变化 • 总熵变即为孤立系统的熵产
Q1 T1 Q2 T2
0
T1 Q1 W功 R 源 Q2 T2
Q2 T2 t t ,c 1 1 Q1 T1
孤立系熵增原理举例(2)
两恒温热源间工作的可逆热机
Siso Q1 T1 Q2 T2 0
T T1
T1 Q1 W功 R 源 Q2 S T2
T2
孤立系熵增原理举例(3)
S f m(s2 s1 )
例 题
• 气体在气缸中被压缩,气体的热力学能
和熵的变化分别为45kJ和-0.289kJ/K, 外界对气体做功165kJ。过程中气体只 与环境交换热量,环境温ห้องสมุดไป่ตู้为300K。问 该过程是否能够实现?
热二律解决的典型问题
1. 某循环或过程能否实现?
Q
Tr 0
熵变的计算方法
功源:只与外界交换功 无耗散
功源的熵变
S 0
理想弹簧
分析系统熵变时,做功项熵变为零。
例 题
• 有1mol的某种理想气体,从状态1经过一
个不可逆过程变化到状态2。已知状态1的 压力、体积和温度分别为p1、V1、T1,状 态2的体积V2=2V1,温度T2=T1。若设比 热容为定值,求熵变化量(S2-S1)。
热力学第五章

Q A1 Q B1
WA '
T1
WB '
A
QA2 '
B
QB 2 '
′ WA ηA = , QA1
′ WB ηB = QB1
低温热源
η A < ηB
QA1 = QB1,
T2
则由 QA1 = WA '+QA2 ' , 如果
QB1 = WB '+QB2 ' 知 QB2 '−QA2 ' = WA '−WB '
首先看出, 克劳修斯 (Clausius) 首先看出,有必要在热力学第一定律之外建立
2
一条独立的定律来概括自然界的不可逆现象。 一条独立的定律来概括自然界的不可逆现象。
可逆过程与不可逆过程的定义 一个系统由某一状态出发,经过某一过程达到另一个状态, 一个系统由某一状态出发,经过某一过程达到另一个状态, 如果存在另一个过程使得系统和外界都完全复原( 如果存在另一个过程使得系统和外界都完全复原(即系统恢 复到原来的状态,同时消除对外界的一切影响),则原来的 复到原来的状态,同时消除对外界的一切影响),则原来的 ), 过程称为可逆过程。反之, 过程称为可逆过程。反之,如果用任何方式都不可能使系统 和外界都完全复原,则称原来的过程为不可逆过程。 和外界都完全复原,则称原来的过程为不可逆过程。 可逆过程举例
T ν 2a ∂U ∂U U = ∫ +U0 dT + ∫ dV = ∫ CV dT − T0 V ∂T V ∂V T
所有准静态过程都是可逆过程。 所有准静态过程都是可逆过程。
Vf V 3
不可逆过程举例 气体向真空的自由膨胀。 → : 气体向真空的自由膨胀。i→f:∆U = 0, Q = 0, W = 0。尽管可以经一等温过程由 。 f→i, W → f →i ≠ 0,
WA '
T1
WB '
A
QA2 '
B
QB 2 '
′ WA ηA = , QA1
′ WB ηB = QB1
低温热源
η A < ηB
QA1 = QB1,
T2
则由 QA1 = WA '+QA2 ' , 如果
QB1 = WB '+QB2 ' 知 QB2 '−QA2 ' = WA '−WB '
首先看出, 克劳修斯 (Clausius) 首先看出,有必要在热力学第一定律之外建立
2
一条独立的定律来概括自然界的不可逆现象。 一条独立的定律来概括自然界的不可逆现象。
可逆过程与不可逆过程的定义 一个系统由某一状态出发,经过某一过程达到另一个状态, 一个系统由某一状态出发,经过某一过程达到另一个状态, 如果存在另一个过程使得系统和外界都完全复原( 如果存在另一个过程使得系统和外界都完全复原(即系统恢 复到原来的状态,同时消除对外界的一切影响),则原来的 复到原来的状态,同时消除对外界的一切影响),则原来的 ), 过程称为可逆过程。反之, 过程称为可逆过程。反之,如果用任何方式都不可能使系统 和外界都完全复原,则称原来的过程为不可逆过程。 和外界都完全复原,则称原来的过程为不可逆过程。 可逆过程举例
T ν 2a ∂U ∂U U = ∫ +U0 dT + ∫ dV = ∫ CV dT − T0 V ∂T V ∂V T
所有准静态过程都是可逆过程。 所有准静态过程都是可逆过程。
Vf V 3
不可逆过程举例 气体向真空的自由膨胀。 → : 气体向真空的自由膨胀。i→f:∆U = 0, Q = 0, W = 0。尽管可以经一等温过程由 。 f→i, W → f →i ≠ 0,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
何不可逆热机,其热效率总小于这两个热源
间工作的可逆热机的效率。
已证: tIR > tR 证明tIR = tR
T1
反证法,假定:tIR = tR
令 Q1 = Q1’ 则 WIR = WR
∴ Q1’- Q1 = Q2’ - Q2= 0
工质循环、冷热源均恢复原状, 外界无痕迹,只有可逆才行,
Q1
1、正循环(卡诺循环) ∵可逆时 T1 T2
(2)不可逆循环
Ñ Q Q1' Q2' 0 吸热
T1
Q1’
Q1
假定 Q1=Q1’ ,tIR < tR,W’<W
W’
W
IR R
Q2' Q2
Q2’
Q2
Ñ ∴
Q Q1' Q2' 0
T T1 T2
T2
克劳修斯不等式的推导Q1 Q2
反证法:假定违反开表述
热机A从单热源吸热全部作功
Q1 = WA 用热机A带动可逆制冷机B 取绝对值
Q1’ = WA + Q2’
T1 热源
Q1
Q1’
A WA B
Q1’ -Q2’= WA = Q1
Q2’
Q1’ -Q1 = Q2’ 违反克表述
冷源 T2 <T1
证明2、违反克表述导致违反开表述
反证法:假定违反克表述
定理:在两个不同温度的恒温热源间工作的 所有热机,可逆热机的热效率为最高。
即在恒温T1、T2下 t,任 t,R
卡诺提出:卡诺循环效率最高 结论正确,但推导过程是错误的
当时盛行“热质说”
1850年开尔文,1851年克劳修斯分别重新证明
开尔文的证明—反证法
要证明 tIR tR
若 tIR > tR
s1 s1
1
T2 T1
T1 q1
Rc w q2
T2
卡诺循环热机效率的说明
t,C
1
T2 T1
• t,c只取决于恒温热源T1和T2
而与工质的性质无关;
• T1 t,c , T2 c ,温差越大,t,c越高
• T1 = K, T2 = 0 K, t,c < 100%, 热二律
2、反循环(卡诺循环)
T1 T2
(1)可逆循环
Ñ Q Q1 Q2 0 放热
C
Q2 Q1 Q2
T2 T1 T2
1 Q1 1 Q2
1 T1 1 T2
T1
Q1 W
R Q2
Ñ ∴
Q Q1 Q2 0
T
T1 T2
T2
克劳修斯不等式的可逆推时导Q1 Q2
300 K
实际循环与卡诺循环
卡诺热机只有理论意义,最高理想 实际上 T s 很难实现
内燃机 t1=2000oC,t2=300oC
tC =74.7% 实际t =30~40%
火力发电 t1=600oC,t2=25oC
tC =65.9% 实际t =40% 回热和联合循环t 可达50%
作业
5-1 5-3 5-4
2、多热源间工作的一切可逆热机
tR多 < 同温限间工作卡诺机 tC
3、不可逆热机tIR < 同热源间工作可逆热机tR tIR < tR= tC
∴ 在给定的温度界限间工作的一切热机,
tC最高
热机极限
卡诺定理的意义
从理论上确定了通过热机循环 实现热能转变为机械能的条件,指 出了提高热机热效率的方向,是研 究热机性能不可缺少的准绳。
tR多
1
T
_
2
6
T1
5s
概括性卡诺热机
如果吸热和放热的多变指数相同
∴ ab = cd = ef
完全回热
T
a T1 b
tR概括
1 T2 T1
tC
n
n
d e T2 c f
s 这个结论提供了一个提高热效率的途径
卡诺定理小结
1、在两个不同 T 的恒温热源间工作的一切
可逆热机
tR = tC
1-2定温吸热过程, q1 = T1(s2-s1) 2-3绝热膨胀过程,对外作功
3-4定温放热过程, q2 = T2(s2-s1) 4-1绝热压缩过程,对内作功
卡诺 循环 示意 图
卡诺循环热效率
t
w q1
q1 q2 q1
1
q2 q1
卡诺循环热效率
t,C
1
T2 s2 T1 s2
第二类永动机???
如果三峡水电站用降温法发电,使水 温降低5C,发电能力可提高11.7倍。 设水位差为180米 重力势能转化为电能:
E mgh 1800m[J ]
mkg水降低5C放热:
Q 21000m 11.7 E 1800m
Q cmt 21000m[J ]
克劳修斯表述
T
T1
制热
T0
制冷
T2
T1
动力
T2
s
例题
有一卡诺热机,从T1热 源吸热Q1,向T0环境放热Q2, 对外作功W带动另一逆向 卡诺循环,从T2冷源吸热Q2’, 向T0放热Q1’ 试证: 当T1>>T0 则
Q2' Q1
T2 T0 T2
C
T1
Q1 W
Q2 T0
Q1’
Q2’ T2(<T0)
§5-3 卡诺定理 (热二律的推论之一)
A 热机是否能实现
Ñ TQ
2000 1000
800 300
可能
0.667kJ/K 0
1000 K 2000 kJ
如果:W=1500 kJ
Ñ TQ
2000 1000
500 300
不可能
A 1200 kJ 1500 kJ
800 kJ 500 kJ
0.333kJ/K 0
300 K
对热力学第二定律的建立具有 重大意义。
卡诺定理举例
A 热机是否能实现
tC
1 T2 T1
1 300 1000
70%
t
w q1
1200 2000
60%
可能
如果:W=1500 kJ
t
1500 2000
75%
不可能
1000 K
2000 kJ
A
1200 kJ 1500 kJ
800 kJ 500 kJ
• 当T1=T2, t,c = 0, 单热源热机不可能
逆向卡诺循环卡诺制冷循环
T
T0
制冷
T2
s1
s2 s
C
q2 w
q2 q1 q2
T2 (s2 s1)
T2
T0 (s2 s1) T2 (s2 s1) T0 T2
T0 c T2 c
1 T0 1 T2
T0 q1
Q2热量无偿从冷源送到热源 假定热机A从热源吸热Q1
T1 热源
对对冷外源作放功热WAQ2 WA = Q1 - Q2 冷源无变化
Q1
A WA
从热源吸收Q1-Q2全变成功WA Q2
Q2 Q2
违反开表述
冷源 T2 <T1
热二律的实质
• 自发过程都是具有方向性的 • 表述之间等价不是偶然,说明共同本质 • 自发过程若想逆向进行,必付出代价
Clausius statement
不可能将热从低温物体传至高温 物体而不引起其它变化。
例:空调,制冷 代价:耗功
热量不可能自发地、不付代价地 从低温物体传至高温物体。
两种表述的关系
开尔文-普朗克 表述
克劳修斯表述
完全等效!!! 违反一种表述,必违反另一种表述!!!
证明1、违反开表述导致违反克表述
注意: 热量的正和负是站在循环的立场上
§5-4 熵Entropy
热二律推论之一
卡诺定理给出热机的最高理想
热二律推论之二
克劳修斯不等式反映方向性
热二律推论之三
熵反映方向性
熵的导出
反循环(可逆、不可逆)
Ñ Q 0 放热
Ñ TQ 0
可逆 = 不可逆 <
仅卡诺循环
克劳修斯不等式
热源温度
将循环用无数组 s 线细 分,abfga近似可看成卡 诺循环
∴ 对任意循环
Ñ TQr 0
克劳修斯 不等式
= 可逆循环 < 不可逆循环 > 不可能 热二律表达式之一
克劳修斯不等式例题
§5-4 克劳修斯不等式
Clausius inequality
热二律推论之一 卡诺定理给出热机的最高理想
热二律推论之二 克劳修斯不等式反映方向性 定义熵
§5-4、 §5-5熵、 §5-6孤立系熵增原理
围绕方向性问题,不等式
克劳修斯不等式
克劳修斯不等式的研究对象是循环 方向性的判据
克劳修斯不等式 的推导
切可逆热机,具有相同的热效率,且与工质 的性质无关。
求证: tR1 = tR2
由卡诺定理
tR1 > tR2
tR2 > tR1
只有: tR1 = tR2
T1
Q1
Q1’
R1WR1 R2WR2
tR1 = tR2= tC
Q2
Q2’
与工质无关
T2
卡诺定理推论二
在两个不同温度的恒温热源间工作的任
加条件;并非所有不违反热力学第一定律的过程均可行。
