高中化学各种水的汇集!
高中化学知识点复习PPT:自然界的水

第8讲 自然界的水
知识梳理
④实验时得到的氧气与氢气的体积比小于 1∶2,可能的原因有:氧气在水中的溶解度 比氢气的大;氧气具有氧化性,部分氧气将 电极氧化而消耗。
第8讲 自然界的水
知识梳理
2.水的生成实验 氢气是____无______ 色____无______味的气体,密度比 空气____小______,____难______溶于水。氢气在空气中 燃烧火焰呈___淡__蓝_____色;点燃氢气和空气或氧气的 混合物会发生_____爆__炸_______,所以在点燃氢气前一 定要___验__纯_____。氢气燃烧的化学方程式 _2__H_2_+__O_2__点__燃__2_H__2O____________________。
5.水是宝贵的自然资源(认识)
6.树立保护水资源和节约用水的意识(内化)
年份 近三 年广 2017 东省 中考 2018
题型 选择
填空
分值 难易度
考查点
2
易
水的组成、净化,硬 水软水的区别
1
易
硬水软水的区别
考查
情况
2019
选择、 填空
3
易
保护水资源、硬水软 水的区别
第8讲 自然界的水
知识梳理
一、水的组成 1.测定水的组成实验——电解水 (1)电解水的化学方程式: __2_H_2_O__通_电___2_H_2_↑_+__O_2_↑_________________________。 (2)现象:电源正、负两极都有___气__泡_____产生,正 极与负极的气体体积比为___1_∶__2____。电源正极产生 的气体可以使燃着的木条_燃__烧__更__旺___;电源负极产生 的气体能燃烧,火焰呈___淡__蓝_____色。(正氧负氢, 氧一氢二)
高中化学水专题知识归纳与透析
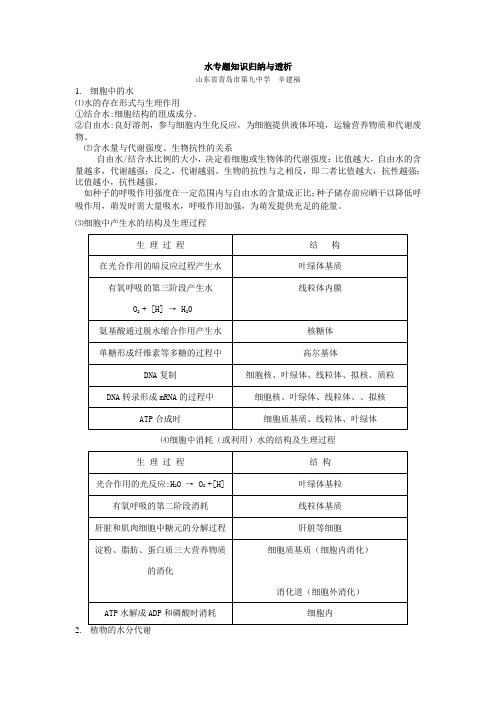
水专题知识归纳与透析山东省青岛市第九中学辛建福1.细胞中的水⑴水的存在形式与生理作用①结合水:细胞结构的组成成分。
②自由水:良好溶剂,参与细胞内生化反应,为细胞提供液体环境,运输营养物质和代谢废物。
⑵含水量与代谢强度、生物抗性的关系自由水/结合水比例的大小,决定着细胞或生物体的代谢强度:比值越大,自由水的含量越多,代谢越强;反之,代谢越弱。
生物的抗性与之相反,即二者比值越大,抗性越强;比值越小,抗性越强。
如种子的呼吸作用强度在一定范围内与自由水的含量成正比;种子储存前应晒干以降低呼吸作用,萌发时需大量吸水,呼吸作用加强,为萌发提供充足的能量。
⑶细胞中产生水的结构及生理过程⑷细胞中消耗(或利用)水的结构及生理过程2.⑴水的吸收①吸胀吸水A.前提条件是植物细胞在没有形成中央大液泡前,主要通过吸胀作用吸水。
B.其原理是依靠细胞内的亲水性物质(蛋白质、淀粉、纤维素)吸水。
(注意:由于任何植物细胞内都有亲水性物质存在,所以任何植物细胞都能进行吸胀作用吸水。
)②渗透作用吸水的原理:A.具有中央大液泡的成熟植物细胞主要通过渗透作用吸水B.渗透系统的两个条件————一个成熟植物细胞是一个渗透系统a.半透膜(原生质层:细胞膜、液泡膜和两膜之间的细胞质,具有选择透过性);b.半透膜两侧溶液浓度差(细胞液浓度与外界溶液的浓度差)。
c.渗透作用原理的最佳例子———质壁分离及复原验证外界溶液浓度 > 细胞液浓度→细胞失水→植物细胞发生质壁分离外界溶液浓度 < 细胞液浓度→细胞吸水→质壁分离的植物细胞发生复原外界溶液浓度 = 细胞液浓度→不吸水,也不失水→不发生质壁分离及复原注意:发生质壁分离时,a.内因:原生质层具选择透过性且原生质层的伸缩性比细胞壁大;b.外因:原生质层两侧溶液具有浓度差;c.现象是:液泡体积变小;液泡颜色变深→细胞液的浓度增大,细胞的吸水能力增强。
(发生复原时,则相反。
)⑵水的运输①蒸腾作用是植物吸收水分和运输水分的主要动力。
高中化学中与水有关的反应有哪些

高中化学中与水有关的反应有哪些一、水参与的氧化还原反应1、水作氧化剂(1)水与钠、其它碱金属、镁等金属反应生成氢气和相应碱(2)水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁)(3)水与碳在高温下反应生成“水煤气”(4)铝与强碱溶液反应2、水作还原剂:水与F2的反应3、水既做氧化剂又做还原剂:水电解4、水既不作氧化剂也不作还原剂(1)水与氯气反应生成次氯酸和盐酸(2)水与过氧化钠反应生成氢氧化钠和氧气(3)水与二氧化氮反应生成硝酸和一氧化氮二、水参与的非氧化还原反应1、水合、水化(1)水与二氧化硫、三氧化硫、二氧化碳、五氧化二磷等酸性氧化物化合成酸。
(能与二氧化硅化合吗?)(2)水与氧化钠、氧化钙等碱性氧化物化合成碱。
(氧化铝、氧化铁等与水化合吗?)(3)氨的水合、无水硫酸铜水合(变色,可检验液态有机物中是否含水)、浓硫酸吸水、工业酒精用生石灰吸水然后蒸馏以制无水酒精、乙烯水化成乙醇2、水解卤代烃水解、乙酸乙酯水解、油脂水解(酸性水解或皂化反应)、水与碳化物——电石反应制乙炔、盐类的水解、氮化物水解、糖类的水解、氢化物——氢化钠水解3、名称中带“水”的物质(1)与氢的同位素或氧的价态有关的“水”蒸馏水—H2O、重水—D2O、超重水—T2O、双氧水—H2O2(2)水溶液氨水—(含分子:NH3,H2O,NH3·H2O,含离子:NH4+,OH-,H+)氯水—(含分子:Cl2,H2O,HClO,含离子:H+,Cl-,ClO-,OH-)卤水—常指海水晒盐后的母液或粗盐潮解所得溶液,含NaCl、MgCl2、NaBr等王水—浓硝酸和浓盐酸的混合物(1∶3)生理盐水—0.9%的NaCl溶液(3)其它水银—Hg、水晶--SiO2、水煤气—CO和H2的混合气、水玻璃—Na2SiO3溶液。
高三化学专题(水)

高三化学专题(水)姓名[资料]---水的分类[矿泉水]指的是天然的来自地下深层未经污染的地下水,在特定的环境下经历了漫长的极其复杂的地质化学过程,溶蚀了岩石,富集了某些矿物成份形成的天然溶液,它含有一定质量的矿及微量元素,由人工提取后消毒装瓶,便成了瓶装的矿泉水。
《饮用天然矿泉水标准》规定,其中得游离二氧化碳和矿化度分别不得少于500mg/L,1000mg/L,Li,Sr,Zn,I,Se,Br和偏硅酸在水中的含量必须达到规定的界限值。
它不是以医疗为目的,但对人体有一定的保健作用。
[自来水]自来水取自天然水源(地表水、地下水)经过一系列处理工艺如沉降、胶凝、沙滤、消毒后再输入到各用户。
[磁化水]即把水放到一磁场(如磁化杯)中进行磁化,然后再饮用。
其机理和对人体的作用目前尚不十分清楚,也没有定论,但首先用来磁化的水必须是纯净的。
[矿化水]人为地在水中加入一些对人体有益的矿物质,矿化壶便利用了这种原理。
但是水中的无机物矿物质是难以被人体吸收的,大部分排泄掉了。
所以人为地加入一些矿物质对人体健康不会有什么显著的帮助。
[蒸馏水]蒸馏水是利用蒸馏设备使水汽化后分流再冷却液化而形成的液体,由于经过了分离过称其中的杂质含量甚少。
将水蒸馏可以有效地去除各重金属离子,但对挥发性有毒有机污染物就无能为力,相反还起到了浓缩的作用,同时不能去除异味。
[纯净水]这是利用过滤或吸附等手段,将水中的病菌、有机物、重金属等杂质充分去除了的水。
[太空水]是利用高分子分离膜技术,即逆渗透原理,净化水质而生成的一种净化水。
其生产装置和其它净化装置不同,它不是进多少水,出多少水,由于水中杂质不能通过而截留在半透膜上,约70%~80%左右的进水被排放掉了,真正能透过膜出来的净化水只占净水的20%~30%。
[练习]一、为了区别硫酸溶液和水两种液体,某班学生想出了下列方法,其中不合理的是A 用量筒量取相同体积的两种液体,分别置于两只相同的烧杯中,再放在天平两边,比较质量,质量较大者是硫酸溶液。
水的专业化学名词解释汇总

水的专业化学名词解释汇总水是人类生活中不可或缺的重要物质,我们每天都会接触到它,使用它。
然而,水的化学性质对于一般民众来说可能并不太熟悉。
本文将汇总一些水的专业化学名词的解释,使读者能够更好地理解水的性质。
1. 水的分子结构水的化学式为H2O,它由一个氧原子和两个氢原子组成。
这种结构使得水分子呈现出极性,即氧原子带正电荷,氢原子带负电荷。
极性使得水分子能够与其他极性物质发生相互作用,如溶解离子。
2. 溶解性水是一种极好的溶剂,因为它可以溶解许多种不同的物质。
水的溶解性与其极性有关,极性物质可以通过与水分子的氢键相互作用而溶解。
不易与水溶解的物质通常是非极性的,如油和脂肪。
3. 酸碱性水可以呈现酸性、中性或碱性,这取决于其中所含的酸和碱的浓度。
在水中,氢离子(H+)的浓度越高,其酸性就越强,氢离子浓度越低则碱性越强。
酸碱性用pH指标来表示,pH值小于7表示酸性,等于7表示中性,大于7表示碱性。
4. 电离性水在分子间形成氢键的同时,也会发生自离解,即部分水分子自发地脱离氢原子和氢离子结合,形成了氢离子(H+)和氢氧离子(OH-)。
这种自离解现象使水成为了良好的导电溶液。
5. 水的密度水的密度受温度和压力的影响。
正常条件下,水的密度最大约在4摄氏度,随着温度的升高或降低,水的密度都会减小。
这种性质使得冰浮在水面上,保护了水下生物的生存环境。
6. 蒸发和沸腾水在一定条件下会从液态转变为气态,这个过程称为蒸发。
当水面温度达到100摄氏度时,水会发生沸腾现象,大量的水分子从液态转变为气态。
蒸发和沸腾的现象是水循环和气候形成的基础。
7. 表面张力水分子之间存在着相互吸引力,这种吸引力导致水的表面形成一个类似弹簧膜的薄层,这种现象称为表面张力。
表面张力使水可以形成水滴,使昆虫能够在水面上行走。
8. 冰的晶体结构当水冷却到0摄氏度以下时,水分子开始有序排列,形成冰晶体结构。
水的冰晶体结构使得冰比液态水具有较大的体积,这也是为什么水在结冰时能够破坏容器的原因。
水环境中的化学高考知识点

水环境中的化学高考知识点水是生命之源,对于维持生态平衡和人类健康至关重要。
然而,随着人类活动的不断增加,水环境遭受到了严重污染。
为了更好地保护水环境,了解水环境中的化学知识点尤为重要。
本文将从水的性质、水中的离子、水中的酸碱平衡以及水中的有机污染物等方面,阐述水环境中的化学高考知识点。
水的性质水是一种分子式为H2O的化合物,具有诸多特性。
首先,水的氢键使得水具有高沸点和高比热容,这使得水能稳定地存在于地球表面。
其次,水是一种极性溶剂,能够溶解多种物质,因此被称为“万能溶剂”。
此外,水还具有溶解氧气,维持水体中生物的正常呼吸。
水中的离子水中存在着多种离子,这些离子对于水体的性质、水中生物的生长和环境污染有着重要影响。
常见的水中离子包括钠离子(Na^+)、钙离子(Ca^2+)、氯离子(Cl^-)等。
这些离子的浓度和组合形式在一定程度上决定了水的咸淡和硬度等特性。
水中的酸碱平衡在水体中,酸碱平衡的维持对于水体的生化过程至关重要。
酸碱指的是溶液中呈现酸性(pH小于7)或碱性(pH大于7)的性质。
水体的酸碱平衡主要通过两种化学反应维持:酸性物质和碱性物质的离解产生的氢离子(H^+)和氢氧根离子(OH^-)的平衡。
通过控制水体的酸碱度,可以保持水体的健康状态,防止酸雨等酸碱污染。
水中的有机污染物水中的有机污染物是指由人类活动引入水环境中的化学物质,例如农药、化肥和工业废水中的有机物。
这些有机污染物对水生生物和人类健康产生严重影响。
常见的有机污染物包括苯系物、多环芳烃和挥发性有机物等。
通过合理的水处理技术和监测方法,可以有效减少水环境中的有机污染物,维护水体的健康和生态平衡。
水环境保护与绿色化学为了保护水环境,减少对水的污染,绿色化学成为了一个重要的方向。
绿色化学是指通过设计、生产和使用化学品的方式,减少对环境和健康的负面影响。
在水环境保护中,绿色化学可以通过合成环境友好的化学品、推动可持续发展和循环经济等方式来减少水环境的化学污染。
高三水化学的知识点

高三水化学的知识点水化学是高中化学学科中的一个重要内容,旨在让学生了解和掌握水及其溶液的性质、组成、反应和应用。
在高三阶段,水化学的知识点是学生复习和巩固的重点之一。
本文将从不同的角度介绍高三水化学的知识点,以帮助学生快速回顾和巩固相关的内容。
1. 水的结构和性质水分子由一个氧原子和两个氢原子组成,呈V字形结构。
这种结构使得水分子具有特殊的性质,如极性、溶解性和导电性等。
水的极性使得它能与其他极性物质形成氢键,影响了溶解度和溶解过程。
此外,水还具有比较高的比热容和比热量,使其能够在温度变化时起到温和的调节作用。
2. 水的离子化和电解质水具有一定的电离能力,可以将部分水分子自发地分解为氢离子(H+)和氢氧根离子(OH-)。
这种离子化过程使得水成为电解质,能够导电。
根据电离程度的不同,溶解在水中的物质可以分为强电解质和弱电解质。
3. 酸碱理论和pH值酸是指可以释放H+离子的化合物,碱是指可以释放OH-离子的化合物。
酸碱反应是指酸与碱在适当条件下发生的中和反应。
在水中,水的自离解过程使得酸碱反应成为可能。
pH值是用来表示溶液酸碱程度的指标,其范围是0到14,7表示中性溶液,小于7表示酸性溶液,大于7表示碱性溶液。
4. 水的溶解度和溶解平衡水作为一种溶剂,具有溶解其他物质的能力。
溶解度是指在特定条件下溶液中能溶解的最大溶质的量,受温度、压力和溶质之间相互作用力等因素的影响。
溶解平衡是指在溶解过程中溶解物质的溶解速率和析出速率达到动态平衡的状态。
5. 水的水合反应和水合离子水合反应是指溶质中的离子与水分子之间发生的化学反应。
水合离子是指溶质中的离子与水分子形成的复合物,如氢氧根离子(OH-)和氢氧化镁(Mg(OH)2)等。
水合反应和水合离子的形成对溶液的性质和反应具有重要影响。
6. 水的电化学性质水具有电极化、电解和电离度的特性,这使得它在电化学反应中具有重要作用。
电解是指通过外加电压在溶液中发生化学反应,并伴随着电解质的离子迁移。
化学水的知识点

化学水的知识点一、水的物理性质。
1. 颜色、气味、状态。
- 水在常温常压下是无色、无味、透明的液体。
2. 密度。
- 水的密度在4℃时最大,为1g/cm³。
这一特性使得冰的密度小于水(冰的密度约为0.9g/cm³),所以冰能浮在水面上。
3. 溶解性。
- 水是一种良好的溶剂,能溶解许多物质,如蔗糖、食盐等。
根据物质在水中溶解性的不同,可以将物质分为易溶、可溶、微溶和难溶物质。
二、水的组成。
1. 电解水实验(人教版)- 实验装置:水电解器,其中加入少量氢氧化钠或硫酸溶液以增强导电性。
- 实验现象:通电后,电极上有气泡产生,正极产生的气体能使带火星的木条复燃,证明是氧气;负极产生的气体能燃烧,产生淡蓝色火焰,证明是氢气。
且氢气与氧气的体积比约为2:1。
- 实验结论:水是由氢元素和氧元素组成的。
化学方程式为2H_2O{通电}2H_2↑+O_2↑。
2. 化学式。
- 水的化学式为H_2O,表示一个水分子由两个氢原子和一个氧原子构成。
三、水的化学性质。
1. 水与金属反应。
- 例如水与金属钠反应:2Na + 2H_2O=2NaOH + H_2↑。
现象为钠浮在水面上(钠的密度比水小),熔成一个闪亮的小球(反应放热,钠的熔点低),在水面上四处游动(产生氢气推动),发出“嘶嘶”的响声,溶液变成红色(生成氢氧化钠使酚酞变红)。
2. 水与非金属反应。
- 如碳与水蒸气在高温下反应:C + H_2O(g){高温}CO + H_2,这一反应是制取水煤气的原理。
3. 水与某些氧化物反应。
- 酸性氧化物与水反应:例如CO_2+H_2O = H_2CO_3,SO_2+H_2O =H_2SO_3(亚硫酸)等。
- 碱性氧化物与水反应:如CaO + H_2O = Ca(OH)_2,反应放出大量的热。
四、水的净化。
1. 沉淀。
- 静置沉淀:水中的不溶性固体杂质,由于重力作用会自然沉降到水底。
- 吸附沉淀:加入明矾等絮凝剂,明矾溶于水后生成的胶状物可以吸附水中的悬浮杂质,使之沉降。
