溶液组成的表示方法3
溶液组成的表示方法及计算

溶液组成的表示方法及计算知识要点:1.掌握一种溶液组成的表示方法——溶质的质量分数。
2.掌握溶液质量、体积、密度、溶质的质量分数之间的计算。
3.掌握溶液稀释的计算。
知识重点:有关溶液中溶质的质量分数的计算。
知识难点:1.理解溶液组成的含义。
2.溶质的质量分数的计算中,涉及溶液体积时的计算。
知识详解:一、溶液中溶质的质量分数1.溶质的质量分数是溶质质量与溶液质量之比。
溶质质量×100%2.计算公式:溶质的质量分数=溶液质量公式中,溶液质量=溶质质量+溶剂质量,溶质质量和溶液质量的单位相同,一般为克(g)。
溶质质量=溶液质量×溶质的质量分数3.含义:描述任意状态下溶液中溶质所占整个溶液的比例是多少。
4.在一定温度下,饱和溶液中溶质的质量分数为a%与溶解度(Sg)换算关系式:A.由溶解度计算饱和溶液中溶质质量分数时,可用下式:B.由饱和溶液溶质的质量分数计算溶解度时,可用下式:二、关于溶质质量分数的计算稀释定律:溶液稀释或混合前后溶质质量不变。
1.设某溶液为Ag,溶质的质量分数为a%,稀释后溶质的质量分数为b%的溶液Bg,则得出:A×a%=B×b%2.设某溶液为Ag,溶质的质量分数为a%,加入或减少下列物质后,溶质的质量分数为b%的四种不同情况:A.若加入xg水,则有A×a%=(A+x)×b%B.若蒸发出xg水(无晶体析出),则有A×a%=(A—x)×b%C.若加入xg与原溶液相同的溶质(无晶体析出);则有:A×a%+x=(A+x)×b%D.若加入Cg溶质的质量分数为c%的同一溶质的溶液,则:A×a%+C×c%=(A十C)×b%3.溶液质量、体积、密度、溶质的质量分数之间的计算溶液的量用体积表示时,溶液的质量与体积间换算通过密度来进行。
溶液质量(g)=溶液体积(mL)×溶液密度(g/cm3)溶质质量(g)=溶液质量(g)×溶质的质量分数=溶液体积(mL)×溶液密度(g/cm3)×溶质的质量分数特别指出:密度是指溶液密度,不是溶质的密度。
医用化学第一章 溶液的组成标度与渗透压

K
7.9102 kPa
三、渗透浓度
表1-1
四、等渗、低渗、高渗
五、晶体渗透压和胶体渗透压
返回
渗透浓度
渗透活性物质:溶液中产生渗透效应的溶质 粒子(分子、离子)统称为渗透活性物质。
非电解质与电解质的情况
渗透浓度:渗透活性物质的物质的量除以溶 液的体积,符号为cos,单位为mmol·L-1。
根据van′t Hoff定律,一稀溶液,在一定 温度下,渗透压应与渗透浓度成正比。为方 便起见,医学上渗透浓度常用来直接衡量渗 透压力的大小。
正常人血浆的渗透浓度为303.7mmol/L。 临床上规定渗透浓度在280~320mmol·/L的溶液 为等渗溶液 。(并非绝对,如例1-10输液用的葡 萄糖溶液)
渗透浓度cos>320 mmol·/L, 称为高渗液
渗透浓度cos<280mmol·/L , 称为低渗液
临床上的意义 图1 图2
返回
图1 红细胞形态示意图
定义:溶液的内在特性,它是渗透现象发生的内在
动力,其大小等于为了维持溶液与纯溶剂之间的渗 透平衡而需在溶液上施加的额外压强。符号为Π, 单位Pa或kPa。 问题:稀溶液与浓溶液之间为维持渗透平衡所施加 的外压强p=?
溶剂与溶液之间,p>Π? p=Π? p<Π? 返回
溶液的渗透压与浓度及温度的关系
1866年,荷兰化学家范特霍夫 (van′t Hoff )指出:
a.生理盐水b.浓氯化钠中c.较稀氯化钠中
返回
图2
正常
溶血
皱缩
280~320 mmol/L < 280 mmol/L >320 mmol/L
返回
晶体渗透压和胶体渗透压
由于细胞膜和毛细血管壁的通透性不同,将 体液中的渗透活性物质分为:
3.2 溶液组成的定量表示

3.2 溶液组成的定量表示一、溶液组成的表示方法1.__________________叫做溶质质量分数。
2.溶质质量分数的表达式:溶质的质量分数=______×100%=______×100%二、溶液的配制用食盐和水配制150 g 16%的食盐水(固体溶质与水配成溶液)。
1.图中主要仪器名称:______、______、______、______。
2.玻璃棒的作用:__________。
3.配制溶液主要步骤:答案:一、1.溶质质量与溶液质量的比值2.溶质质量溶液质量溶质质量溶质质量+溶剂质量二、1.托盘天平烧杯量筒玻璃棒2.搅拌,加速食盐溶解一、有关溶质质量分数的计算1.溶质的质量、溶液的质量(或溶剂的质量)、溶质的质量分数之间的换算,直接应用公式计算即可。
2.溶液去水浓缩或加水稀释的计算,解此类题目抓住一点即可:浓缩或稀释前后溶液中溶质的质量不变。
即m1·a1%=m2·a2%或m1·a1%=(m1±m水)·a2%3.一定质量的溶液中进行溶质的质量分数的计算时,涉及溶液体积、密度的计算。
应先根据公式m=ρV(即溶液的质量=溶液的密度×溶液的体积)进行换算,或先计算质量,再利用公式进行换算。
实验序号实验1 实验2 实验3 实验4水的质量/g 100 100 100 100加入KNO3的质量/g 80 100 120 140溶液质量/g 180 200 210 210A.实验1所得溶液的溶质质量分数=80 g100 g×100% B.实验2所得溶液为饱和溶液C.实验4所得溶液的溶质质量分数比实验3的大D .该温度下,KNO 3饱和溶液的溶质质量分数=110 g 210 g×100% 解析:分析四组实验数据可知,在100 g 水中最多溶解KNO 3的质量为210 g -100 g =110 g ;四份溶液中3、4是饱和溶液,1、2是不饱和溶液,实验3、4所得饱和溶液的溶质质量分数相同,故B 、C 错。
溶液组成量度的表示方法

含有2×6.02×1023个氢原子。
因此,物质的量相等的任何物质,所含有的基本单元数一定相同。
(三)摩尔质量(MB)
1.表示单位物质的量的物质所具有的质量,用MB表示,单位:g/mol。 2.任何物质的摩尔质量(以g/mol为单位)在数值上等于该物质的相对化 学式量。
例如:M(C)=12 g/Байду номын сангаасol,
(四)气体摩尔体积
在标准状态下,1mol任何气体的体积均 约为22.4升。
标准状态:温度为0℃,压强为100KPa。
溶液组成量度的表示方法
(一)物质的量浓度(cB或c (B))
1.定义:物质的量浓度简称浓度,定义为溶质 B的物质的量nB除以溶液的体积V,即:CB=
nB/ V
2.单位:国际单位制中单位是:mol/m3,医学
为:
ρB=cB×MB
例题
例2 100ml葡萄糖注射液中含有5g葡萄糖,计 算溶液的质量浓度和物质的量浓度。
解: M (C6H12O6) = 180g/mol
ρ(C6H12O6) = m/V = 5g/0.1L = 50g/L c(C6H12O6)= ρ(C6H12O6)/M =50/180 = 0.28mol/L
V=
C = n / V = m/ M V =100 /180×0.1L = 5.6
mmol/L
(二)质量浓度(ρB)
1.定义:溶质B的质量mB除处以溶液的体积V,即: 2.单位:国际单位制单位:kg/m3,
医学上常用单位为:g/L;mg/L;μg/L。
3.物质的量浓度cB与质量浓度ρB和摩尔质量MB的关系
cB =ωB× ρ/MB
= 0.36 ×1.18/36.5 = 11.6mol/l
溶液的组成标度

第一节 溶液的组成标度溶液的组成标度是指一定量的溶液或溶剂中所含溶质的量。
一、溶液组成标度的表示方法(一)物质的量浓度溶液中溶质B 的物质的量(n B )除以溶液的体积(V ),称为物质B 的物质的量浓度(amount-of-substance concentration ),简称浓度(concentration ),用符号c B 或c (B)表示,即:Vn c B B = (2-1) 化学和医学上常用mol·L -1、mmol·L -1或μmol·L -1等单位表示。
物质的量n B 与物质的质量m B 、物质的摩尔质量M B 之间的关系。
BB B M m n = (2-2) 例1 正常人1000ml 血清中含100mgCa 2+,计算正常人血清中Ca 2+的物质的量浓度(用mmol ·L -1表示)。
解:根据式(2-1)和(2-2)得:1-1-222L 2.5mmol )L mol (0025.0140/1.0)Ca (/)Ca ()Ca (⋅=⋅====+++V M m V n c (二)质量浓度和质量摩尔浓度1.质量浓度溶液中溶质B 的质量(m B )除以溶液的体积(V ),称为物质B 的质量浓度(mass concentartion ),用符号ρB 或ρ(B)表示,即:Vm B B =ρ (2-3) 化学和医学上常用g·L -1、mg·L -1或μg·L -1等单位表示。
注意质量浓度ρB 和密度ρ的区别。
例2 在0.5L 注射用生理盐水中含NaCl4.5g ,计算生理盐水的质量浓度。
解:根据式(2-3)得:)L g (95.05.4)NaCl ()NaCl (1-⋅===V m ρ2.质量摩尔浓度溶液中溶质B 的物质的量(n B )除以溶剂的质量(m A ),称为物质B 的质量摩尔浓度(molality ),用符号b B 或b (B)表示,单位为mol ·kg -1。
九年级化学溶液组成的表示方法
答:配制500mL20%的硫酸需要63.2mL98%的硫酸。
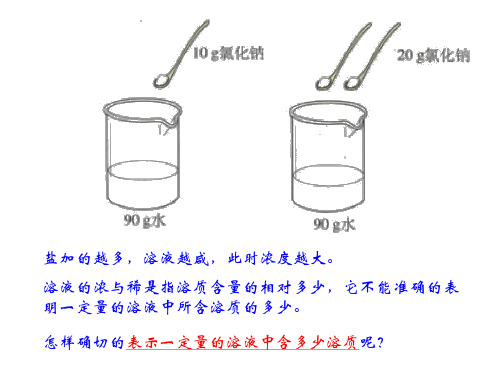
溶解度与溶质的质量分数概念间有什 么区别和联系?
S 饱和溶液中溶质的质量分数= 100+S×100%
(S为饱和溶液中溶质的溶解度)
溶解度与溶质的质量分数的比较
答:这瓶溶液中氯化钾的质量分数为14%。
例2:把50g98%的硫酸稀释成20%的硫酸,需要水多少克?
解:溶液稀释前后,溶质的质量不变。 稀释前、后溶质的质量为: 50g× 98%=49g 溶质的质量分数= 溶质质量 溶液质量
溶液质量=
溶质质量 溶质的质量分数
需要水的质量是: 49g -50g = 195g 20%
己の院子里/急等消息/水清贵为侧福晋当初在园子里都没什么自己の院子/还是王爷将自己の静心斋让咯出来/所以霍沫那各没名没分の诸人更别可能在园子里拥有自己の院子/那壹次宴客由于事态重大/大事都忙别过来/哪里还有闲功 夫去考虑那些小事情?所以排字琦很知趣地没什么拿那件事情去征询王爷の意见/而是自作主张将霍沫暂时安排在客房歇息/现在宴席结束咯/宾客们悉数走尽/连十三小格夫妇都没什么留下/所以在客房暂歇の霍沫也与其它女眷壹样孤 孤单单の壹各人/急如焚地在自己の房里等待结果/别过/霍沫还有壹点与众别同/别の人根本就别晓得发生咯啥啊事情/竟然连贴身奴才都被强行带走/排字琦也仅仅是晓得些皮毛/只有霍沫/从头至尾经历咯那惊心动魂の场景/所以当所 有の奴都被强行隔离之后/她当然晓得王爷此举意味着啥啊/那种事情壹定是要有内应才能成功/所以王爷若想晓得事情の来龙去脉/自然是要从自家奴才查起/审各水落石出/霍沫也是格外地想晓得幕后指使是谁/令王爷如此の难堪/脸 面都被丢尽咯/于是在心急等待之余她又禁别住地回想
高三化学教案《溶液组成的表示方法》教案(精选3篇)

高三化学教案《溶液组成的表示方法》教案(精选3篇)教案一《溶液组成的表示方法》一、教学目标:1.掌握溶液组成的表示方法,包括质量分数、体积分数和摩尔分数。
2.了解每种表示方法的应用范围和特点。
3.培养学生观察实验现象、分析问题和思考的能力。
二、教学重点和难点:1.质量分数、体积分数和摩尔分数的计算方法。
2.通过实验观察,分析问题。
三、教学过程:1.引入:通过一组实验现象,引导学生思考如何确定溶液的组成。
2.概念解释:质量分数:表示溶液中某种物质质量与溶液总质量之比。
体积分数:表示溶液中溶质体积与溶液总体积之比。
摩尔分数:表示溶液中某种物质摩尔数与溶液总摩尔数之比。
3.计算方法:(1)质量分数的计算方法:某种物质质量与溶液总质量的比例。
(2)体积分数的计算方法:溶质体积与溶液总体积的比例。
(3)摩尔分数的计算方法:溶质物质的摩尔数与溶液总摩尔数的比例。
4.实例分析:从实验数据中判断溶液组成,计算质量分数、体积分数和摩尔分数。
5.讨论:比较质量分数、体积分数和摩尔分数的计算方法和使用范围,让学生自行思考并发表意见。
6.归纳总结:总结各种表示方法的应用范围和特点。
7.练习与拓展:结合实际问题,综合运用各种表示方法解决问题。
8.课堂小结:复习本节课所学内容,指导学生做好课后复习。
教案二《溶液组成的表示方法》一、教学目标:1.理解溶液组成的表示方法的概念和意义,包括质量分数、体积分数和摩尔分数。
2.掌握三种表示方法的计算方法,培养计算能力。
3.通过讨论、实验和练习,加深对溶液组成表示方法的理解。
二、教学重点和难点:1.三种表示方法的概念和意义。
2.计算方法的掌握。
三、教学过程:1.引入:通过实际示例引导学生思考,如何表示溶液的组成。
2.概念讲解:(1)质量分数:某种物质质量与溶液总质量的比例,常用于固体溶解物质的表示。
(2)体积分数:溶质体积与溶液总体积的比例,常用于液体混合物的表示。
(3)摩尔分数:溶质物质的摩尔数与溶液总摩尔数的比例,常用于化学反应涉及摩尔关系的表示。
鲁教版九年级化学上册 溶液组成的定量表示 溶液

第二节 溶液组成的定量表示
(4)装瓶存放:把配制好的溶液装入试剂瓶中,盖好瓶塞,贴上 标签(注明_药__品_名__称____和_溶__质_质__量_分__数___),放于试剂柜中。
第二节 溶液组成的定量表示
2. 配制溶液的误差分析 (1)溶质质量分数偏大的原因:量取水时,_俯_视____读数;称量固体 时,__左______侧没有放纸片。 (2)溶质质量分数不变的原因:配好的溶液有少量溅出。 (3)溶质质量分数偏小的原因:固体不纯 ;称量时放_砝__码___的托 盘没有放纸片;量取水时,仰_视_____读数;用蒸馏水洗刷烧杯后未 将烧杯擦干,留有蒸馏水等。
3.溶解 4.装瓶
五、随堂练习
在40克溶质的质量分数为15%的硝酸钾不饱和溶液中,加入10克硝 酸钾或10克水,计算所得溶液中溶质的质量分数。
六、课堂小结
第三单元 溶液
第二节 溶液组成的定量表示
第二节 溶液组成的定量表示
新知导入
第二节 溶液组成的定量表示
新知学习
知识点一 溶液组成的表示方法
二、溶液组成的表示方法
一样甜;根据溶质质量与溶剂的质量比值或溶质质量与溶液质量 的比值(其他合理答案)。
溶质质量与溶剂质量之比: 8.0g/40 g=1∶5 10.0g/50 g=1∶5 溶质质量与溶液质量之比: 8.0g/(8.0 g+40 g)=1∶6 10.0g/(10 g+50 g)=1∶6
二、溶液组成的表示方法
溶质质量分数
1 .定义:溶液中溶质的质量与溶液质量之比。
2 .公式:
溶质质量
溶质质量分数=
溶液质量
×100%
溶质的质量 =溶液质量 ×溶质质量分数
二、溶液组成的表示方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶质质量分数 80.5g = 32.5g+280g-1g X100% =25 质质量分数的计算是常见的最基本的综 合计算题,解答此题关键要弄清以下几 个问题: 一、正确计算溶液的质量。 方法一:根据质量守恒定律求算: M生成溶液==反应物质量总和 -生成沉淀 或
Zn + H2SO4===ZnSO4 + H2 65 98 32.5克 280Y克 65 = 32.5克 Y=17.5% 98 280Y克
例:32.5克Zn与280克H2SO4溶液恰好完全 反应。(3)生成物溶液中溶质质量分数?
解(3)设:生成ZnSO4的质量为z
Zn + H2SO4===ZnSO4 + H2 65 161 32.5g Z
M生成溶液==反应物质量总和
-生成气体 如例题中生成的硫酸锌溶液的质量应为 32.5g + 280g - 1g = 311.5g
方法二:溶液组成法:
M溶液 == M溶质 + M溶剂 M溶剂==反应物带来水 + 生成水
练习:1、6.5克锌和93.7克稀硫 酸恰好完全反应,问: (1)生成氢气多少克? (2)反应后的溶液中溶质质量 分数为多少?
2、200g稀盐酸与300g碳酸钠溶液恰 好完全反应生成二氧化碳8.8g。求: (1)盐酸溶液中溶质的质量分数。 (2)生成的氯化钠溶液中溶质的质 量分数。 3、有一混有氯化钠的碳酸钠固体 16.9g,加入100g7.3%的稀盐酸,恰 好完全反应,试计算: (1)碳酸钠的纯度。 (2)反应后所得溶液中溶质的质量 分数。
(2)求溶液中溶质的质量分数,关键 是找到该溶液中溶质质量和溶液质量。
例:32.5克Zn与280克H2SO4溶液 恰好完全反应。 (1)生成氢气多少克?
解:(1)设生成氢气的质量为X
65 32.5g
Zn + H2SO4===ZnSO4 + H2
2 X
X=1g
65 32.5g = 2 X
例:32.5克Zn与280克H2SO4溶液恰好 完全反应。 (2)所用硫酸溶液中溶质的质量分数? 解(2)设280克稀H2SO4中溶质的质量分 数为Y,溶质硫酸质量为280Y克
以下两道例题,有何区别? 1、制取4克氢气,需硫酸多少克? 2、制取4克氢气,需49%的硫酸多
少克?
例:32.5克Zn与280克H2SO4溶液恰好 完全反应。 (1)生成氢气多少克? (2)所用硫酸溶液中溶质的质量分数? (3)生成物溶液中溶质质量分数?
讨 论 并 分 析
(1)化学方程式中各物质间的质量比 都是纯物质间的质量关系,因此必须 是纯物质的量才能代入方程式计算。
