7有机化学-第七章醇、硫醇、酚
¥07醇、硫醇、酚

醇分子间形成的氢键
水分子间的氢键
氢键对醇溶解度及沸点的影响
对溶解度影响 醇羟基与水分子之间形成 氢键,使醇的溶解度增大。低级醇能与水互 溶,但随着烃基增大,氢键对溶解度影响也 相应下降。 对沸点影响 液态醇羟基之间可通过氢键 缔合,使变成气态时需多提供断裂氢键的能 量,故醇的沸点比相应分子质量的烷烃高。
乙醇 ethyl alcohol
CH2OH
异丙醇 isopropyl alcohol
苄醇(苯甲醇) benzyl alcohol
OH
⑵系统命名法 规则: ①主链:含羟基及不饱和键的最长 碳链; ②编号:从靠近羟基端编起,且序 号和最小; ③命名:标出取代基位次、数目及 名称等,称某醇。
例如:
CH3CH CHCH2OH CH3 CH3
(三)醇的化学性质 1、与活泼金属的反应
CH3CH2OH Na CH3CH2ONa 1 H 2 2 NaOH
CH3CH2ONa
H2O
CH3CH2OH
酸性:H2O > ROH > RC≡CH > NH3 > RH 碱性:R- > NH2- > RC≡C- > RO- > OH醇钠碱性:叔醇钠 > 仲醇钠> 伯醇钠
6 Ar OH FeCl3 H3 [ Fe(OAr)6 ] 3 HCl
(蓝紫色)
凡是分子中具有烯醇式结构或通 过分子内的互变异构作用能产生烯醇 式结构的化合物,遇见三氯化铁溶液 都能显色。
OH C C
OH
4、氧化反应
OH K2Cr2O7 H2SO4 O O
对苯醌 p-benzeoquinone
HO OH Na2Cr2O7 H2SO4 O O
OH
CH3
o-甲苯酚
m-甲苯酚
有机化学—醇的合成

有机化学——醇的合成前言有机化学主要是介绍化学物质的科学。
目前有机化学物质的分类主要是按照其决定性作用,能代表化学物质的基团也就是官能团的不同来进行分类的。
可分为:烷烃,烯烃,炔烃,芳香烃(以上为烃类);卤代烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物,胺类,硝基化合物,腈类,含硫有机化合物(如硫醇,硫醚,硫酚,磺酸,砜与亚砜等),含磷有机化合物等元素有机化合物,杂环化合物等。
具体主要是介绍这些化学物质的系统命名,化学反应,反应机理,制备方法。
其中化学反应基本上为基团的取代,能否进行一个反应,取决于热力学和动力学两个方面的因素。
而制备方法主要是通过无机物,石油提取物,以及容易制备或成本低的物质制得难以得到的物质。
反应机理也为基团之间的进攻和离去倾向之间的竞争。
有机合成方面主要研究比较简单的化合物或元素经化学反应合成有机化合物。
19世纪30年代合成了尿素;40年代合成了乙酸。
随后陆续合成了葡萄糖酸、柠檬酸、琥珀酸、苹果酸等一系列有机酸;19世纪后半叶合成了多种染料;20世纪40年代合成了DDT和有机磷杀虫剂、有机硫杀菌剂、除草剂等农药;20世纪初,合成了606药剂,30~40年代,合成了一千多种磺胺类化合物,其中有些可用作药物。
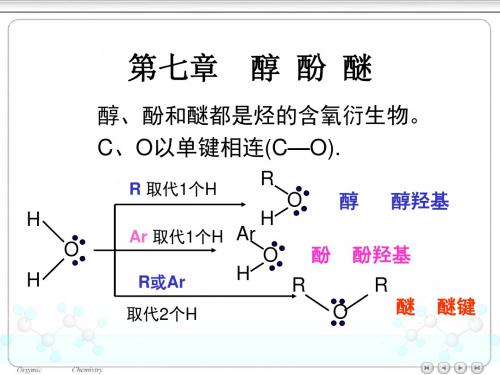
醇醇是脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基所取代后的化合物,羟基(—OH)是醇的官能团。
一、醇的分类、命名和结构(1)醇的分类根据醇分子中所含羟基的数目,可以分为一元醇、二元醇及三元醇等,同时二元醇以上的醇称为多元醇;在一元醇分子中,根据羟基所连接的碳原子的不同级数,可分为一级醇(伯醇)、二级醇(仲醇)和三级醇(叔醇);根据醇分子中烃基的类别,又可分为脂肪醇、脂环醇,或饱和醇、不饱和醇。
伯醇(RCH2OH): CH3CH2OH仲醇(R2CHOH):(CH3)2CHOH叔醇(R3 COH): (CH3)3C-OH注:羟基和碳碳双键直接相连的醇叫烯醇。
在一般情况下,烯醇式互变—烯醇是不稳定,容易互变成为比较稳定的醛或酮。
有机化学课后习题答案(张凤秀主编)

第1章 习题答案1. 1. 指出下列化合物中每个碳原子的杂化轨道类型:(1)均为sp 3 杂化。
(2)(3)(4)(5)(6)2. 指出下列分子或离子哪些是路易斯酸?哪些是路易斯碱?(1)路易斯碱; (2)路易斯酸; (3)路易斯碱; (4)路易斯碱; (5)路易斯碱; (6)路易斯酸; (7)路易斯碱; (8)路易斯酸; (9)路易斯酸; (10)路易斯酸; (11)路易斯碱; (12)路易斯酸3. 指出下列化合物中官能团的名称及所属化合物的类别:(1)卤素,卤代烃; (2)醚键,醚; (3)羟基,醇; (4)醛基,醛 (5)双键,烯烃; (6)氨基,胺; (7)羧基,羧酸; (8)酯基,酯 (9)酐键,酸酐; (10)酰胺基,酰胺 (11)三键,炔 (12)羟基,酚 4. 下列化合物哪些易溶于水?哪些易溶于有机溶剂? 易溶于水的有(1)、(3)、(4)、(5)、(6);易溶于有机溶剂的有:(1)、(2)、(3)、(4)、(5)。
5求该化合物的实验式和分子式。
该化合物的实验式为:CH 2O ,分子式为C 2H 4O 2、第2章 饱和烃习题答案1.用系统命名法命名下列化合物:(1)2-甲基戊烷 (2)2,2,4-三甲基-3-乙基戊烷 (3)2,2-二甲基己烷 (4)2-甲基-5-乙基庚烷 (5)反-1-氯-2-溴环丁烷 (6)反-1,2-二甲基环戊烷 (7)9-甲基-2-乙基二环[3.3.1]壬烷 (8)3,5-二甲基螺[3.4]辛烷 2.写出下列化合物的结构式:CH 3CHCH 2CH 2CH 33CH 3CH 2CHCHCH 2CH 2CH 3CH 32H 5(1)(2)CH CH 3CH 3C CH CH 32H 5CH 3CH 3(3)(4)(5)HCH 3HC(CH 3)3(6)sp 2CH 2C 3O 232杂化3杂化sp 杂化杂化33杂化32杂化sp 332CH 2CH 3C CH (CH 2)3CH 33CH 3CH CH 2CH 3CH 3CH 3C CH CH 3CH 3(CH 2)4CH 33)2(7)(8)(9)(10)2H 53.写出分子式为C 6H 14 烷烃的各种异构体,并正确命名。
硫醇的氧化反应

四、甲醇、乙醇的功能和毒性 甲醇为无色透明液体,能与水和大多数有机溶剂混溶,是实验室常用的 溶剂,也是一种重要的化工原料。甲醇的主要用途是作为溶剂,有酒的 气味,但毒性很强,若长期接触甲醇蒸气,可使视力下降;若内服少量 (10m1)可致人失明,多量(30m1)可致死。 乙醇是酒的主要成分,70%乙醇称为酒精。目前更好的方法是利用石油 裂解气中的乙烯进行加水反应制得。
在同样条件下,叔醇主要发生分子内脱水成烯。一般不能直接形成醚。
(四) 氧化反应
有机反应中,通常把脱去氢原子或加上氧原子的反应看成是氧化反应 (oxidation),把加上氢原子或脱去氧原子的反应看成是还原反应(reduction)。 醇类化合物的氧化,实质上是从分子中脱去两个氢原子,其中一个是 羟基上的氢,另一个是与羟基相连碳上的氢(α-H)。反应的产物取决于 醇的类型和反应条件。 伯醇可失去1个α-H而生成醛,醛继续氧化生成羧酸。
重排机制:
CH3 甲基1,2迁移 重排 H3C C C CH3 -H H3C C H3C C
CH3 CH3
CH3 H
再例如:2,3-二甲基-1-丁醇在硫酸和140℃的条件下生成2,3-二甲基-2-丁烯。
重排机制:
已知正碳离子的稳定性次序为:叔碳>仲碳>伯碳,故不同脂肪醇脱水 活性的顺序为:叔醇>仲醇>伯醇。同时醇的分子内脱水成烯的反应也 遵循Saytzeff规律,即主要产物是双键上连有最多烃基的烯烃。
CH3CH2OH
[O]
CH3CHO
[O]
CH3COOH
仲醇失去一个α-H 生成酮,通常酮不会被继续氧化为酸。
OH CH3CHCH3 [O] CH3CCH3 O
叔醇没有α-氢,一般不能被氧化。
[O]代表氧化剂,常用的氧化剂有K2Cr2O7的酸性水溶液、KMnO4溶液等。 伯醇氧化的最终产物为酸,仲醇氧化的产物为酮,叔醇一般不能被氧化。 反应物和产物都是无色的,氧化反应使K2Cr2O7的酸性水溶液由橙红色 变成绿色、KMnO4溶液由紫色变成棕色沉淀。利用此实验现象区别伯、 仲与叔醇。 伯醇的氧化产物与所用的氧化剂和反应条件有关。用KMnO4或K2Cr2O7 为氧化剂时,反应很难停留在生成醛的一步,醛还会被继续氧化,产物 主要是羧酸。
有机化学——第7章醇酚醚

25
6、氧化脱氢反应
在有机化合物的分子中加入氧或脱去氢的反应都叫做氧化反应。
1) 伯醇氧化生成醛,醛进一步氧化生成酸。
CH3 CH2 CH2OH
K2CrO7-H2SO4
CH3 CH2CHO
[O]
CH3 CH2 COOH
2) 仲醇氧化生成酮,酮不易被继续氧化 。
H3 C CH OH CH3 [O] CH3 C O CH3
烯丙位 苯甲位 一级醇
}
醛
弱碱,反应条件温和, 不饱和键不受影响。
琼斯试剂 CrO3+稀H2SO4
费慈纳-莫法特试剂
醛(产率不高, 不用。)
醛(产率很高)
稀酸,反应条件温和, 不饱和键不受影响。 酸性 (H3PO4) , 其它基团不受影响。 碱性,可逆,分子内 双键不受影响。 28
反应机理 1oROH (SN2)
SN2
SN2
BrCH2CH3 +
2oROH , 3oROH (SN1)
SN2
SN1
(CH3)3C+ + HOPBr2
Br -
(CH3)3CBr
18
ROH + SOCl2
b.p. 79oC
RCl + SO2 + HCl
该反应的特点是:反应条件温 和,反应速率快,产率高,没 有副产物。
13
2、与氢卤酸反应
发生亲核取代反应,生成卤代烃和水,是制取卤代烃的重要方法。
R OH + HX
R X + H2O
氢卤酸的活性次序:HI > HBr > HCl; 醇的活性次序:烯丙式醇,苄基醇 > 3º 醇 > 2º 醇 > 1º 醇。 烯丙醇、叔醇、大多数仲醇及空间位阻大的伯醇,反应是按SN1
有机化学~7醇、酚、醚
加入苯,蒸出水和苯的共沸物,
除去水,使平衡向右移动。
醇还可以与其它酰基化试剂发生酯化反应:
O ROH + R'C Cl O R'C OR
酰氯
O O ROH + R'C OCR' O R'C OR
吡啶
缚酸 剂
N
酸酐
吡啶可与生成的HCl作用,有利反应进行。
6. 脱水反应
(1) 分子间脱水 两分子醇在酸催化下,分子间脱水,生成醚
OH
CO2H
邻-羟基苯甲酸
HO
SO3H
4-羟基苯磺酸
二 元 酚
OH OH
HO
邻-苯二酚(儿茶酚) 1,2-苯二酚
OH
OH CH3
(CH2)5CH3
4-己基-1,3-苯二酚
OH
2,5-二羟基甲苯 2-甲基-1,4-苯二酚
三 元 酚
HO
OH OH 含两个或 两个以上酚羟基 的都属于多元酚。
1,2,3-苯三酚 (连苯三酚)麦食子酚
CH-OH CH2-
3-丁基-1-苯基4-己烯-2-醇
***多元醇的命名:“某二醇、某三醇”等。-OH 数目与主链碳原子数相同时,可不标出羟基位次。
CH2—CH2—CH2 OH OH
1,3-丙二醇 CH2OH HOCH2CH2CHCH2CH2CH2CH2OH 3-羟甲基-1,7-庚二醇
OH OH 顺-1,2-环戊二醇
7.2.2 酚的结构
sp2 H . O
1.6D
.
p-共轭 ①苯环上电子云密度增加; ②酚羟基氢的离解能力增强。
结构与性质的关系: 1. C—O键具有部分双键的性质,较难断裂; 2. O—H键极性增加,酚羟基具有酸性; 3. O上p电子向苯环转移,使苯环电子密度增高, 易发生亲电取代;并比醇易于氧化。
醇、硫醇、酚

CH CH CHO
• 欧芬脑尔(Oppenauer)氧化法:在异 丙醇铝或叔丁醇铝存在下,将仲醇和丙 酮一起反应,醇被氧化成酮,丙酮被还 原成异丙醇的反应。
O R2C HO H+ C H3C C H 3 Al[O C H (C H 3)2]3 O RC R + OH C H3C HC H 3
•在实际工作中,三卤化磷常用红磷与溴或 碘作用产生。如:
CH3CH2OH
P + I2
CH3CH2I
• 醇与PX5也可发生类似的反应,但与PX5 反应时,副产物较多,所以,这不是制 备卤代烃的好方法。
ROH + PCl5 ROH + POCl3 RCl + POCl3 + HCl (RO)3PO + 3HCl 磷酸酯
OH Na2Cr2O7 H2SO 4/
CH3 KMnO4/H H3C C OH CH3
O KMnO4/H CH2CH2COOH CH2CH2COOH
C H3C CH2 KMnO4/H C H C O + CO + H O 3 2 2 CH3 CH
3
(2)用温和的氧化剂氧化(选择性氧化):
沙瑞特(Sarrett)试剂:CrO3/C5H5N 琼斯(Jones)试剂: CrO3/稀H2SO4 活性二氧化锰。
(二)二元醇的反应
1、脱水反应 邻二醇分子内脱水:生成不稳定的烯醇, 再重排成醛或酮 分子间脱水:共轭二烯烃、环醚
2、pinacol重排
CH3 CH3 H3C C C CH3 H2SO4 CH3 H3C C C CH3
OH OH
CH3 O
H+
有机化学课件——Chapter 07 醇、酚、醚

有机化学课件
32
第七章 醇、酚、醚
3. 醇的脱水反应
在浓硫酸催化下,醇通常发生脱水反应得到烯烃或醚. 反应涉及碳正离子中间体. 如果产物为烯烃则遵从Saytzeff规则. 较低温度下反应主要发生分子间脱水成醚, 通常低于140oC . 较高温度下主要发生分子内脱水成烯烃的反应, 通常高于 180oC.
有机化学课件 26 第七章 醇、酚、醚
醇和氢卤酸反应的局限性在于: 所期待的卤代烃不是总能 高收率地得到, 具体表现为四个方面. ① 大多数醇不能和HI反应得到碘代烷烃; ② 1o和2o醇制备氯代烷收率很低; ③ 总是有消除反应产物(烯烃)生成; ④ 碳正离子中间体经常发生重排,得到重排产物.
有机化学课件
OH CH2CH2CH2COOH
有机化学课件 5 第七章 醇、酚、醚
三、醇的物理性质
Unusually high boiling points due to hydrogen bonding between molecules. Small alcohols are miscible in water, but solubility decreases as the size of the alkyl group increases.
有机化学课件
17
第七章 醇、酚、醚
1º, 2º, 3º碳的氧化还原程度
氧化: 分子中C-H 变成C-O. 还原: 分子中C-O 变成C-H.
有机化学课件
18
第七章 醇、酚、醚
1) 仲醇的氧化
许多氧化剂都可以将2o醇氧化为酮. 常用氧化剂如: Na2Cr2O7/H2SO4 H2CrO4 可能是氧化反应的活性物种. 氧化反应伴随明显的颜色变化: 反应溶液由橙色(Cr6+) 变为深蓝色(Cr3+).
