药品不良反应事件记录登记表及汇总表
药品不良反应报告表 填写示例及填写说明

药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□药品不良反应/ 事件报告表示例首次报告□跟踪报告□编码:1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显着的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。
如果选择“有”,则在报告的空白处清晰叙述。
药品不良反应记录表

通用名称(含剂型,监测期内品种用*注明)
生产厂家
批号
用法用量
用药起止时间(日期、时分)
国内外有无类似不良反应(包括文献报道)
怀
疑
药
品
并
用
药
品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:导致死亡□
药品不良反应记录表
药品不良反应 / 事 件记 录 表编号:
患者姓名:
性别:பைடு நூலகம்□女□
出生日期:年月日
民族
体重(kg)
联系方式
家族药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
年月日
原患疾病:
不良反应/事件过程描述(包括症状、体征、临床检验等)
不良反应/事件及分类判定
不良反应 □ ( 新的□严重□ 一般□) 不良事件 □
不良反应关联性评价
肯定□很可能□可能□可能无关□待评价□无法评价□
备注
部门:报告人:电话:
记录日期:年月日
药品不良反应记录表

不良反应□(新的□严重□一般□)不良事件□
不良反应关联性评价
肯定□很可能□可能□可能无关□待评价□无法评价□
备注
部门:报告人:电话:
记录日期:年月日
不良反应/事件处理情况(对病人的诊治情况):
通用名称(含剂型,监测期内品种用*注明)
生产厂家
批号
用法用量
用药起止时间(日期、时分)
国内外有无类似不良反应(包括文献报道)
怀
疑
药
品
并
用
药
品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:导致死亡□
药品不良反应记录表
药品不良反应/事件记录表编号:
患者姓名:
性别:男□女□
出生日期:年月日
民族
体重(kg)
联系方式
家族药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
年月日
原患疾病:
不良反应/事件过程描述(包括症状、体征、临床检验等)
药品不良反应记录表

药品不良反应/ 事件记录表编号:
患者姓名:性别:男□女□出生日期:年月日民族体重(kg)联系方式
家族药品不良反应/事件:有□无□不详□既往药品不良反应/事件情况:有□无□不详□
不良反应/事件名称:不良反应/事件发生时间:
年月日
原患疾病:
不良反应/事件过程描述(包括症状、体征、临床检验等)不良反应/事件处理情况(对病人的诊治情况):
通用名称(含剂型,监测期内品种用*注明)生产厂家批号用法用量
用药起止时间
(日期、时分)
国内外有无类似不良
反应(包括文献报道)
怀
疑
药
品
并
用
药
品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:导致死亡□不良反应/事件
及分类判定
不良反应□(新的□严重□一般□)不良事件□
不良反应关联
性评价
肯定□很可能□可能□可能无关□待评价□无法评价□
备注
部门:报告人:电话:
记录日期:年月日。
药品不良反应表格填写说明

药品不良反应表格填写说明《药品不良反应报告和监测管理办法》(以下简称《办法》)中针对不同报告类型提供了三份表格,分别是《药品不良反应/事件报告表》、《药品群体不良反应/事件报告表》和《药品不良反应/事件定期汇总表》。
下面将分别对三份表格中涉及医疗机构的《药品不良反应/事件报告表》、《药品群体不良反应/事件报告表》填写要求进行详细的说明。
(一)《药品不良反应/事件报告表》《办法》第十三条明确规定:药品生产、经营企业和医疗卫生机构必须指定专(兼)职人员负责本单位生产、经营、使用药品的不良反应报告和监测工作,发现可能与用药有关的不良反应应详细记录、调查、分析、评价、处理,并填写《药品不良反应/事件报告表》,每季度集中向所在地的省、自治区、直辖市药品不良反应监测中心报告,其中新的或严重的药品不良反应应于发现之日起15日内报告,死亡病例须及时报告。
1、填写注意事项(1)《办法》第十四条规定:《药品不良反应/事件报告表》的填报内容应真实、完整、准确。
(2)《药品不良反应/事件报告表》是药品安全性监测工作的重要档案资料,手工报表需要长期保存,因此需用钢笔、签字笔书写,填写内容、签署意见(包括有关人员的签字)字迹要清楚,不得用报告表中未规定的符号、代号、不通用的缩写形式和花体式签名。
其中选择项画“√”,叙述项应准确、完整、简明,不得有缺漏项。
(3)每一个病人填写一张报告表。
(4)个人报告建议由专业人员填写,可以是诊治医务人员、药品生产、经营企业专(兼)职人员及专业监测机构人员。
(5)尽可能详细地填写报告表中所要求的项目。
有些内容无法获得时,填写“不详。
(6)对于报告表中的描述性内容,如果报告表提供的空间不够,可另附A4纸说明。
在纸的顶部注明“附件”,所有的附件应按顺序标明页码,附件中必须指出描述项目的名称。
(7)补充报告:如需作补充报告时,请注意与原报表编号保持一致,并在报告左上方注明“补充报告”,与原报表重复的部分可不必再填写。
药品不良反应报告表填写示例及填写说明
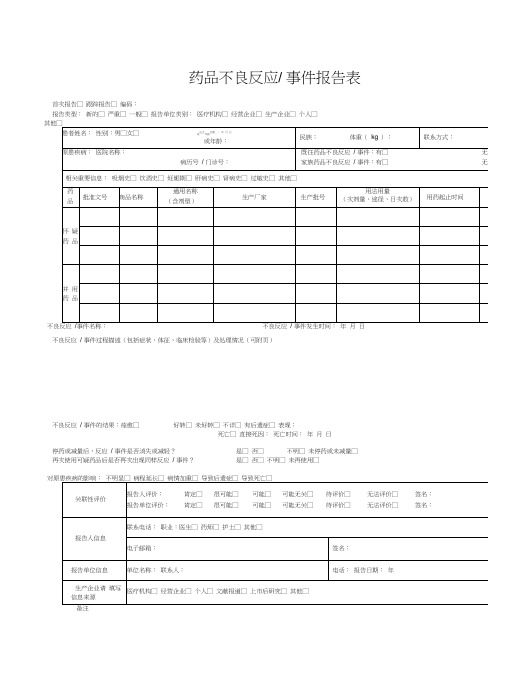
药品不良反应/ 事件报告表首次报告□ 跟踪报告□ 编码:报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□不良反应事件名称:不良反应事件发生时间:年月日不良反应/ 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)不良反应/ 事件的结果:痊愈□好转□ 未好转□ 不详□ 有后遗症□ 表现:死亡□ 直接死因:死亡时间:年月日停药或减量后,反应/ 事件是否消失或减轻?是□ 否□不明□ 未停药或未减量□再次使用可疑药品后是否再次出现同样反应/ 事件?是□ 否□ 不明□ 未再使用□电子邮箱: 签名:×××药 品 不 良 反 应 / 事 件 报 告 表示例不良反应 / 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页) 一般格式为:患者因×××疾病于×××月×××日(必要时应详细到×××时分)以×××途径给予×××药品,×××剂量,用药×× ×时间出现×××反应(反应描述须明确、具体) ,×××时间后给予是否停药及×××处理(包括以×××途径给予×××药品及×××剂 和其他处理措施) ,处理后×××时间患者转归情况。
对原患疾病的影响: 不明显□ 病程延长□ 病情加重□ 导致后遗症□ 导致死亡□报告人评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:××× 报告单位评价:肯定□很可能□可能□可能无关□待评价□无法评价□签名:×××报告人信息患者姓名:×××性别:男□女□出生日期: 年 月 日 或年龄: ××民族:××体重( kg ):××联系方式:××××××原患疾病:指患者此次入 诊的主要疾病(如果有多 疾病可以补充在相关重要 是备注里面),不能写字院或就 种慢性信息或 母缩写。
药品不良反应报告表、填写示例及填写说明
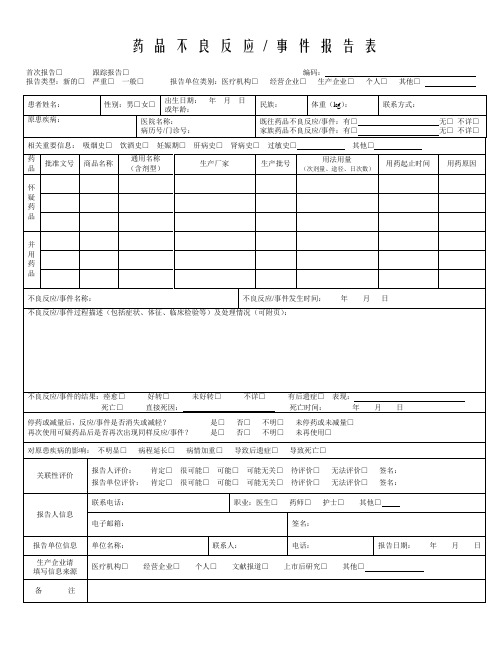
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应/ 事件报告表示例首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□《药品不良反应/事件报告表》填写说明1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
药品不良反应事件报告表及填写说明
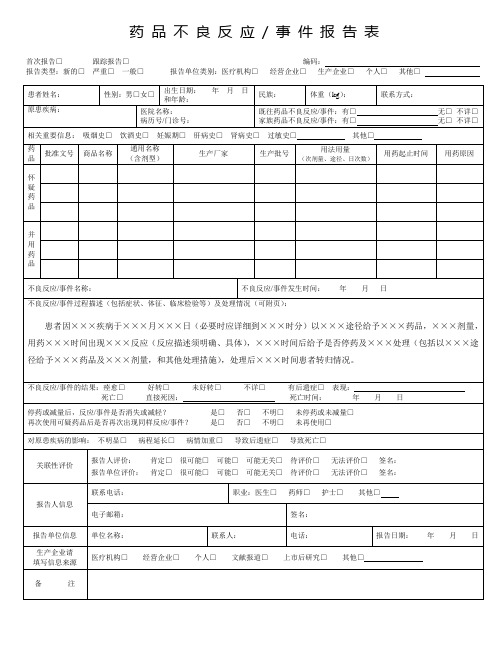
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□《药品不良反应/事件报告表》填写说明1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。
如果选择“有”,则在报告的空白处清晰叙述。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年月日
生产企业请
填写信息来源
医疗机构□经营企业□个人□文献报道□上市后研究□其他□
药品不良反应事件定期汇总表
汇总时间
年月至年月
企业名称
传真
企业地址
邮编
联系人
电话
商品名
通用名(含剂型)
注册时间
再注册时间
批准文号
国家基本药物□国家医疗保险药品□
国家非处方药□中药保护品种□
本期产量
本期销量
预计使用人数
药品成分或处方变更情况
详细情况(变化成分及原辅料名称、剂量、变更依据等):
执行标准(附质量标准一份)
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
批准文号
商品名称
通用名称
(含剂型)
径、日次数)
用药起止时间
用药原因
不良反应/事件名称:
不良反应/事件发生时间:年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页2000字之内):
频数
信息来源
临床(例)
个人(例)
文献(例)
研究(例)
其他(例)
出现药品不良反应/事件总人数:
药品不良反应查处记录
产品名称
产品批号
规格
数量
涉及批号
涉及数量
不良反应情况
报告人:年月日
调查情况
调查人:年月日
处理意见
质量部负责人:年月日
审批意见
审批人:年月日
药品不良反应事件报告表
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
是否在监测期内(进口药是否为首次获准进口5年内):是□否□
境外情况(国产药提供出口及国外使用情况/进口药提供国外使用情况)
相关研究(文献、综述、研究报告)
药品不良反应/事件发生情况:有□无□
报告人:报告日期:年月日
药品生产企业(签章):省ADR中心(签章):
药品不良反应/事件发生情况
不良反应/事件名称
【填写要求】:血常规、肝功、肾功、血脂分析、生命体征、血气。
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
备注
患者姓名:
性别:男□女□
出生日期:年月
年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
既往药品不良反应/事件:有□无□不详□
家族药品不良反 应/事件:有□无□不详□
相关重要信息:吸烟史□饮酒史□妊娠期□肝病史□肾病史□过敏史□其他□
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
