实验四 磺基水杨酸合铁配合物的组成及稳定常数的测定
实验目的磺基水杨酸与三价铁离子配合物的组成及稳定常数的测定

分光光度计的使用注意事项: (1) 比色皿的清洁程度,直接影响实验结果。因此,
特别要将比色皿清洗干净。装样前处理:自来水反复冲 洗→蒸馏水漂洗2次→待装溶液漂洗2次。必要时,需用 浓硝酸或铬酸洗液短时间浸泡。 用完后用自来水和蒸馏 水洗净并用檫镜纸檫干放回比色皿盒中。
28
(2) 拿放比色皿时,应持其“毛面”,不要接触“光面”。
35
实验总结
• 若测得的1#、11#溶液的吸光度不为零,作图 时如何处理?
• 从理论上说,只有Fe3+或只有磺基水杨酸的 溶液中,由于没有配合物生成,吸光度应该 与蒸馏水一样为零
• 作图时按零处理
36
实验总结
• 经文献查阅, Fe3+与磺基水杨酸形成的1:1 型配合物的稳定常数为1014.64,而根据实验 数据计算出的稳定常数与该值相差悬殊, 原因是什么?
样品液3 样品液2 样品液1 参比液
25
将参比液拉入光路中,按 “100%T”键调T为100%,此 时仪器显示“BLA”,表示仪器 正在自动校正,校正完毕后显 示“100.0”。
“100%T”键
26
⑥ 样品测定: 将MODE转换为“ABSORBANCE”,显色屏读数为
0.000,然后将样品液分别拉入光路中,此时显示测 得的样品吸光度。
22
③ 波长选择:用波长调节旋钮设置所需的波长
23
④ 调零
光路断开或照射在纯黑体上时进行调零
打开样品室盖,在T方式下按“0%”键,此时仪器
自动校正后显示“0.000”。
T模式
“0%”键
24
⑤ 调满 在比色皿槽中,依次放入参比液,样品液1和样品
液2等,盖上样品室盖(注意透光截面垂直于光路方向)。
光度法对磺基水杨酸铁配合物的组成及稳定常数的实验研究
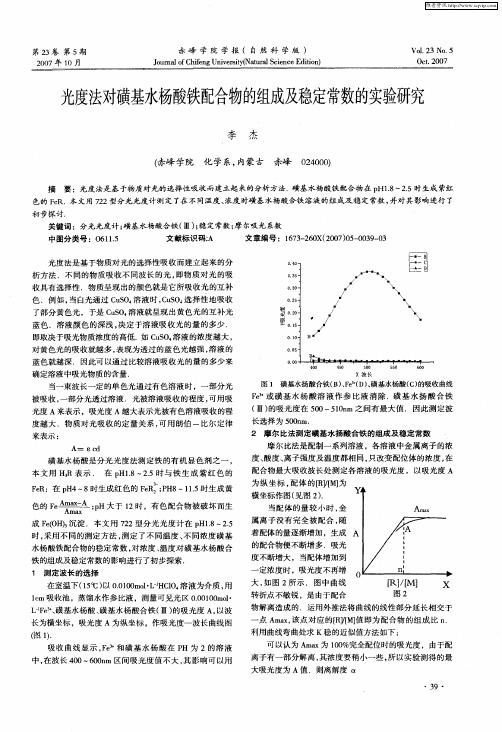
磺基水杨 酸是分光光 度法测定 铁 的有 机显色 剂之一 ,
本文 用 HR表示 . 在 p . . 与铁 生 成 紫 红 色的 H1 8~25时
配合物最大吸收波长处测定各 溶液 的吸光度 ,以吸光度 A
为纵 坐标 , 体 的【]M] 配 R, 为 f 横 坐标作 图( 见图 2 . ) 当配 体 的量 较小 时 , 金 属离子 没有完全 被配合 , 随 着 配体 的量逐渐增加 ,生成
( 1. 图 1
f / R】[ 』
图2
X
物解离造成 的.运用外 推法将 曲线的线 性部分延 长相交于
一
点 A a, m x 该点 对应 的f ]M] 即为配合物 的组成 比 n R, 值 f . 可 以认为 A a m x为 10 0 %完全配位时 的吸光度 ,由于配
利用曲线弯曲处求 K稳的近似值方法如下 :
V0 . 3 No 5 12 . 0c . 0 7 t2 0
光度法 对磺基 水杨酸铁配 合物的 组成及稳 数的 验研究 定常 实
李
040) 200
要 :光度 法是基 于物质对光的选择性 吸收而建 立起来的分析方法, 磺基水杨酸铁配合物在 p 1 —25时生成 紫红 l 8 i. .
在室温下(5 ) 00 0 m lL C0 溶 液为介质 , 1℃ 以 .10 o・- 14 H 用 lm 吸收池 ,蒸馏水作参 比液 ,测量可见光区 00 10 l c . 0 mo・ 0 L e 、 『 “ 磺基水杨 酸、 F 磺基水杨酸合铁 ( 的吸光度 A, Ⅲ) 以波 长为横坐标 ,吸光度 A为纵坐标 ,作吸光度一波长 曲线 图
色的 F R, 文用 7 2型分光光度计测 定了在不 同温度 、 e 本 2 浓度 时磺基 水杨 酸合铁 溶液的组成及稳定常数 , 并对其影响进行 了
磺基水杨酸合铁配合物的组成及稳定常数的测定
磺基水杨酸合铁配合物的组成及稳定常数的测定一、实验目的1.了解分光光度法测定配合物组成及稳定常数的方法及原理;2.学会分光光度计的使用;3.掌握等摩尔系列法测定配合物的组成及稳定常数。
二、实验原理磺基水杨酸( ,简式为H3R) 可与Fe3+ 形成稳定的配合物,配合物的组成随溶液pH值的不同而不同。
在pH = 2~3、4~9、9~11时,磺基水杨酸与Fe3+ 分别形成三种不同颜色、不同组成的配合物。
本实验测定pH = 2~3时所形成的红褐色磺基水杨酸合铁(Ⅲ) 配合物的组成及稳定常数。
实验中通过加入一定量的HClO4溶液来控制溶液的pH值。
所测溶液中磺基水杨酸为无色,Fe3+ 溶液的浓度很小,也可认为无色,只有磺基水杨酸合铁(Ⅲ) 配合物有色。
由朗伯–比耳定律A = εbc可知,当波长λ、溶液的温度T 及比色皿的厚度b均一定时,溶液的吸光度A只与有色配合物的浓度c成正比。
通过对溶液吸光度的测定,可以求出配合物的组成。
用分光光度法测定配合物的组成,通常有等摩尔系列法、摩尔比法、平衡移动法等,每种方法都有一定的适用范围。
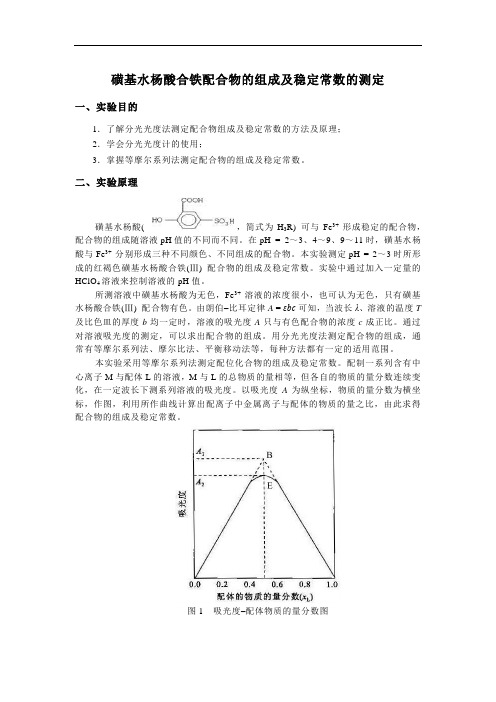
本实验采用等摩尔系列法测定配位化合物的组成及稳定常数。
配制一系列含有中心离子M与配体L的溶液,M与L的总物质的量相等,但各自的物质的量分数连续变化,在一定波长下测系列溶液的吸光度。
以吸光度A为纵坐标,物质的量分数为横坐标,作图,利用所作曲线计算出配离子中金属离子与配体的物质的量之比,由此求得配合物的组成及稳定常数。
图1吸光度–配体物质的量分数图具体操作时,取用物质的量浓度相同的金属离子溶液和配体溶液,按照不同的体积比(即物质的量之比) 配成一系列溶液,测定其吸光度值。
以吸光度值 A 为纵坐标,体积分数(,即物质的量分数。
式中:V M为金属离子溶液的体积,V L为配体溶液的体积) 为横坐标作图,得到吸光度–配体物质的量分数图(如图1所示),将曲线两边的直线部分延长相交于B点,B点对应的吸光度值A1 最大。
等摩尔连续变化法测定磺基水扬酸合铁的组成及稳定

光度法对磺基水杨酸铁配合物的组成及稳定常数的实验研究四:等摩尔连续变化法测定磺基水扬酸合铁的组成及稳定fggdj分光光度计来源:东海仪表等摩尔连续变化法是配制一系列溶液,保持溶液中度、离子强度、温度和金属离子与配体的总物质的量不变改变金属离子cM和配体的摩尔分数使之连续化,在最大吸收波长处测定各溶液的吸光度,以吸光度A配体的摩尔分数xR作图(图4),根据两边线性部分的延线相交之点所对应的配体摩尔分数值,即可求出配合的组成比可以认为相交之点Amax为配合物以n完全配位而不离解的吸光度,而实验测得值为A,两者之差就是由配合物离解所造成的.由此可求K稳,相应计算同摩尔比法.按表2配制溶液,用1cm比色皿,以1号试剂作参比液在500nm处测各溶液的吸光度,以A对xR作图,确定n.并求K稳.实验数值表明,摩尔比法和等摩尔连续变化法两种测定方法的配位数相同,最大吸光度偏差为0.002,实验测量值偏差为0.003,解离度偏差为0.028,平衡常数数值相对偏差为2.5%.考虑误差来源,认为两种分析方法无显著性差异.一、实验原理1、 等物质的量系列法求配合物组成及稳定常数对于配合物体系而言,如果组成配合物的中心离子和配体的吸收光谱与配合物不重合。
就可以选择对配合物有较大吸收的波长,测得平衡体系吸光度与相应的配合物浓度[MLn]间应符合:,得知了吸光度A 就可以求出的浓度。
本实验选用磺基水杨酸(简写为H 3R )与Fe 3+形成的配位平衡体系, H 3R 和Fe 3+等试剂与配合物的吸收光谱不重合,因此可用分光光度法测定。
但由于配位反应:所以配合物的组成受溶液的pH 影响,在pH=2~3时, 4~9时,9~11时,二者可形成三种颜色不同、组成不同的配离子。
本实验是测定pH=2~3时形成的红褐色磺基水杨酸铁配离子的组成及其稳定常数,实验中是通过加入一定量的HClO 4来控制溶液的pH 值。
由于配合物系统的复杂性,因此建立了不同的平衡系统及相应的处理方法,本实验选用等物质的量连续变化法(浓比递变法)。
磺基水杨酸铁配合物稳定常数的测定

磺基水杨酸铁配合物稳定常数的测定一.实验目的1.了解比色法测定溶液中配合物的组成和稳定常数的原理。
2.学习分光光度计的使用方法。
二.基本原理磺基水杨酸(SO 3HHOCOOH简化为H 3R ),与Fe 3+可以形成稳定的配合物,配合物的组成随溶液的pH 值的不同而改变。
在pH=2~3时,pH=4~9时,pH=9~11.5时,磺基水杨酸与Fe 3+能分别形成不同颜色且具有不同组成的配离子。
本试验是测定pH=2~3时形成的紫红色的磺基水杨酸铁配离子的组成及其稳定常数。
实验中通过加入一定量的HClO 4溶液来控制溶液的pH 值。
测定配离子的组成时,分光光度法是一种有效的方法。
实验中,常用的方法有两种:一是摩尔比法,一是等摩尔数连续变化法(也叫浓比递变法)。
本实验采用后者,用上述方法时要求溶液中的配离子是有色的,并且在一定条件下只生成这一种配合物,本实验中所用的磺基水杨酸是无色的,Fe 3+溶液很稀,也可以认为是无色的,只有磺基水杨酸铁配离子显紫红色,并且能一定程度的吸收波长为500nm 的单色光。
光密度又称吸光度,是指光线通过溶液或某一物质前的入射光强度与该光线通过溶液或物质后的透射光强度比值的对数,可用分光光度计测定。
光密度与浓度的关系可用比尔定律表示:CL A ε=其中:A 代表光密度;ε代表某一有色物质的特征常数,称之为消光系数;L 为液层厚度;C 为溶液浓度,当液层厚度一定时,则溶液光密度就只与溶液的浓度成正比。
本实验过程中,保持溶液中金属离子的浓度(C M )与配位体的浓度(C R )之和不变(即总摩尔数不变)的前提下,改变C M 与C R 的相对量,配制一系列溶液,测其光密度,然后再以光密度A 为纵坐标,以溶液的组成(配位体的物质的量分数)为横坐标作图,得一曲线,如图1所示,显然,在这一系列溶液中,有一些是金属离子过量,而另一些溶液则是配位体过量,在这两部分溶液中,溶液离子的浓度都不可能到最大值,因此溶液的光密度也不可能达到最大值,只有当溶液中金属离子与配位体的摩尔比与配离子的组成一致时,配离子的浓度才最大,因而光密度才最大,所以光密度最大值所对应的溶液的组成,实际上就是配合物的组成。
铁(III)离子与磺基水杨酸配合物的组成和稳定常数的测定

五.数据处理
以吸光度 A 为纵坐标,体积比 VFe /( VFe 中的按钮可完成作图过程。
3+ 3+
+VL),即摩尔分数为横坐标作图,点击图 8
图 8 实验数据绘图过程
图 2 容量瓶的使用 (2)移液管的使用, 以及用移液管在烧杯中配制系列溶液。
图 3 移液管的使用及正确操作演示 (3)分光光度计的使用方法。 ① 721 型分光光度计的使用
图 4
721 型分光光度计的仪器简图
(1)仪器预热约 20min。 (2)灵敏度选择:放大器灵敏度分五档,是逐步增加的,1 档最低。其选择原则是保证能 使空白溶液很好调到透光率 100 的情况下,尽可能采用较低档,这样仪器将有更高的稳定 性。所以,使用时一般灵敏度都放在 1 档,灵敏度不够时再逐步升高。不过要注意,改变 灵敏度后要重新调透光率 0 和透光率 100。 (3)预热光度计:预热后,要连续几次调透光率 0 和透光率 100,仪器才可开始进行测量。 (4)测量溶液光密度:打开比色皿暗箱盖,取出比色皿架,除已装空白溶液的比色皿外, 其余 3 个比色皿分别用去离子水和所装溶液洗 2~3 遍,接着依次装入不同浓度的标准系列 溶液或未知液,液面应高于比色皿的 2/3,溶液(千万不要使劲擦,以免磨毛比色皿的透光 面) ,将它们依次放到比色皿架内,并把比色皿放回暗箱内定位销上(尽量贴近左面,光面 穿过光路) ,把比色皿暗箱盖合上。
离子的解离度为: MLn 起始浓度 c M 0 cα
而配离子的稳定常数 K 稳可由下列平衡式导出: + nL (电荷省去) 0 n cα
平衡浓度 c-cα
K稳
=
式中 c 为 B 点或 E 点所对应的金属离子的浓度,α为解离度。
光度法对磺基水杨酸铁配合物的组成及稳定常数的实验研究

光度法对磺基水杨酸铁配合物的组成及稳定常数的实验研究光度法是一种实验方法,通常用于研究溶液中某种物质的浓度和光吸收的关系。
在化学实验中,光度法被广泛应用于研究配位化合物的组成和稳定常数等性质。
这篇文章将着重介绍光度法在磺基水杨酸铁配合物的研究中的应用。
首先,我们需要明确一些概念。
所谓磺基水杨酸铁配合物,就是由铁离子和磺基水杨酸离子组成的一种化合物。
在溶液中,这种化合物会通过配位作用形成复合物,并且形成不同的比例,这些比例可以通过一定的实验方法来确定。
稳定常数是一种用来描述化学反应系统在平衡状态下强度的指标,通常用来衡量配位反应中复合物的稳定程度。
在实验过程中,首先我们需要制备磺基水杨酸铁配合物的溶液,然后通过光度法来研究它的组成和稳定常数。
为了确定配合物的组成,我们可以利用分光光度计来测量溶液的吸收度,并根据比例原理来计算不同组分的浓度。
通常情况下,我们使用一定的数学方法来处理实验数据,从而确定溶液中每种组分的浓度。
例如,可以使用计算机程序来拟合研究结果,得到精确的配合物组成。
测定配合物的稳定常数,则需要通过测定不同配比下的吸收度来实现。
在实验中,我们可以通过改变配合物中每种组分的浓度来确定其稳定常数。
通常来说,我们需要测定几个不同比例下的吸收度,然后将实验数据带入计算公式中,以得出配合物的稳定常数。
总之,光度法是一种非常重要的实验手段,可以被广泛应用于化学反应、药物研发等领域中。
特别是在磺基水杨酸铁配合物的研究中,光度法能够有效地研究其组成和稳定常数等性质,为我们深入了解化学反应提供了重要的实验手段。
磺基水杨酸合铁配合物的组成及其稳定常数的测定

实验七铁(III)离子与磺基水杨酸配合物的组成和稳定常数的测定一、实验目的1.了解采用分光光度法测定配合物组成和稳定常数的原理和方法。
2.学习用图解法处理实验数据的方法。
3.进一步学习分光光度计使用方法,了解其工作原理。
4. 进一步练习吸量管、容量瓶的使用二、实验原理R)可以与Fe3+ 形成稳定的配合磺基水杨酸(简式为H3物。
配合物的组成随溶液pH值的不同而改变。
在pH=2~3、4~9、9~11时,磺基水杨酸与Fe3+能分别形成三种不同颜色、不同组成的配离子。
本实验是测定pH=2~3时所形成的红褐色磺基水杨酸合铁(Ⅲ)配离子的组溶液来控制溶液的pH值。
成及其稳定常数。
实验中通过加入一定量的HClO4由于所测溶液中磺基水杨酸是无色的,Fe3+溶液的浓度很小,也可认为是无色的,只有磺基水杨酸合铁(Ⅲ)配离子(MRn)是有色的。
根据朗伯—比耳定律A=εbc可知,当波长λ、溶液的温度T及比色皿的厚度b均一定时,溶液的吸光度A只与有色配离子的浓度c成正比。
通过对溶液吸光度的测定,可以求出配离子的组成。
用光度法测定配离子组成,通常有摩尔比法、等摩尔连续变化法、斜率法和平衡移动法等,每种方法都有一定的适用范围,本实验采用等摩尔连续变化法,通过分光光度计测定配位化合物的组成。
具体操作时,取用摩尔浓度相等的金属离子溶液和配位体溶液,按照不同的体积比(即摩尔数之比)配成一系列溶液,测定其吸光度值。
以吸光度值 A 为纵坐标,体积分数(,即摩尔分数。
式中:V M为金属离子溶液的体积,V L为配位体溶液的体积)为横坐标作图得如图1所示的曲线,将曲线两边的直线部分延长相交于B点,B点对应的吸光度值A B 最大。
由B点对应的摩尔分数值,可计算配离子中金属离子与配位体的摩尔数之比,即可求得配离子MLn 中配位体的数目n 。
图 1 配位体摩尔分数-吸光度图在图1中,在B点最大吸收处对应的摩尔分数值为0.5,则:即:金属离子与配位体摩尔数之比为1︰1。
