配合物结构
配合物结构

2 Eeg + 3Et2 g = 0 ∴ Eeg Et2 g = 10 Dg
那
Eeg = 6 Dg Et2 g = 4 Dg
3、正四面体场的作用:配体从四面体的四个顶点接近中心离子
L
L
一种 d xy , d yz , d zx
L
L L
指向四面体棱的中点,
L
受一定斥力,能量有所 上升;
L
L
d xy , d yz , d zx
2+ 4
[Fe ( H 2O )6 ] ,[Fe ( CN )6 ]
Q Fe2+ : kk 3d 6 , p = 19150cm 1 H 2O = 10400cm 1 , CN = 33000cm 1 ∴ H 2O < p ,
[Fe ( H 2O )6 ]2+ 中Fe2+的 d电子排布
eg 2 t2 g 3+1
正八面体
dsp , d sp L 杂化
一般,共价配合物多是低自旋态。如 [Fe(CN)6]3-等
晶体场理论(CFT) §6-2 晶体场理论(CFT)
M
n+与L n-的作用是L n-形成的力场对M n+的作用,使M n+
的d轨道分裂, d电子重排。
一、中心离子 轨道能级的分裂: 中心离子d轨道能级的分裂 中心离子 轨道能级的分裂: 1、球对称场的作用:5个d轨道受到的作用是相同的,轨道整 体能量上升,但不发生分裂。 Es
依光谱序列
I < Br <L< OH < F < H2O <L< py< NH3 <L< en< NO < CN,CO 2
无机化学《配合物》教案

无机化学《配合物》教案配合物是指由配位原子(或离子)与另一部分(配位体)通过化学键连接而成的化合物。
配合物具有许多独特的化学和物理性质,并广泛应用于催化剂、药物、颜料和材料等领域。
本教案旨在介绍配合物的定义、结构以及配位键的形成机制和性质。
一、配合物的定义1.配合物是指由配位原子(或离子)与另一部分(配位体)通过化学键连接而成的化合物。
2.配位原子(或离子)是通常为过渡金属离子,但也可以是其他元素或离子。
3.配位体是指可以通过配位键与配位原子(或离子)形成配合物的分子或离子。
二、配合物的结构1.配位原子(或离子)和配位体通过配位键相连。
2.配位键的形成使得配位体围绕着配位原子(或离子)形成一个立体结构,称为配位球。
3.配合物的结构可以是一维、二维或三维的,具有不同的形态和几何构型。
4.配位原子(或离子)的电子层配置决定了配合物的稳定性和反应性。
三、配位键的形成机制和性质1.配位键的形成是通过配位体的配位原子与配位原子(或离子)的空位或配对电子形成配位键。
2.配位键可以是共价键、离子键或金属键。
3.配位键的形成能力受到配位原子(或离子)的电子能级和配位体的配位能力的影响。
4.配位键的性质包括键长、键能、键角和配位度等。
这些性质决定了配合物的化学和物理性质。
四、配合物的化学性质1.配合物可以发生配位键的断裂和配位体的替换反应,产生新的配合物。
2.配合物的稳定性受到配位原子(或离子)的电荷、原子半径和配位体的配位能力的影响。
3.配合物的溶解度和酸碱性常常与配位体的配位能力和配位度有关。
4.配合物的光谱性质(如吸收光谱、荧光光谱等)可以用来确定配位原子(或离子)和配位体的结构和环境。
五、配合物的应用1.配合物常用作催化剂,参与有机合成和化学反应。
2.配合物可用于制备药物,具有生物活性和药效。
3.配合物可以用作颜料和染料的原料,提供不同颜色和稳定性。
4.配合物可用于制备材料,具有特殊的磁性、光学和电学性质。
第四章 配合物

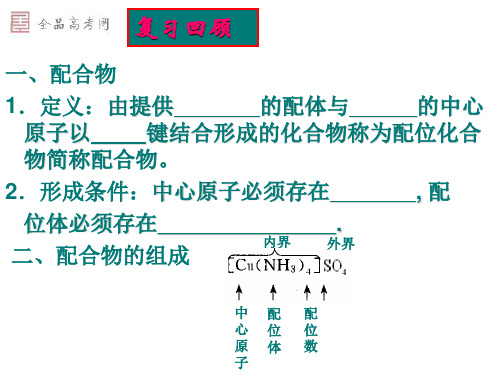
第4章:配合物一.配合物的组成(1)配位体:是含有孤电子对的分子或离子,如NH3、Cl-、CN-等。
配位体中直接同中心原子配合的原子,叫做配位原子。
如上例[Cu(NH3)4]2+配离子中,NH3是配位体,其中N原于是配位原子。
配位原子经常是含有孤对电子的原子。
(2)中心离子(或原子):一般是金属离子,特别是过渡金属离子,但也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。
此外,少数高氧化态的非金属元素也能作为中心原子存在,如SiF62-中的Si(Ⅳ)及PF6-中的P(V)等。
(3)配位数:直接同中心离子(或原子)配合的配位原子的数目,叫做该中心离子(或原子)的配位数,一般中心离子的配位数为2、4、6、8(较少见),如在[Pt(NH3)6]C14中,配位数为6,配位原子为NH3分子中的6个氮原子。
(4)配离子的电荷:配离子的电荷数等于中心离子和配位体电荷的代数和。
如[Cu(NH3)4]2+的电荷是+2+(0)×4=+2。
二.配合物的分类配位化合物的范围极广,主要可以分为以下几类:(1)单核配合物这类配合物是指一个中心离子或原子的周围排列着一定数量的配位体。
中心离子或原子与配位体之间通过配位键而形成带有电荷的配离子或中性配合分子。
如[Cu(NH3)4]SO4、K4[Fe(CN)6]等皆属于此类配合物。
(2)螯合物这类配合物是由多齿配位体以两个或两个以上的配位原子同时和一个中心离子配合并形成具有环状结构的配合物。
例如乙二胺H2N-CH2-CH2-NH2和Cu2+形成的如下螯合物:三.配合物的命名配合物的命名与一般无机化合物的命名原则相同。
若配合物的外界是一简单离子的酸根,便叫某化某;若外界酸根是一个复杂阴离子,便叫某酸某(反之,若外界为简单阳离子,内界为配阴离子的配合物也类似这样叫法)。
若配离子的内界有多种配体,须按下列顺序依次命名:简单离子—复杂离子—有机酸根离子;而中性分子配位体的命名次序为:H2O—NH3—有机分子。
配合物的结构

6 2g
t 26g e1g
3 3
1 2
d8
t
e 6 2
2g g
3
d9
t
e 6 3
2g g
4
3 4
-12Dq -6 Dq
t 26g eg2 t 26g eg3
3 4
3 4
d10 t36geg4
5
5
0 Dq t26geg4
5
5
CFSE
-4Dq -8Dq -12Dq -16 Dq+P -20 Dq+2P -24 Dq+2P -18 Dq+P -12Dq -6 Dq 0 Dq
4 5.62 高 外轨型 sp3d2
晶体场稳定化能(CFSE)
1.晶体场稳定化能(CFSE)的定义
d电子从未分 裂的d轨道进入分 裂后的d轨道,所 产生的总能量下降 值。
2.CFSE的计算
n1:t 2
n2:e
轨道中的电子数
g
轨道中的电子数
g
mm12::八球面形体体场场中中,,dd轨轨道道中中的的成成对对电电子子数数
排布原则:(1)能量最低原理 (2)Hund规则 (3)Pauli不相容原理
电子成对能(P):两个电子进入同一轨 道时需要消耗的能量。
强场:o > P 弱场:o < P
八面体场中电子在t2g和eg轨道中的分布
八面体场中电子在t2g和eg轨道中的分布
高自旋
低自旋
例:
o /J
P/J 场
Co3+的价电子构型
八面体场中 d 电子排布
未成对电子数 实测磁矩/B.M
自旋状态 价键理论 杂化方式
[Co(CN)6]367.524 ×10-20 35.250 ×10-20
配合物结构的空间构型
3 正三角形
4 正四面体型
4 平面四边型
5 三角双锥体
5 四方锥体
6
八面体
6
八面体
通式
ML2±
ML3± ML4± ML4± ML5± ML5± ML6± ML6±
实例
[Ag(NH3)2]+
[HgI3][Zn(NH3)4]2+ [Pb(CN)4]2-
PF5 SbF52AlF63[Fe(CN)6]3-
新课讲述
sp
中心原子杂化方式
sp
配位数
2
银的化 合价
+1
形状
直线型
活动与探究
试用杂化轨道理论分析下列配合物的空 间构型 [Zn(NH3)4]2+
[Ag(CN)2]-
[HgI3][Ni(CN)4]2-
总结归纳
三、常见配合物的杂化方式、配位数及空间构型
中心原子杂化 配位数
方式
Sp
2
形状 直线型
Sp2 Sp3 *dsp2 * sp3 d *dsp3 * sp3 d2 * d2sp3
必
定易与Mn+
结合.如
NH3>
3. 形成配合物后,颜色、溶解性、酸碱性、氧化
还原性等都有可能发生改变。
形成现象
几何异构
交 流 与 1. 怎样判断顺式和反式? 讨 论 2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表.
配合物 顺式 反式
结构式
Cl Cl
Pt
NH3 NH3
Cl
NH3
Pt
NH3 Cl
分子极性 在水中溶解 性
知识点1 配合物的组成及命名

第三章配合物结构主要内容:1.配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系。
2.内轨型、外轨型配合物的概念;中心离子价电子排布与配离子稳定性、磁性的关系。
3.配合物晶体场理论的基本要点;高自旋、低自旋配合物等;推测配合物的稳定性、磁性。
4.配合物的颜色与 d-d 跃迁的关系。
配合物的组成配合物:是由中心离子(或原子)与一定数目的阴离子或中性分子形成具有一定的空间构型和稳定性的复杂化合物。
例如: [Ag(NH3)2]OH, [Cu(NH3)4]SO4,Ni(CO)41.中心离子(或原子)中心离子(或原子)也称为形成体,具有空的价电子轨道,通常是金属离子和原子,也有少数是非金属元素。
例如:Cu2+,Ag+,Fe3+,Fe,Ni,BⅢ,PⅤ……配位体简称配体,通常是非金属的阴离子或分子,例如:F-,Cl-,Br-,I-,OH-,CN-,H2O,NH3,CO……2.配位体和配位原子单齿配体:配体中只有一个配位原子。
多齿配体:具有两个或多个配位原子的配体。
例如:乙二胺(en ) 2 2 2 2H N CH CH N H ∙∙∙∙乙二酸根(草酸根) -242O C 乙二胺四乙酸根 EDTA (Y 4-)配位原子:与形成体成键的原子。
配位数:配位原子数单齿配体:形成体的配位数等于配体的数目;多齿配体:形成体的配位数等于配体的数目与基数的乘积。
3. 中心离子(或原子)的配位数[] Cu(en)22+Cu 2+的配位数等于4。
例如:CH N H NH C H CuCH N H NH C H 2222222 22+Ca2+的配位数为6,配位原子分别是4个O,2个N。
从溶液中析出配合物时,配离子常与带有相反电荷的其他离子结合成盐,这类盐称为配盐。
配盐的组成可以划分为内层和外层。
配离子属于内层,配离子以外的其他离子属于外层。
外层离子所带电荷总数等于配离子的电荷数。
配合物的化学式和命名配酸:×××酸配碱:氢氧化×××配盐:先阴离子后阳离子,简单酸根加“化”字,复杂酸根加“酸”字。
第二课时 配合物的结构和性质

第二课时配合物的结构和性质【学习目标】了解配合物的结构和性质【知识要点】一、配合物的结构2.顺、反异构体化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配位体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位体的位置都是彼此相邻的。
(4)顺、反异构体性质同。
【基础训练】已知Pt(NH3)2Cl2有顺、反两种异构体A、B,A为棕黄色,有抗癌活性,在水中溶解度为0.2577g,B为淡黄色,无抗癌活性,在水中溶解度为0.0366g。
请指出______是顺式异构体,______是反式异构体,写出表示A、B的空间结构的结构式:A___________________________ B___________________________3.配合物的类型(了解)配合物的范围极广,主要可以分为以下几类:(1)简单配位化合物:指由单基配位体与中心离子配位而形成的配合物。
这类配合物通常配体较多,在溶液中可以逐级解离成一系列配位数不同的配离子。
(2)螯合物:具有环状结构的配合物叫螯合物。
二、配合物的性质:配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________(2)配位体的碱性____________________________________________________三、配合物的应用1.银镜反应2.Fe3+的检验3.用于离子的检验用可分离CuSO4溶液和Fe2(SO4)3溶液。
第5章配合物结构

结构异构
原子间连接方式不同引起的异构现象 (键合异构,电离异构,水合异构,配位异构……) (1) 键合异构
[Co(NO2)(NH3)5]Cl2 [Co(ONO)(NH3)5]Cl2 (2) 电离异构
硝基 黄褐色 酸中稳定 亚硝酸根 红褐色 酸中不稳定
[Co(SO4)(NH3)5]Br [Co Br(NH3)5] SO4
配合物的空间构型
配体在中心原子(或离子)的周围并非任意的堆积, 而是以确定的数目,按一定的方式有规律的排列着。 其中,中心原子的配位数与配合物的空间构型有着 密切的关系,
配位数为二和三的配合物
当中心原子与二个配体配位时,为使两配体成键电 子对间的斥力最小通常将形;成键角为1800的直线 型配合物。
(3) 水合异构
[Cr(H2O)6]Cl3 [CrCl(H2O)5]Cl2 ·H2O [CrCl2(H2O)4]Cl ·2H2O
(4) 配位异构
紫色 亮绿色 暗绿色
[Co(en)3][Cr(ox)3] [Cr(en)3][Co(ox)3]
2 立体异构
立体异构的研究曾在配位化学的发展上起过决定 性的作用。Werner曾出色地完成了配位数为四和六 的配合物立体异构的合成与分离,从而为确立配故 理论提供了最令人信服的证明。
2.83
0
=√n(n+2)
—磁矩,单位为波尔磁子,符号 B.M. n—未成对电子数
n(未成对电子数) 0 1 2 3 4 5
(理)/B.M. 0 1.73 2.83 3.87 4.90 5.92
/B.M. n(未成对电子数)
Fe3+的d电子构型 杂化轨道 配键类型
[FeF6]3- [Fe(CN)6]3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在 t 2 g 上出现d电子排布不对称,易发生小畸变。
§6-3
Cu2+ Zn2+
四、Jahn-Teller效应:配合物发生几何变形的现象。
如 [CuCl6]4-
为拉长的八面体
Cl Cl
Cl
0.296nm
原因:由于中心离子的d电子在分裂的
Cu
t2 g ,eg 分布不对称所引起的。
后果:消除了 eg ( 或t2 g
0.230nm
Cl
Cl Cl
)
的简并。
分析: Cu2+:kk3d9
按微扰理论, d轨道的平均能量不变,并令Es=0
2 Eeg 3Et2 g 0 Eeg Et2 g 10Dg
那
Ee g 6 D g Et2 g 4 Dg
3、正四面体场的作用:配体从四面体的四个顶点接近中心离子 一种 d xy , d yz , d zx
L L L L
, Cl- 是弱场
这样,使得在 z方向的斥力大于 x , y 方向,而把 z 方向拉长。 例: [Ni(CN)4]2Ni2+:kk3d8 , 而CN-是强场
Cu2+的d电子采取高自旋态,即 t 2 g 6 d 2 2 d 2 2 1 z x y
Ni2+的d电子采取低自旋态 t 2 g 6 d z 2 2 d x 2 y 2 0
n+
的电子排布与自由离子一样,一般是高自旋
L
n-
……L
n-
M n+ L n- ……L
n-
二、共价配键: 要点:1、 M 2、 M
M
n+
L
n-
n+在配体影响下,价层电子重排,空出足够
的空轨道;
n+的价轨道进行杂化,决定空间构型。
( n 1 )d 2 nsnp3 杂化—内轨型 nsnp nd
3 2
d xy
d z2
d yz ,d zx
Es
5.14Dg
d
其它配位体场对中心离子的影响,可类似分析。
二、 d轨道的电子排布: d轨道分裂后,迫使电子重排。这会使电子成对的能量P增 加,这是自旋引起的量子力学效应。 1、分裂能 和成对能
p
:①配体影响:同一中心离子,配体的场强愈强,引起 愈大。
三、晶体场稳定化能——LFSE:
d电子进入分裂的d轨道,产生总能量下降——LFSE。 1、 LFSE的计算:如八面体场
LFSE nEt2 g mEeg np
例
Fe ( CN )6 3 ,
Fe3 : kk3d 5
p 29675 cm1 CN 33000 cm1
2 dsp 分别和3个 杂化轨道形成 配键,电
例: 蔡司盐离子(Zeise) [PtCl3(C2H4)]-
子由Cl- 提供; 和 2 与一个 dsp2 杂化轨道形成 配键,电子
2
*0
由C2H4提供; *0 与Pt2+的 d 2 都具有 对称性,形成反 zx 馈 配键。 Cl Cl 如 右 图 所 示
R=CH2CH3 =COCH3
N H H
H CH3
CH3
还原卟啉环系(叶绿素,细菌叶绿素)
N C C C C His96 N Zn
H2O N
CF3 O O
S
Zn
C N N His119 C C C
O N S
C C C N
N C
Zn
O N CF3
His94
碳酸酐酶
CO2
OH
双核锌大杂环配合物
HCO3
唐敖庆先生等因在配位场理论方面的贡献和成就,曾获得 国家自然科学一等奖
推荐参考书目:
《 配位化学》,戴安邦等,科学出版社,1987,10 《配位化合物的结构和性质》,游效曾,科学出版社,1992,2
§6-1 配合物的价键理论(VBT)
一、电价配键: M
n+与L n-(或有偶极矩的分子),靠
静电引力结合在一起,形成配合物。 结合力——库仑力 取决于L n-的大小和电荷。中心离子M 态,有单电子,显顺磁性。 如[FeF6]3-等
③ 随配位原子半径的减小而增大: 如 I Br Cl S F O N C p :电子成对能。使体系能量升高。 2、 d轨道中d电子的排布:要从 和 ①
p
综合考虑。
p p
配体是弱场, 较小 d电子尽量采取高自旋态。
②
如: Fe2
配体是强场, 较大 d电子尽量采取低自旋态。
L L L L
指向四面体棱的中点, 受一定斥力,能量有所 上升; 一种 d x 2 y 2 , d z 2
2
d xy , d yz , d zx
dx
2
y2
,d z
指向四面体面心,受斥
力较小,能量升高较小。
t
d
Et2
Es
Ee
4 4 四面体场失去中心对称,且 t 0 10 Dg 9 9 2 同理 3Et 2 Ee 0 那 Et2 0 1.78Dg 2 5 4 3 Et 2 Ee 10D g Ee 0 2.67Dg 9 5
属 D5d 点群。
中心原子Fe:kk3d64s24p0 ,其中 dzx,dyz 具有 对称性,
配体:两个戊环的离域 分子轨道也具有 对称性,
Fe和两个C5H5 能形成 配键,生成二茂铁 配合物。
2 2 2 2 4 2 0 0 配体CO :1 2 3 4 1 5 2 6
HOMO LUMO
分析:6个CO的每个 5 2 与Cr 的6个
对称性(对称允许),可形成6个成键 轨道, 和6个反键 轨道 2 且电子由CO的 5 提供,形成 配键;(如下图)
d sp
2
3 杂化轨道都具有
Cr
d 2sp3
+
C
5 2
O
Cr
C O
配键
由于6个 配键的形成,使Cr 上聚集了过多的负电荷,体
2 2 2 系处于不稳定状态。又Cr 的 d xy , d yz , d zx 具有 对称性,分
别从6个方向把d电子反配给CO的2 空轨道,形成6个 d *
反馈 配键。(如下图)
的热力学稳定性有如下规律:
d1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9 d10
如[M(H2O)6]2+ ,M2+如为第一过度金属离子
H kj / mol 的变化规律如下图所示
H
Ca2+ Sc2+
Ti2+
V2+
Cr2+
Mn2+ Fe2+ Co2+ Ni2+
杂化—外轨型
正八面体
dsp2 , d 4 sp3 杂化
一般,共价配合物多是低自旋态。如 [Fe(CN)6]3-等
§6-2 晶体场理论(CFT)
M
n+与L n-的作用是L n-形成的力场对M n+的作用,使M n+
的d轨道分裂, d电子重排。
一、中心离子d轨道能级的分裂: 1、球对称场的作用:5个d轨道受到的作用是相同的,轨道整 体能量上升,但不发生分裂。 Es
配键
M
如果中心离子的价态是零价或负价,其键的特点为
一、羰基配合物: 如 Cr(CO)6 中心原子 Cr :kk3d54s14p0
L
当配体CO接近Cr 时, d电子重排 kk3d64s04p0.
3d x2 y2 ,3d z2 ,4s,4 px ,4 p y ,4 pz 进行 d 2sp3 杂化,具有 对称性。
第六章 配合物结构
由中心离子或原子(M)与周围配体(L)所组成的化合物为 配合物。 M—L之间的键称配位键 配位键理论:价键理论—VB 晶体场理论—CFT 分子轨道理论—MO 配位场理论—MOT 配位场理论是在分子轨道理论的基础上,把中心原子(M)
的价轨道按
…… 道按 和
和
的对称性分类,与配体线性组合的群轨
2
y2
2
L L L L
L
L L
L L L
L L
dx
2
y2
,d z
2
d xy , d yz , d zx
Eeg
0 10Dg
Es
能级图中:t—三重简并,e—二重简并,2—以 V 反对称
令 0 10Dg
d
Et 2 g
D g 为相对场强参数
Eeg Et2 g 10Dg
dx
2
y2
, d z , d xy , d yz , d zx
2
d
2、正八面体场的作用:L从 x , y , z 六个方向接近中心离子 由于d轨道的伸展方向不同,所以,能量升高不一样。
dx
, d z 与配体L影响方向相同,排斥力大,能量升高较高; d xy , d yz , d zx 与配体岔开,排斥力较小,能量升高较低。
2 4
Fe ( H 2O )6 ,Fe ( CN )6
Fe2 : kk 3d 6 , p 19150 cm1 H 2O 10400 cm1 , CN 33000 cm1 H 2O p ,
