第三节烃
《主题五 第三节 烃的衍生物》教学设计教学反思

《烃的衍生物》教学设计方案(第一课时)一、教学目标1. 知识与技能:学生能够识别烃的衍生物,了解其物理性质和化学性质,掌握其定名规则。
2. 过程与方法:通过实验和观察,学生能够理解烃的衍生物的转化过程,并掌握其反应机理。
3. 情感态度价值观:培养学生对于化学学科的兴趣,树立科学周密的学习态度。
二、教学重难点1. 教学重点:掌握烃的衍生物的定名规则,理解烃的衍生物的转化过程和反应机理。
2. 教学难点:理解烃的衍生物的化学性质,通过实验观察其反应过程。
三、教学准备1. 准备相关实验器械,如试管、烧杯、滴定管等。
2. 准备烃的衍生物样品及试剂。
3. 制作PPT,包含相关图片和视频,以帮助学生理解。
4. 安排学生预习相关内容,提前阅读教材。
四、教学过程:(一)引入课题通过展示一些平时生活中的化学物质,如酒精、苯、油漆、塑料等,引发学生的兴趣和思考。
然后提出课题:烃的衍生物在生活和化工生产中的应用。
(二)教学重点与难点重点:烃的衍生物的观点、分类和性质。
难点:烃的衍生物在生活和化工生产中的应用。
(三)教学方法以学生自主探究为主,结合教师引导和讲解。
(四)教学用具PPT课件、实验器械、相关化学物质样品等。
(五)教学过程1. 介绍烃的衍生物的观点和分类,通过PPT展示一些常见的烃的衍生物,如乙醇、苯酚、乙酸等,并诠释它们的性质和用途。
2. 进行实验演示,让学生观察乙醇、苯酚、乙酸等物质的物理性质,如颜色、气味、状态等,并引导学生通过实验探究它们的化学性质,如氧化、还原、酯化等反应。
3. 组织学生进行小组讨论,让学生结合实验结果和课本知识,总结烃的衍生物的性质和用途,并鼓励他们提出自己的问题和见解。
4. 针对学生讨论中出现的问题和难点,进行讲解和答疑,并引导学生将所学知识应用到实际生活中,如诠释油漆、塑料等物质的组成和性质。
5. 安置课后作业,包括复习稳固教室内容、查阅资料了解更多烃的衍生物的应用等,以培养学生的自主学习能力和探究精神。
2017-2018学年高中化学 第一章 有机化合物的结构与性质 烃 第3节 烃 第1课时 烃的概述烷烃的化学性质 鲁科

只生成 CH3Cl B.甲烷与氯气发生取代反应,生成的产物中 CH3Cl 最多 C.甲烷与氯气发生取代反应,生成的产物为混合物
D.1 mol CH4 完全生成 CCl4,最多消耗 2 mol Cl2
解析:甲烷与氯气一旦发生取代反应就不会停止在某一步,故得不
到纯净的 CH3Cl,A 错误,C 正确;甲烷与氯气的反应中每取代 1 mol 氢原子,消耗 1 mol 氯气,生成 1 mol HCl,故产物中 HCl 最多,B
(2)链烃的物理通性 ①相似性: 烷烃、烯烃、炔烃在物理性质上具有某些相似性。如它们均为无
色物质,都 不溶于 水而易溶于 有机溶剂,密度比水 小 等。
②递变性: 链烃的物理性质随着其碳原子数的递增呈现出一定的递变性。
a.状态:由 气态 →液态→ 固态 ; b.熔、沸点: 逐渐升高 ;
c.密度:逐渐增大(但小于 1 g·cm-3)。
CH2Cl2 + 2HCl , CH4 + 3Cl2 ―h―ν→ CHCl3 + 3HCl , CH4 +
4Cl2―h―ν→CCl4+4HCl。1 mol CH4 生成 CH3Cl、CH2Cl2、
CHCl3、CCl4 各为 0.25 mol,则消耗 Cl2 的物质的量为 0.25 mol
+0.25 mol×2+0.25 mol×3+0.25 mol×4=2.5 mol。
第3节 烃
第 1 课时 烃的概述 烷烃的化学性质 [课标要求]
1.了解烃的分类。 2.了解烷烃、烯烃、炔烃、苯及其同系物的物理性质。 3.掌握烯烃、炔烃的命名规则(含一个双键或叁键)。 4.掌握烷烃的化学性质。
1.烷烃的通式是 CnH2n+2。 2.烷烃是饱和烃,烯烃、炔烃属于不饱和烃,苯及其同系物
1.3_烃
【问题2】结构特点,与同学们讨论,推导这些烃的组 成通式并完成下面的表格(用n表示分子中碳原子数)
类别 烷烃 单烯烃 环烷烃 单炔烃 二烯烃 环烯烃 苯及苯的同系 物
通 式
CnH2n+2 (n≥1)
CnH2n (n≥2)
CnH2n—2 (n≥2)
CnH2n—6 (n≥6)
【知识支持】 1、分子中的碳原子连接成环状而又无苯环的烃称为 脂环烃。 2、脂环烃分子中碳原子间完全以单键相连的烃为环 烷烃、含有碳碳双键的为环烯烃、含有碳碳叁键的为 环炔烃。 3、链烃分子中含有两个碳碳双键的烃称为二烯烃 【问题3】环烷烃、二烯烃与哪些链烃互为同分异构体?
课堂练习
1、空气中含甲烷5%~15%(体积分 数)点燃就会爆炸,发生爆炸最强 烈时,甲烷在空气中所占的体积分 数是( 约10 )%。 2、在光照下,将等物质的量的CH4 和Cl2充分反应,得到产物的物质的 量最多的是( D ) A、CH3Cl B、CH2Cl2 C、CCl4 D、HCl
3、一定量的甲烷燃烧后得到的产物 是CO、CO2、H2O(g),此混合物的 质量为49.6g,当其缓缓通过足量的 无水CaCl2时气体质量减少25.2g,则 混合气体中CO的质量为( )
讨论
• 将过量的乙烯通入盛有溴水的 试管中,在反应后的溶液中加
入经硝酸酸化的AgNO3溶液,为
什么溶液中没有出现淡黄色的
AgBr沉淀?
2.加成反应
①.与卤素单质加成:
H H
H—C=C—H
同时断键
H H
H—C C—H
Br Br CH2Br-CH2Br
1,2 – 二溴乙烷
Br−Br CH2=CH2+Br2
解:n水=25.2g/18g/mol=1.4mol nH= 2.8 mol n甲烷=0.7mol 设CO为 xmol,则CO2为(0.7-x)mol,故有: 28x + 44(0.7-x)=49.6-25.2=24.4 x=0.4mol Wco=28X0.4=11.2g
第三节烃

基础再现·深度思考
第2 讲
2.甲烷跟溴水中的 Br2 能发生取代反应生成 CH3Br 吗?
答案
不能,只有纯净卤素单质在光照条件下才能与 CH4 发
生取代反应,溶液中的卤素单质不能与 CH4 发生取代反下列物质:①丁烷 ②2甲基丙烷 ③戊烷 ____________。
基础再现·深度思考
第2 讲
深度思考 6.乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,二 者的褪色原理是否相同?两反应在鉴别和除杂方面有何 不同?
答案 二者褪色原理不相同。乙烯使酸性高锰酸钾溶液褪色 是发生了氧化还原反应,高锰酸钾将乙烯氧化成 CO2,高锰 酸钾被还原;乙烯使溴的四氯化碳溶液褪色是与单质溴发生 了加成反应。在鉴别烷烃和烯烃时二者均可以使用,但在除 杂时不能用高锰酸钾溶液,因为会引入 CO2 杂质。
基础再现·深度思考
第2 讲
②苯的同系物发生卤代反应时,在光照和催化剂条件下,卤 素原子取代氢的位置不同,如
(2)苯环对甲基的影响 烷烃不易被氧化,但苯环上的烷基易被氧化。 苯的同系物能使酸性高锰酸钾溶液褪色,而苯不能被酸性高 锰酸钾溶液氧化,用此法可鉴别苯和苯的同系物。
基础再现·深度思考
第2 讲
CH3Cl+HCl
; ; ; 。
甲烷的四种氯代物均 难 溶于水,常温下,只有 CH3Cl 是 气体 , 其他三种都是 液体 。CHCl3 俗称 氯仿 ,CCl4 又叫四氯化碳 ,是重要的有机溶剂,密度比水 大 。
基础再现·深度思考
第2 讲
(2)甲烷的氧化反应 热化学方程式为 CH4(g)+2O2(g)
基础再现·深度思考
第2 讲
特别提醒
从形式上看,加成反应类似于无机化学中的化合
第三节 烃

烃的通式和物理性质 烃的通式和物理性质
类别 烷烃 单烯烃( 单烯烃(只有一个 碳碳双键) 碳碳双键) 单炔烃( 单炔烃(只有一个 碳碳叁键) 碳碳叁键) 苯及苯的同系 物
通 式
CnH2n+2
(n≥1) )
CnH2n
(n≥2) )
CnH2n—2
(n≥2) )
CnH2n—6
(n≥6) )
注意同分异构体的问题
3-甲基 丁烯 甲基-1-丁烯 甲基 2-甲基 丁烯 甲基-2-丁烯 甲基
CH3CH=CCH3 CH3
7、在120℃时,某混合烃和过量 2在一密闭 、 某混合烃和过量O ℃ 容器中完全反应, 容器中完全反应,测知反应前后的压强没 有变化, 有变化,则该混合烃可能是 A、 、 √ 、CH4和C2H4 B、CH4和C2H6 C、C2H4和C2H6 D、C3H4和C3H6 、 、
第3节 烃 节
烟台二中高09级 烟台二中高 级
一、烃的概述 烷烃 (饱和烃) 饱和烃) 链烃(脂肪烃) 链烃(脂肪烃) 烯烃
烃
环烃
脂环烃
炔烃 饱和烃) 环烷烃(饱和烃) 环烯烃
芳香烃
苯和苯的同系物
多环芳香烃 [问]哪些是饱和烃和不饱和烃,怎样区分? 哪些是饱和烃和不饱和烃, 问 哪些是饱和烃和不饱和烃 怎样区分?
烃与氧气的反应 点燃 CxHy +(x+y/4) O2 xCO2 + y/2 H2O / / 在处理有关烃的燃烧问题时,应注意的问题: 在处理有关烃的燃烧问题时,应注意的问题: 燃烧时, (1)当等物质的量的烃 )当等物质的量的烃CxHy燃烧时,耗氧 燃烧时 量大小怎么比较呢? 量大小怎么比较呢? 看“x+y/4”的大小 + (2)等质量的烃完全燃烧时,耗氧量大小 )等质量的烃完全燃烧时, 的大小 怎么比较呢? 怎么比较呢? 质量分数H%越大, 完全燃烧时(假设温度 (3)气态烃 质量分数 %越大,即y/x值越大,耗氧量越大 )气态烃CxHy完全燃烧时/ 值越大 完全燃烧时(值越大, 100 ℃以上,水为气态):气体△V =V后- 以上,水为气态):气体△
烷烃

有多种等长的最长碳链可供选择时,应选择取代基最多
的碳链为主链。 CH3-CH2-CH—CH-CH2-CH3 3 4 CH3— —CH3 2 CH CH 5 1 CH3 CH3 6
② 编号——从靠近支链的一端开始,编号时应尽可能
使取代基具有最低编号。
两端一样长时,从小取代基一端开始编号。 CH3CH2CHCH2CHCH2CH3 CH3 CH2CH3
C、2mol
D、6mol
3、 写出下列烷烃的分子式:
(1)含有38个碳原子的烷烃的分子式
(2)含有38个氢原子的烷烃的分子式 (3)相对分子量为128的烷烃的分子式
正丁烷
异丁烷
名称 正丁烷 异丁烷
熔点/℃ -138.4 -159.6
沸点/℃ 相对密度 -0.5 0.5788 -11.7 0.557
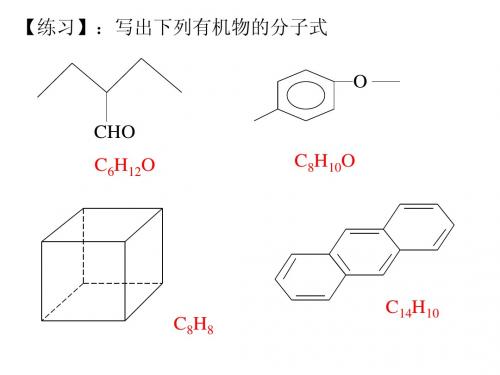
2、立方烷是一种新合成的烃,其分子 结构为正方体,碳架结构如图所示: (1)立方烷的分子式为? C8H8 (2)该立方烷的二氯代物具有同分异 构体的数目是? 三种
4:
1 互为同位素,___ 2 是同 下列五组物质中___ 素异形体,___ 5 是同分异构体,___ 4 是同 系物,___ 3 是同一物质。
沸点/ ℃
-164 -88.6 -42.1 -0.5 36.1 301.8
相对 密度
0.466 0.572 0.585 0.5788 0.6262 0.7780
水溶性 不溶 不溶 不溶 不溶 不溶 不溶
分析表3-1烷烃的结构简式,写出对应的分子式。相邻
两个烷烃结构和分子组成上有什么联系?
五. 烷烃的命名
1.直链烷烃的命名
与普通命名法基本相同,但不用“正”字。
戊
第一章第三节烯烃(第一课时)

第三节:烯烃(第一课时)主备人:陆劲松审核人:曹飞审核签字:【学习目标】:1、了解烯烃的通式、物理性质2、掌握的命名方法3、熟记烯烃的化学性质。
【学习重、难点】:烯烃的化学性质(不对称分子与不对称烯烃的加成反应、烯烃的加聚反应)【学习方法】:阅读法、讨论法、理论推导法。
(阅读选5 课本28、32~36面)预习案一、烯烃(单烯烃)单烯烃是指分子中只含有一个碳碳双键的链烃1、通式:(常见的单烯烃:C2H4、C3H6、C4H8)2、命名:与烷烃命名类似:步骤:选主链,称某烯;编号码,定支链;取代基写在前,注位置用短线;不同基,简在前;相同基、合并算。
不同的是:①要选为主链②要从开始编号③写名称是要用标出的位置。
2、物理性质:熔沸点:密度水溶解度:不溶于易溶于3、化学性质:(1)燃烧:用通式表示烯烃的燃烧化学方程式_____________________________(2)氧化反应:能使 褪色。
(3)加成反应:(能与Br 2、H 20 、HBr 等)R —CH=CH 2通入溴水中____________________________________________R —CH=CH 2与水的反应________________________________________R —CH=CH 2与溴化氢反应______________________________________(4)加聚反应:n CH 2 探究案探究点一:烯烃的命名1、下列有机物的名称肯定错误的是( )A .2-甲基-1-丁烯B .2,2-二甲基丙烷C .5,5-二甲基-3-己烯D .4-甲基-2-戊烯2、写出下列物质的结构简式:(1)3,5-二甲基-3-庚烯:(2) 3-乙基-1-辛烯:探究点二:烯烃的性质1、由乙烯推测丙烯的结构或性质正确的是( )A .分子中所有原子在同一平面上B .与HCl 加成只生成一种产物.C .能使KMnO 4酸性溶液褪色D .能与溴水发生取代反应而使溴水褪色2、1-丁烯在一定条件下发生加聚反应的产物是( )A 、-CH 2-CH-CH 2-CH 3-nB 、-CH 2-CH-nC 、-CH 2-CH-CH 2-nD 、-CH 2-CH-CH 2-nCH 2-CH 3CH 3CH 3训练案1、下列化合物中,在常温常压下以液态形式存在的是( )A 、乙烯B 、丁烷C 、丙烯D 、1-庚烯2、下列关于烯烃的叙述中不正确的是:( )A 、烯烃都含碳碳双键B 、烯烃中所有的原子都在同一平面内C 、易发生加成反应D 、能使酸性高锰酸钾溶液或溴水褪色3、下列反应中,产物一定是纯净物得是:( )A 、CH3CH=CH2与HClB 、CH3CH=CH2的加聚C 、CH3CH=CHCH3与HBr 加成D 、CH3CH3与Cl2的取代反应4、下列物质,不可能是丙烯的加成产物的( )A 、CH3CH2CH3B 、CH3CH2CHCl2C 、CH3CH2CH2ClD 、CH3CHClCH3 5、某烯烃与H 2加成后的产物是CH 3-CH-CH-C(CH 3)2,则该烯烃的结构式可能有 ( ) A 、1种 B 、2种 C 、3种 D 、4种6、下列关于聚乙烯的有关说法,正确的是( )A .聚乙烯为纯净物B .聚乙烯可使溴水褪色C .聚乙烯的单体可作果实催化剂D .聚乙烯可使KMnO4溶液褪色7.某气态烃1mol 能和1molHCl 完全加成,加成后产物分子上的氢原子又可被5molCl2取代,则此气态烃可能是( )A .CH3CH=CH2B .CH2=CH2C .CH2=CHCH2CH3D .CH2=C(CH3)2CH 3CH 3学习反思:。
第三节 烃.烷烃的化学性质ppt

烃
第二课时 烷烃的化学性质
知识回顾:
1、甲烷的结构
成键方式、空间构型、分子式、电子式、 结构式、结构简式等。
2、甲烷的化学性质
(1)氧化反应: (2)取代反应: (3)甲烷的高温热分解
常见烷烃的球棍模型
甲 烷
乙 烷
丁 烷
丙 烷
异 丁 烷
思考:甲烷、乙烷、丙烷、丁烷在结构上有什么共同点?
二、烷烃
1、烷烃的结构特点
(1)饱和链烃: C—C可旋转、链状、锯齿形。
(2)以C为中心ห้องสมุดไป่ตู้四面体构型。
(3)分子中含有碳氢极性键和碳碳非极性键。 (4)通式:CnH2n+2 注意:该通式只表示烷烃; 由通式可算出烷烃的含碳量、含氢量; 烷烃共价键总数:3n+1。
2、烷烃的化学性质
(1)稳定性 常温下不活泼,与强酸、强碱、强氧化剂和还原 剂都不发生反应。不能使溴水、溴的四氯化碳溶液和 高锰酸钾溶液褪色。 (2)取代反应
在光照条件下,烷烃与卤素单质发生取代反应。
甲烷跟氯气反应化学方程式:
CH
4
Cl
2
CH 3 Cl HCl
光
光
一氯甲烷(g),一氯代物
CH 3 Cl Cl 2 CH 2 Cl 2 HCl
二氯甲烷(l),二氯代物
CH 2 Cl 2 Cl 2 CHCl Cl 2 CCl
(4)热分解反应
高温、无氧条件下,烷烃发生分解反应。一般甲烷 高温分解,长链烷烃高温裂化、裂解。
CH4 C4H10 C4H10
高温 △
C+2H2 C2H4+C2H6 CH4+C3H6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节烃
【复习目标】
1、掌握烯烃、炔烃的命名规则。
2、掌握烷烃、烯烃、炔烃、苯及其苯的同系物的化学性质。
【复习重难点】
1.烷烃、烯烃、炔烃、苯及其苯的同系物的化学性质。
2.能从结构上分析烷烃与烯烃、炔烃化学性质的不同,烯烃与炔烃化学性质相似的原因。
【教学过程】
一、烃的概述
1.根据来源和性质人们将烃分为什么?
2.烯烃和炔烃的命名规则与烷烃类似,不同的是哪几方面?
3.烷烃、烯烃和炔烃具有哪些相似的物理性质?
4.苯的物理性质有哪些特点?
练习
1.下列有机物中(1)属于开链脂肪烃的是_______________,(2)属于芳香烃的是________,(3)属于苯的同系物的是________。
(4)属于脂环烃的是
2.对下列物质进行系统命名:
CH = CH CH
3 C —CH3
CH3
CH3
3
CH3
—CH3
①CH2
= CH
CH2CH3
②CH3 CH = CH —CH —CH3
CH3
③CH3—C
CH3
= CH —CH
CH3
—CH2—CH3
④CH3—CH
CH3
—C = CH2
CH3
3.下列各组物质能用分液漏斗分离的是: ()
A.溴和苯
B.溴和溴苯
C.水和已烷
D.水和硝基苯
二、烷烃、烯烃、炔烃的化学性质
1.烷烃的通式是什么?有哪些化学性质?其特征反应是什么?
2.烯烃的通式是什么?有哪些主要的化学性质?其特征反应是什么?
3.炔烃的通式是什么?有哪些化学性质?其特征反应是什么?
【小组讨论】烯烃与酸性高锰酸钾溶液反应被氧化的部分与氧化产物的对应关系
练习4.既可用来除去甲烷中的丙烯,又可用来鉴别乙烷与丁烯的方法是()A.把气体通入足量液溴中B.在导管口处点燃
C.一定条件下与H2发生加成反应D.把气体通入足量溴水中
练习5、写出2—甲基—2—丁烯被酸性高锰酸钾溶液氧化的方程式:
三、苯及其同系物的化学性质
1.苯分子的结构有哪些特点?
2.苯分子的化学性质有哪些?
3.苯的同系物通式为是什么,主要的化学性质为?.
练习
6.苯环结构中不存在C—C与C=C的简单交替结构,可以作为证据的事实是()①苯不能使酸性KMnO4溶液褪色②苯不能使溴水因化学反应而褪色
③经实验测定只有一种结构的邻二甲苯④苯能在加热和催化剂条件下氢化成环己烷⑤苯中相邻C、C原子间的距离都相等。
A.只有①②B.只有④⑤
C.只有①②⑤D.只有①②③⑤。
