陌生方程式书写专练
10、《陌生情景中化学方程式的书写》-专题练习hw
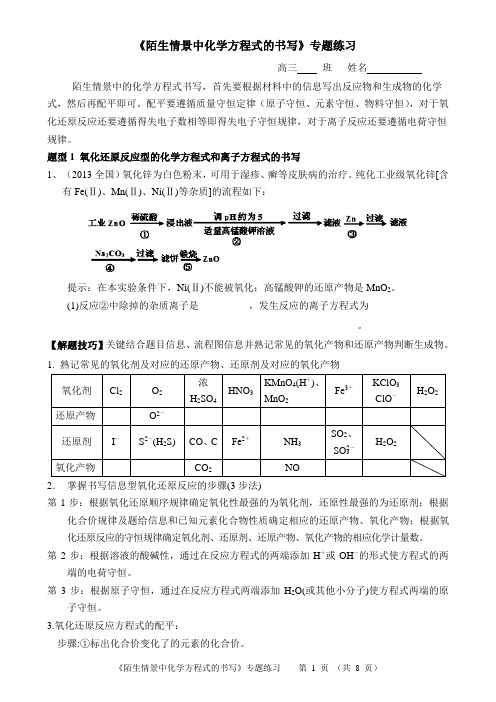
《陌生情景中化学方程式的书写》专题练习高三班姓名陌生情景中的化学方程式书写,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。
配平要遵循质量守恒定律(原子守恒、元素守恒、物料守恒),对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应还要遵循电荷守恒规律。
题型1 氧化还原反应型的化学方程式和离子方程式的书写1、(2013全国)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________________________________________________________。
【解题技巧】关键结合题目信息、流程图信息并熟记常见的氧化产物和还原产物判断生成物。
1. 熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物2.掌握书写信息型氧化还原反应的步骤(3步法)第1步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第2步:根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
第3步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
3.氧化还原反应方程式的配平:步骤:①标出化合价变化了的元素的化合价。
②列变化:分别标出化合价升高数和化合价降低数③根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
④利用元素守恒,观察配平其他物质4. “补缺”的技巧(1)可能出现的情况:H +→H 2O (酸性)、 OH -→H 2O (碱性)、H 2O →H +(中性或酸性)、H 2O →OH -(中性或碱性)(2)绝不可能出现的情况:H +→OH - 或者OH -→H +【对点集训】2、(2013北京)在酸性条件下,将MnO -4氧化Fe 2+的离子方程式补充完整: MnO -4+ Fe 2++ ________=== Mn 2++ Fe 3++ ________。
A陌生化学方程式书写专项练习

陌生化学方程式书写专项练习1.复分解反应:首先确定反应物没有常见氧化剂,还原剂,然后按照复分解反应特征,相互交换成分,组成新的物质。
2.氧化还原反应:熟记常见的氧化还原反应,常见的氧化剂,还原剂,根据氧化还原反应规律以及各物质的性质,题目所给条件等推测产物。
1.S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化学方程式是。
2.欲降低废水中重金属元素铬的毒性,可将转化为Cr(OH)3沉淀除去。
工业用电解法来处理含废水。
阳极反应式是Fe-2e-=Fe2+,阴极反应式是2 H+ +2e-=H2↑。
Fe2+与酸性溶液中的反应的离子方程式是,得到的金属阳离子在阴极区可沉淀完全。
3.通空气的条件下煅烧铬铁矿(主要成分可表示为FeO·Cr2O3)和NaOH的固体混合物生成Na2CrO4和NaFeO2反应的化学方程式是。
4.石灰乳中通入Cl2 ,得到Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反应的化学方程式是。
5.CaCl2溶液中通入NH3和CO2两种气体后,生成超细CaCO3的化学方程式是。
6.将含Cr2O72﹣的废水调至pH为2~3,再加入Na2S2O3溶液(转化为SO42﹣),该反应发生时,每0.4 mol Cr2O72-转移2.4 mol e-,该反应的离子方程式为。
7.铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式:。
8.氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式。
科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为。
9.已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8 mol电子。
该反应的离子方程式是。
10.SO2气体通入足量BaCl2和硝酸的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是。
完整word版,2018届二轮复习陌生方程式的书写训练专题练习

2018届二轮复习专题之陌生方程式的书写训练班姓名书写陌生(信息型)化学方程式时,应先根据信息确定反应物纪最终产物,再根据化合价升降法来配平,若无法判断最终产物,可先确定中间产物,再用叠加法来确定总化学方程式。
第一部分氧化还原反应类型1、(2013北京)在酸性条件下,将MnO-4氧化Fe2+的离子方程式补充完整:MnO-4+Fe2++________===Mn2++Fe3++________。
2、(2015浙江)完成以下氧化还原反应的离子方程式:( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________3、(2012全国)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:。
4、氧化还原反应是氧化和还原两个过程的对立统一。
现有一个还原过程的反应式如下:NO-3+4H++3e-===NO↑+2H2O(1)下列五种物质中能使上述还原过程发生的是________(填字母)。
A.KMnO4B.Na2CO3C.Cu2O D.Fe2(SO4)3(2)写出上述反应的化学方程式并配平:。
5、(2013江苏)氧化镁在医药、建筑等行业应用广泛。
硫酸镁还原热解制备高纯氧化镁是一种新的探索。
以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:(1)MgCO3与稀硫酸反应的离子方程式为。
(2)加入H2O2氧化时,发生反应的化学方程式为。
6、生产硫化钠大多采用无水芒硝(Na2SO4)-碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:________________________________________________________。
7、向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式:_____________________________________________________________________________________。
陌生化学方程式书写专项练习

陌生化学方程式书写专项练习1.(东I)S2Cl2与水反映,有无色刺激性气味气体产生,并有黄色沉淀生成,该反映的化学方程式是。
2.(东I)欲降低废水中重金属元素铬的毒性,可将Cr2O72−转化为Cr(OH)3沉淀除去。
工业用电解法来处置含Cr2O72−废水。
阳极反映式是Fe-2e-=Fe2+,阴极反映式是2 H+ +2e-=H2↑。
Fe2+与酸性溶液中的Cr2O72−反映的离子方程式是,取得的金属阳离子在阴极区可沉淀完全。
3.(西I)通空气的条件下煅烧铬铁矿(主要成份可表示为FeO·Cr2O3)和NaOH的固体混合物生成Na2CrO4和NaFeO2反映的化学方程式是。
4.(朝I)石灰乳中通入Cl2 ,取得Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反映的化学方程式是。
5.(朝I)CaCl2溶液中通入NH3和CO2两种气体后,生成超细CaCO3的化学方程式是。
6.(海I)将含Cr2O72﹣的废水调至pH为2~3,再加入Na2S2O3溶液(转化为SO42﹣),该反映发生时,每mol Cr2O72-转移mol e-,该反映的离子方程式为。
7.(丰I)铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反映式:。
8.(石I)氨气在纯氧中燃烧,生成一种单质和水,试写出该反映的化学方程式。
科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反映的电极反映式为。
9.(东II)已知Na2S2O3溶液与Cl2反映时,1mol Na2S2O3转移8 mol电子。
该反映的离子方程式是。
10.(西II)SO2气体通入足量BaCl2和硝酸的混合溶液中,生成白色沉淀和无色气体,反映的离子方程式是。
11.(西II)直接加热AlCl3·6H2O不能取得无水AlCl3。
陌生化学方程式的书写专题训练

陌生化学方程式的书写专题训练1.KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是。
2.在NaOH的环境中,Cl2与NaI反应,每1 mol NaI完全反应转移6 mol 电子,写出反应的化学方程式:。
3.已知CO是工业上常用的还原剂,500℃时,11.2 L(标准状况)SO2在催化剂作用下与CO发生化学反应。
若有2×6.02×1023个电子转移时,写出该反应的化学方程式。
4.铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入,铜屑可以逐渐溶解,该反应的离子方程式:。
5.氧化还原反应中实际上包含氧化和还原两个过程。
下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
写出并配平该氧化还原反应的方程式:6.某同学取FeSO4的溶液,酸化后加入KI、淀粉溶液,变为蓝色。
写出与上述变化过程相关的离子方程式:、。
7.(1)在强碱性环境中Cl2可将Fe(OH)3氧化为K2FeO4,学出该反应的离子方程式:。
(2)在溶液中用次氯酸钠、氢氧化铁和氢氧化钾也可制高铁酸钾,其反应的离子方程式为:。
(3)已知K2FeO4溶液中在酸性溶液中会迅速反应产生Fe2(SO4)3,则离子方程式为。
8.工业上利用KOH和MnO2为原料制取KMnO4。
主要生产过程分两步进行:其中第一步是将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;该步反应的化学方程式为_______ __________________。
9.污水及自来水处理的方法有很多(1)碱性环境下,Cl2可将水中的CN-转化为两种无毒的气体,写出该反应的离子方程式:。
(2)酸性环境下,向含重铬酸根的废水中加入FeSO4溶液,然后调节溶液的pH,使生成的Cr3+转化为Cr(OH)3,写出第一步对应的离子方程式:。
陌生方程式书写

陌生方程式的书写1. SOCl 2是一种液态化合物,向盛有水的锥形瓶中滴加几滴SOCl 2,剧烈反应,瓶中有白雾形成,并带有刺激性气味气体逸出,该气体中含有可使品红褪色的SO 2,待白雾消失后,向溶液中滴加硝酸银溶液,有不溶于硝酸的白色沉淀析出。
写出SOCl 2与水反应的化学方程式_______________________________________________________________2. (1)工业上煅烧黄铁矿(FeS 2)的烧渣(主要成分是Fe 2O 3及FeS ,SiO 2),将烧渣溶于稀硫酸过程中,先是固体大部分被溶解,接着有单质硫生成,写出该反应(只写生成硫)的离子方程式____________________________________________________________(2)Fe(NO 3)3溶液中加入Na 2SO 3溶液,溶液先由棕色变绿色,离子方程式为_______________________________过一会又变棕黄色,离子方程式为_________________________________(3)LiFePO 4(难溶于水)被视为最有前途的锂离子电池材料之一,以FePO 4(难溶于水),Li 2CO 3,单质碳为原料在高温条件下制备LiFePO 4,该反应还可以生成一种可燃性气体,则反应方程式为___________________________________3、 含有较多Ca 2+、Mg 2+的水称为硬水,长期饮用硬水,会患消化系统和泌尿系统疾病。
烧硬水过程中形成水垢,不及时清除会造成导热不良、浪费燃料等。
(1)锅炉水垢中的CaSO 4,可用Na 2CO 3溶液处理,使之转化为疏松、易溶于酸的CaCO 3,写出转化的化学方程式_______________________(2)向处理后的水垢中加入NH 4Cl 溶液,水垢即可溶解。
陌生情景中化学方程式的书写专题训练及答案

陌生情景中化学方程式的书写专题训练化学方程式是化学科学的一套独特的符号系统,有其书写和使用的规范,在书写化学方程式时要遵循质量守恒定律,对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应遵循电荷守恒规律。
陌生情景中(信息型)的化学方程式书写时,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。
配平化学方程式的办法和技巧很多。
但归根到底,都是依据上述的三个基本规律。
1.高锰酸钾在水溶液中放出活性氧,起到消毒作用,同时生成+4价的氢氧化锰和氢氧化钾。
若活性氧用[O]来表示,请写出该反应的化学方程式2.(原创)铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2→FeO42-+Cl-+H2O,该反应的离子方程式中H2O的化学计量数是3.某些非金属单质能发生自身氧化还原反应(歧化反应)。
例如,硫在碱液中加热,零价的硫被歧化为负二价态和正四价态;碘在碱液中能歧化为负一价态和正五价态。
试分别写出硫和碘在碱液中发生歧化反应的离子方程式。
4.硫粉、炭粉与硝酸钾混合,可以得到黑火药。
黑火药爆炸的产物与其组成有关。
一般黑火药组成为一硫二硝三碳,爆炸产物为K2S、N2、CO2。
(1)写出黑火药爆炸反应的化学方程式该反应的氧化剂是,还原剂是。
(2)求氧化产物与还原产物的物质的量之比。
5.某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氧化铅,其中Pb为+2价)六种物质,已知Pb(N3)2是反应物之一。
根据你学过的有关化学定律和知识,试写出这个反应的化学方程式。
6.为实现消除碘缺乏病的目标,国家卫生部规定食盐必须加碘,其中碘以碘酸钾或碘化钾的形式存在。
(1)有人烹调时,分别含有碘化钾和碘酸钾的加碘食盐混合,当滴食醋时,产生紫色蒸气,反应的离子方程式为(2)这两种加碘食盐可以在潮湿的空气中曝露而加以鉴别,其原理是,反应的离子方程式为7.铁酸钠(Na2FeO4)是处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成Fe3+离子。
高中化学:陌生化学(离子)方程式的书写 真题演练

专题4-陌生化学(离子)方程式的书写1.(2020年新课标Ⅰ 26题)钒具有广泛用途。
黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO 2、Fe 3O 4。
采用以下工艺流程可由黏土钒矿制备NH 4VO 3。
矾矿粉NH 4VO 330%H SO NaOHNaOHHClNH ClMnO 2 滤渣滤液滤渣 滤渣 滤渣该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示:回答下列问题:(1)“酸浸氧化”需要加热,其原因是________________________________。
(2)“酸浸氧化”中,VO +和VO 2+被氧化成VO +2,同时还有___________离子被氧化。
写出VO +转化为VO +2反应的离子方程式_________________________。
(3)“中和沉淀”中,钒水解并沉淀为V 2O 5·x H 2O ,随滤液②可除去金属离子K +、Mg 2+、Na +、___________,以及部分的__________________。
(4)“沉淀转溶”中,V 2O 5·x H 2O 转化为钒酸盐溶解。
滤渣③的主要成分是___________。
(5)“调pH ”中有沉淀生产,生成沉淀反应的化学方程式是_________________________。
(6)“沉钒”中析出NH 4VO 3晶体时,需要加入过量NH 4Cl ,其原因是________________________________。
2.(2020年新课标Ⅰ 27题)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni 、Al 、Fe 及其氧化物,还有少量其他不溶性物质。
采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO 4·7H 2O ):硫酸镍晶体滤渣滤液滤渣NaOH 溶液NaOH 溶液稀H SO H O 溶液溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示:金属离子 Ni 2+ Al 3+ Fe 3+ Fe 2+ 开始沉淀时(c =0.01 mol·L −1)的pH沉淀完全时(c =1.0×10−5 mol·L −1)的pH7.2 8.73.74.72.23.27.5 9.0回答下列问题:(1)“碱浸”中NaOH 的两个作用分别是______________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
陌生方程式书写专练
1.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2。
生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
2.生产硫化钠大多采用无水芒硝(Na2SO4)-碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
3.向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式:________________________________________________________________________
________________________________________________________________________。
4.向含Cr2O2-7的酸性废水中加入FeSO4溶液,使Cr2O2-7全部转化为Cr3+。
写出该反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
5.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),该反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
6.(1)AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式:________________________________________________________________________。
(2)氢能是一种极具发展潜力的清洁能源,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。
其反应过程如下图所示:
反应Ⅰ的化学方程式:_____________________________________________________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO2-3将NO2转化为NO-2,其离子方程式:_________________________________________________________。
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)H3PO2的工业制法:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。
写出白磷与Ba(OH)2溶液反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(6)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO2-4而实现SO2的处理(总反应为2SO2+O2+
2H 2O===2H 2SO 4)。
已知含SO 2的废气通入含Fe 2+、Fe 3+的溶液时,其中一个反应的离子方程式为4Fe 2++O 2+4H +===4Fe 3++2H 2O ,则另一反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
(7)废旧干电池中的MnO 2与FeS 在70 ℃的硫酸中浸取,生成MnSO 4和Fe 2(SO 4)3的化学方程式:
________________________________________________________________________。
7.(1)用阴离子交换膜控制电解液中OH -的浓度制备纳米Cu 2O ,反应为2Cu +H 2O=====电解
Cu 2O +H 2↑,装置图如下所示。
该电解池的阳极反应式:
________________________________________________________________________
________________________________________________________________________。
(2)储氢可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:环己烷
(g) FeSO 4/Al 2O 3高温
苯(g)+3H 2(g) 一定条件下,下图装置可实现有机物的电化学储氢(忽略其他有机物)。
生成目标产物的电极反应式为________________________________________________________________________
________________________________________________________________________。
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如下图所示。
电解时b 极上生成乙烯的电极反应式为
________________________________________________________________________
________________________________________________________________________。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以CO 2和H 2O 合成CH 4。
写
出铜电极表面的电极反应式:
________________________________________________________________________
________________________________________________________________________。
(5)在微电子工业中NF 3常用作氮化硅的蚀刻剂,工业上通过电解含NH 4F 等的无水熔融物生产NF 3,其电解原理如图所示。
a 电极为电解池的________极,写出该电极的电极反应式:________________________________________________________________________
________________________________________________________________________。
