核外电子排布与元素周期表(PPT39页)
合集下载
原子核外电子排布与元素周期表

习题处理
二、核外电子排布与元素周期表
1.周期表是依据什么原则建构的?
思考:
2.周期表中,各周期元素种类数为何依次为2,8,8,18,18,32 ,…?
3.为何原子的最外层电子数不超过8个(He不超过2个), 次外层不超过18个,倒数第三层不超过32个?
4.各周期元素的外围电子分别填充在哪些原子轨道中? 5.s区、p区、d区和f区分别在周期表的什么位置?
• 【例题5】对于基态的Fe2+和Fe3+, 1. 写出它们的核外电子排布式。 2. 写出它们简写的离子轨道表示式。
【课后练习】
• 1、对于下列基态原子,填写表中空白:
Ni
Cl
Zr
Pm
核外电子 排布式
简写的电 子排布式
原子轨道 表示式
原子中未 成对电子 数
• 对于下列基态离子填写表中空白:
Cl电子排布式
• 概念:
• 在原子外层轨道上的电子由于能量较高, 因此一般化学反应只涉及外层原子轨道上 的电子,这些电子称为价电子(valence electron)。
应用
根据周期表中各周期元素原子轨道的类型填写基态原子的 电子排布式。
1.从H原子开始填写。 2.按照原子序数递增的顺序依次填写各元素。 3.同一周期从左→右, • 经过IA和IIA是,将电子填入ns轨道中,——s区 • 经过IIIA-0族时,将电子填入np轨道中,——p区 • 经过IIIB-IIB时,将电子填入(n-1)d轨道中,——d区 • 经过镧系元素和锕系元素时,将电子填入(n-2)f轨道
6.如何从核外电子排布看稀有气体是各周期中最稳定的元 素?
7.d电子从 周期开始出现,即(n-1)d,n≥ ? f电子从 周期开始出现,即(n-2)f,n≥ ?
二、核外电子排布与元素周期表
1.周期表是依据什么原则建构的?
思考:
2.周期表中,各周期元素种类数为何依次为2,8,8,18,18,32 ,…?
3.为何原子的最外层电子数不超过8个(He不超过2个), 次外层不超过18个,倒数第三层不超过32个?
4.各周期元素的外围电子分别填充在哪些原子轨道中? 5.s区、p区、d区和f区分别在周期表的什么位置?
• 【例题5】对于基态的Fe2+和Fe3+, 1. 写出它们的核外电子排布式。 2. 写出它们简写的离子轨道表示式。
【课后练习】
• 1、对于下列基态原子,填写表中空白:
Ni
Cl
Zr
Pm
核外电子 排布式
简写的电 子排布式
原子轨道 表示式
原子中未 成对电子 数
• 对于下列基态离子填写表中空白:
Cl电子排布式
• 概念:
• 在原子外层轨道上的电子由于能量较高, 因此一般化学反应只涉及外层原子轨道上 的电子,这些电子称为价电子(valence electron)。
应用
根据周期表中各周期元素原子轨道的类型填写基态原子的 电子排布式。
1.从H原子开始填写。 2.按照原子序数递增的顺序依次填写各元素。 3.同一周期从左→右, • 经过IA和IIA是,将电子填入ns轨道中,——s区 • 经过IIIA-0族时,将电子填入np轨道中,——p区 • 经过IIIB-IIB时,将电子填入(n-1)d轨道中,——d区 • 经过镧系元素和锕系元素时,将电子填入(n-2)f轨道
6.如何从核外电子排布看稀有气体是各周期中最稳定的元 素?
7.d电子从 周期开始出现,即(n-1)d,n≥ ? f电子从 周期开始出现,即(n-2)f,n≥ ?
高三化学总复习之 元素周期律PPT课件
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III
B
IV B
VB
VI B
VII B
VIII
IB
II 1 B3
1 4
1 5
1 6
1 7
1 8
M L k
18 8 2
最4 外
1 9
2 0
2 1
2 2
2 3
24
25
26
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
层5 电
3
71
3
82
3 9
4 0
4 1
增 强
Rb Sr In Sn Sb Te I
酸 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
第20页/共31页
3.气态氢化物的热稳定性
热稳定性增强
热 稳 定 性 减 弱
B CNO F
热
Si P S Cl
稳
定
As Se Br
性
Te I
增 强
At
热稳定性减弱
第21页/共31页
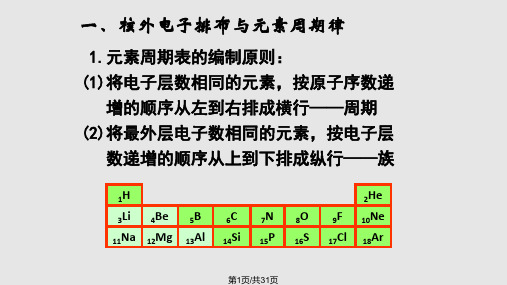
一、核外电子排布与元素周期律
1.元素周期表的编制原则: (1)将电子层数相同的元素,按原子序数递
增的顺序从左到右排成横行——周期 (2)将最外层电子数相同的元素,按电子层
数递增的顺序从上到下排成纵行——族
1H
2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
核外电子的排布规律和元素周期表

二、原子的价电子层结构
(1)基态原子的价层电子构型
价层——价电子所在的亚层 价层电子构型——指价层的电子分布式
ⅠA
0
一 1 ⅡA
1s1
ⅢA ⅣA ⅤA ⅥA ⅦA 2 1s2
二3 4
5 6 7 8 9 10
三 11 12 ⅢBⅣBⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 13 14 15 16 17 18
几率峰出现, 相当于电子靠近核, 受核 作用强, 同时回避了内层电子的屏蔽作 用, 自身能量下降. 这种效应称为钻穿 效应。
可以用钻穿效应解释能级分裂, 即同一
能级组(n 相同), l 大的电子能量高,
l 小的电子可以钻入内部, 自身能量降 低, 产生能级分裂。总之, 屏蔽效应使 电子的能量上升, 钻穿效应使电子能降 低。
原子实——原子中除去最高能级组以外 的原子实体
三、元素周期律与核外电子排布的关系
最后一个电子填入s亚层
ⅠA
1、分区
0
一
二 三
1131S最Ⅱ142A后Ⅲ一B Ⅳ个BⅤ电B Ⅵ子B一ⅦB般填Ⅷ入次Ⅰ外BⅡ层BⅢd153A亚Ⅳ164层AⅤ175ApⅥ186AⅦ197A
2
10 18
四 19
20
21
22 23
(6) 当被屏蔽电子是(nd)组或(nf)组电子
时,同组电子屏蔽为0.35,左边各组电子 屏为1.00。 在计算某原子中某个电子的值时,可将有关 屏蔽电子对该电子的值相加而得。 例:计算铝原子中其它电子对一个3P电子的 值,其Z* =? 解:按斯来特规则分组 (1S)2(2S,2P)8( 3S,3P)3
= 0.35×2 + 0.85 ×8 + 1.00 ×2 = 9.50 Z* = Z – = 13–9.50 = 3.5
(1)基态原子的价层电子构型
价层——价电子所在的亚层 价层电子构型——指价层的电子分布式
ⅠA
0
一 1 ⅡA
1s1
ⅢA ⅣA ⅤA ⅥA ⅦA 2 1s2
二3 4
5 6 7 8 9 10
三 11 12 ⅢBⅣBⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 13 14 15 16 17 18
几率峰出现, 相当于电子靠近核, 受核 作用强, 同时回避了内层电子的屏蔽作 用, 自身能量下降. 这种效应称为钻穿 效应。
可以用钻穿效应解释能级分裂, 即同一
能级组(n 相同), l 大的电子能量高,
l 小的电子可以钻入内部, 自身能量降 低, 产生能级分裂。总之, 屏蔽效应使 电子的能量上升, 钻穿效应使电子能降 低。
原子实——原子中除去最高能级组以外 的原子实体
三、元素周期律与核外电子排布的关系
最后一个电子填入s亚层
ⅠA
1、分区
0
一
二 三
1131S最Ⅱ142A后Ⅲ一B Ⅳ个BⅤ电B Ⅵ子B一ⅦB般填Ⅷ入次Ⅰ外BⅡ层BⅢd153A亚Ⅳ164层AⅤ175ApⅥ186AⅦ197A
2
10 18
四 19
20
21
22 23
(6) 当被屏蔽电子是(nd)组或(nf)组电子
时,同组电子屏蔽为0.35,左边各组电子 屏为1.00。 在计算某原子中某个电子的值时,可将有关 屏蔽电子对该电子的值相加而得。 例:计算铝原子中其它电子对一个3P电子的 值,其Z* =? 解:按斯来特规则分组 (1S)2(2S,2P)8( 3S,3P)3
= 0.35×2 + 0.85 ×8 + 1.00 ×2 = 9.50 Z* = Z – = 13–9.50 = 3.5
核外电子排布与元素周期表

P S 110 104
K 227
Rb 248 Cs 265
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 197 161 145 132 125 124 124 125 125 128 133 122 122 121
Se 117
Br 114Байду номын сангаас
Kr 198
Xe 217
Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I 215 181 160 143 136 136 133 135 138 144 149 163 141 141 137 133 Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po 217 188 159 143 137 137 134 136 136 144 160 170 175 155 153
Au
Hg Tl
[Xe]4f145d106s1
[Xe]4f145d106s2 [Xe]4f145d106s26p1
82
83 84
Pb
Bi Po
[Xe]4f145d106s26p2
[Xe]4f145d106s26p3 [Xe]4f145d106s26p4
85
86
At
Rn
[Xe]4f145d106s26p5
(四)
31
32 33 34 35 36
Ga
Ce As Se Br Kr
[Ar]3d104s24p1
[Ar]3d104s24p2 [Ar]3d104s24p3 [Ar]3d104s24p4 [Ar]3dl04s24p5 [Ar]3d104s24p6
37 38 39 40
核外电子排布与周期律

核外电子排布与周期律
2020年5月31日星期日
•第一单元 •核外电子排布与周期律
•一、原子核外电子的排布 •二、元素周期律 •三、元素周期表及其应用
•
•复 •原子结构示意图
习
•第2电子层L •第层1电子层K层
•第3电子层M 层
•原子 核
•+•1 •2 •8 •6
6
•S
•核电荷数 即质子数
•
•原子结构
,
•
•归纳 •元素的金属性、非金属性强弱判断 •一、从物质的性质上判断 •信息提示!•P5页
•金属性越强:
•非金属性越强:
•1.越容易从水或酸 • 中置换出氢
•1.与氢气化合越容易 , •气态氢化物越稳定
•2.最高价氧化物的 •2.最高价氧化物的 • 水化物碱性越强 • 水化物酸性越强
•
•归纳 •元素的金属性、非金属性强弱判断 •二、从物质的结构上判断
数相•同交)随流着与核讨电荷论数的•递P4增页,原子半径逐渐减小。
•?
• •元原素子的序数性=质核是电否荷也数呈=质子数 周期性的变化?
•
•
•活动与探究 •P5页 •探究活动 1
•实验
•物质 11Na 12Mg 13Al
•与水 •与冷水反应 •剧烈 的反应 •与热水反应
•缓慢 •较快
•与盐酸反应
•碱性减弱
•酸性增强
•
•探究活动 2 •P6页
•
•探究活动 3 •P6页
•
•探究活动 3 •P7页 •问题
•(1) •碱性减弱 •酸性增强
;
• •金属性减 •非金属性增强 。 弱
•(2) •+1价 → +7价 ,•- 4价 → -1价 。
2020年5月31日星期日
•第一单元 •核外电子排布与周期律
•一、原子核外电子的排布 •二、元素周期律 •三、元素周期表及其应用
•
•复 •原子结构示意图
习
•第2电子层L •第层1电子层K层
•第3电子层M 层
•原子 核
•+•1 •2 •8 •6
6
•S
•核电荷数 即质子数
•
•原子结构
,
•
•归纳 •元素的金属性、非金属性强弱判断 •一、从物质的性质上判断 •信息提示!•P5页
•金属性越强:
•非金属性越强:
•1.越容易从水或酸 • 中置换出氢
•1.与氢气化合越容易 , •气态氢化物越稳定
•2.最高价氧化物的 •2.最高价氧化物的 • 水化物碱性越强 • 水化物酸性越强
•
•归纳 •元素的金属性、非金属性强弱判断 •二、从物质的结构上判断
数相•同交)随流着与核讨电荷论数的•递P4增页,原子半径逐渐减小。
•?
• •元原素子的序数性=质核是电否荷也数呈=质子数 周期性的变化?
•
•
•活动与探究 •P5页 •探究活动 1
•实验
•物质 11Na 12Mg 13Al
•与水 •与冷水反应 •剧烈 的反应 •与热水反应
•缓慢 •较快
•与盐酸反应
•碱性减弱
•酸性增强
•
•探究活动 2 •P6页
•
•探究活动 3 •P6页
•
•探究活动 3 •P7页 •问题
•(1) •碱性减弱 •酸性增强
;
• •金属性减 •非金属性增强 。 弱
•(2) •+1价 → +7价 ,•- 4价 → -1价 。
核外电子排布与周期律PPT课件

递变性(从上至下,金属性增强,非金属性减弱) 递变性(从左到右,金属性减弱,非金属性增强)
元素周期律及元素周期表 的三大意义
⑴ 学习和研究化学的规律和工具
⑵ 研究发现新物质
预言新元素,研究新农药,寻找半导 体材料、催化剂、耐高温耐腐蚀材料。
⑶ 论证了量变引起质变的规律性
二、离子键
1、定义: 使阴阳离子结合成化合物的静电 作用,叫做离子键。
核外电子排布与 周期律
回顾 随着原子序数的递增
元素原子的核外电子排布
元素原子半径 元素主要化合价 呈现周期性变化
元素性质的递变规律
项目
核电荷数 电子层数 原子半径 化合价
同周期(左→右) 逐渐增大 相 同 同主族(上→下) 增 增 大 多
逐渐减小
最高正价:+1 →+7
负化合价:- 4 → -1
逐渐增大
4.氢键对物质性质的影响 ⑴氢键的存在使物质的熔沸点相对较高
⑵解释一些反常现象:如水结成冰时, 为什么体积会膨胀。
一 碳的几种同素异形体
名称 硬度 颜色 深灰, 有金属 光泽 透明 导电性 化学性质 结构
石墨
较软
导电 不导电
能燃烧 能燃烧
层片状 正四面 体型
金刚石 非常坚 硬
二
氧的同素异形体
用电子式表示下列共价分子的形成过程
· · · · · · · · 碘 : I ·+ ·I : → : I: I: · · · · · ·· · · · 水 2 + ·O ·→ H ﹕O﹕ H · · H· · · + ·S · → H ﹕S ﹕H 硫化氢 2 · · H· H · ﹕ + ·N → H ﹕N 氨 3 · H· H · · · + 2 ·O · ﹕ C﹕ ﹕O C· → O﹕ 二氧化碳 · · · ·
原子核外电子的排布 课件
1
单质与水(或酸)反应
最高价氧化物对应的水化物 碱性强弱
①常温或加热下遇水 Al _无__明__显__现__象__
②与酸反应__剧__烈_
Al(OH)3:_两__性__氢___氧__化__物_
结论
Na、Mg、Al的金属性逐渐_减___弱_
②硅、磷、硫、氯的非金属性的递变规律
Cl、S、P、Si
HClO4>H2SO4>H3PO4>H2SiO3
第1课时 原子核外电子的排布 元素周期律
一、原子核外电子的排布 什么是电子层?原子核外电子排布的原则是什么? 1.电子层 (1)电子层的含义。 多电子原子里,电子分别在__能__量__不__同__的区域内运动,人们把 不同的区域简化为不连续的壳层,称之为电子层。
(2)电子层表示方法。
电子层n 1 2
【典例3】(2012·大纲版全国卷)元素X形成的离子与钙离子的 核外电子排布相同,且X的离子半径小于负二价硫离子的半径。 X元素为( ) A.Al B.P C.Ar D.K 【思路点拨】解答该题要注意以下三点: (1)Ca2+、P3-、K+均为18e-结构; (2)Al3+为10e-结构,Ar是稀有气体元素; (3)相同核外电子排布的离子随核电荷数递增,离子半径递减。
的核外电子数一定不等于其核电荷数,D错误。
二、元素周期表中元素性质的变化规律
原子半径
从同周期 (从左往右)
减小
主要化合价
金属性
非金属性
单质
氧化性 还原性
+1→+7 -4→-1 减弱 增强
增强
减弱
同主族 (从上到下)
增大
相似(最高正价相同)
第1课时 原子核外电子的排布 元素周期律
路漫漫其修远兮,吾将上下而求索
2.下列有关元素周期律的叙述正确的( A ) A. 元素周期律的本质是元素原子核外电子排布呈周期 性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增 呈周期性变化 D. 元素周期律的本质是元素的性质随原子量的递增而 呈周期性变化
6、已知Xn+、Y(n+1)+、Zn-、R(n-1)-四种粒子都具有相 同的电子层结构,这四种离子半径大小关系是 A A、 Zn- >R(n-1)- >Xn+ >Y(n+1)+ B、 Xn+ > Y(n+1)+ > Zn- >R(n-1)C、 R(n-1)- > Zn- >Y(n+1)+ >Xn+ D、 Xn+ > Zn- >Y(n+1)+ >R(n-1)-
路漫漫其修远兮,吾将上下而求索
二、元素周期律
核电荷数为1-18的元素原子核外电子层排布
路漫漫其修远兮,吾将上下而求索
原子 序数 元素 名称 元素 符号 电子 排布
1
2
氢
H
氦
He
请阅读和比较1-18号元 素的有关数据,从中能找 出什么规律?
1
2
原子半径 0.37 (10-10m) 化合价 + 1
1.22
路漫漫其修远兮,吾将上下而求索
随着原子序数的递增 引起了
最外层电子数1→8
核外电子排布呈周期性变化 (K层电子数1→2) 同周期元素原子半径 大→小 化合价:+1→+7 元素性质呈周期性变化 归纳出 -4→-1
核外电子排布元素周期表详解
门捷列夫
梦中的景象 • 从学生时代开始,门捷列夫就一直对“元素”与 “元素”之间可能存在的种种关联感兴趣,并且 利用一切时间对化学元素进行研究。
不过是十五 • 一天清晨,门捷列夫经过一个夜晚的研究后,疲 倦地躺在书房的沙发上,不知不觉就睡着了。睡
年来的努力! 梦中,他突然清晰地看见元素排列成周期表浮现 在他的眼前,他又惊又喜,随即清醒过来,顺手 记下梦中的元素周期表。 • 因为在梦中得到灵感,元素周期表的发现又被称 为四大名梦之一。
荷数 名称 符 号
K
2 氦 He 2
10 氖 Ne 2
18 氩 Ar 2
各电子层的电子数
L
M
N
O
P
最外层 电子数
2
8
8
88
8
36 氪 Kr 2 8 18 8
8
54 氙 Xe 2 8 18 18 8
8
86 氡 Rn 2 8 18 32 18 8
8
各层最多电子数 2 8 18 32 50 2n2
2020年7月14日
2020年7月14日
练一练
4.指出Br在周期表中的位置 Br:第4周期 ⅦA族
5.某元素位于第二周期,第ⅦA 族,它 是_氟__元素。
2020年7月14日
其 它 周 期 表
其它周期表
一、原子核外电子的排布规律:
能量由低到高。 每层最多容纳2n2个电子。 最外层电子数都不超过8个(K层不超过2个)。 次外层电子数不超过18个。
2020年7月14日
练一练
1.下图所画的原子结构示意图正确的是( )
A.
B.
C.
D.
2.某元素有三个电子层,其最外层电子数是次 外层的一半,此元素是( ) A. S B. C C. Si D. Cl
核外电子排布与元素周期律
3、最外层电子数最多不超过8个(k为最外层,最多两个电子) 4、电子能量最低的离核近,能量高的离核远,电子总是尽先排 布在能量低的电子层里。
练习:
1、下列粒子的结构示意图正确的是
D
练习:
2、某元素的原子核外有三个电子层,M层的电子 数是L层电子数的1/2,则该元素的原子是 B A.Li B.Si C.Al D.K
10 Ne
18
元素符号
原子半径(nm)
Na
0.186
Mg
0.160
Al
0.143
Si
0.117
P
0.110
S
0.102
Cl
0.099
Ar
思
考
影响原子半径大小的因素有哪些? ① 电子层数,一般电子层数越多,原子半径越大;
② 原子核对电子的吸引,使半径有减小的趋向;
③ 核外电子多了,增加了电子之间的排斥,有使半 径增大的倾向。
(2)同主族:从上到下,原子半径增大
(3)原子半径大于相应的阳离子半径 (4)原子半径小于相应的阴离子半径 (5)具有相同电子层结构的微粒,核电荷数 越大,半径越小。
rO > rF > rNa >rMg >rAl
2+ 2+
3+
原子序数
元素符号 主要化合价 实例 原子序数 元素符号 主要化合价 实例
10 Ne 0 Ne 18 Ar
原子序数 元素符号
主要化合价
实例
+1
NaCl
+2
MgCl2
+3
AlCl3
+4 -4
SiO2 SiH4
+5 -3
H3PO4 PH3
练习:
1、下列粒子的结构示意图正确的是
D
练习:
2、某元素的原子核外有三个电子层,M层的电子 数是L层电子数的1/2,则该元素的原子是 B A.Li B.Si C.Al D.K
10 Ne
18
元素符号
原子半径(nm)
Na
0.186
Mg
0.160
Al
0.143
Si
0.117
P
0.110
S
0.102
Cl
0.099
Ar
思
考
影响原子半径大小的因素有哪些? ① 电子层数,一般电子层数越多,原子半径越大;
② 原子核对电子的吸引,使半径有减小的趋向;
③ 核外电子多了,增加了电子之间的排斥,有使半 径增大的倾向。
(2)同主族:从上到下,原子半径增大
(3)原子半径大于相应的阳离子半径 (4)原子半径小于相应的阴离子半径 (5)具有相同电子层结构的微粒,核电荷数 越大,半径越小。
rO > rF > rNa >rMg >rAl
2+ 2+
3+
原子序数
元素符号 主要化合价 实例 原子序数 元素符号 主要化合价 实例
10 Ne 0 Ne 18 Ar
原子序数 元素符号
主要化合价
实例
+1
NaCl
+2
MgCl2
+3
AlCl3
+4 -4
SiO2 SiH4
+5 -3
H3PO4 PH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
写出碱金属元素基态原子的电子排布
碱金属 原子序数 周期 基态原子的电子排布
锂
3
二 1s22s1或[He]2s1
钠
11
三
1s22s22p63s1或[Ne]3s1
钾
19
四 1s22s22p63s23p64s1或[Ar]4s1
铷
37
五 1s22s22p63s23p63d104s24p65s1或[Kr]5s1
元
外围电子排布
周素
期 数 ⅠA-ⅡA ⅢB-Ⅷ ⅠB-ⅡB ⅢA- 0族
目
ⅦA
12
1S1
1S2
28
2S1-2
2S22p1 -5 2S22p6
3 18 3S1-2
2.元素周期表共有多少个纵列?周期表上元素 的“外围电子排布”简称“价电子层”,这是 由于这些能级上的电子数可在化学反应中发生 变化。每个纵列的价电子层的电子数是否相等?
知识回顾:元素周期表的结构
周期
短周期(第一,二,三周期,2,8,8) 长周期(第四,五,六周期,18,18,32) 不完全周期(第七周期,26)
铯
55
六
1s22s22p63s23p63d104s24p64d105s25p66s1 或[Xe]6s1
结论:
❖ 1、同族原子最外层电子排布一般相同 ❖ 2、1、2纵行电子排在S亚层:nS1、nS2 ❖ 3~12纵行电子排在d亚层上: ❖ (n—1)d1nS2~(n—1)d10nS2 ❖ 13—18纵行电子排在P亚层上: ❖ nS2nP1~nS2nP6
1.周期的划分与什么有关? 2.每一周期中所能容纳的元素种数与什么有关? 3.周期序数与什么有关?
展示电子排布的周期表
一、核外电子排布与周期的划分
能级
能级组数(周 能级组内最多电子数
期数)
(周期中的元素数)
周期名称
1s
1
2s,2p
2
3s,3p
3
4s,3d,4p
4
5s,4d,5p
5
6s,4f,5d,6p
8个
2)周期元素数目=相应能级组中原子轨道 所 能容纳的电子总数
周期 能级组 能级组内原子轨 元素数目 电子最大容
道
量
1
Ⅰ
1s
2
2
2
Ⅱ
2s 2p
8
8
3
Ⅲ
3s 3p
8
8
4
Ⅳ
4s 3d 4p
18
18
5
Ⅴ
5s 4d 5p
18
18
6
Ⅵ
6s 4f 5d 6p
32
32
7
Ⅶ 7s 5f 6d (未完) 26 (未完)
对于能量相同的轨道(同一电子亚层),当电子排布处 于全满(s2、p6、d10、f14)、半满(s1、p3、d5、 f7)、全空(s0、p0、d0、f0)时比较稳定,整个 体系的能量最低。
鲍林近似能级图
1.元素周期表共有几个周期?每个周期各有多 少中元素?写出每一周期开头第一个元素和结 尾元素的最外层电子排布通式。为什么第一周 期结尾元素的电子排布跟其他周期不同?
第二课时
复习:基态原子的核外电子排布三大原则
能量最低原则: 核外电子的排布要使整个原子的能量最低,以形成稳
定结构。 泡利不相容原理: 一个原子轨道中最多只能容纳两个电子,并且这两个
电子的自旋方向必须相反。 洪特规则: 对于基态原子,电子在能量相同的轨道上排布时,应
尽可能的分占不同的轨道并且自旋方向相同。 洪特规则的特例:
未满
3)元素所在周期的判断:周期数=电子层数(n)
[练习]书写20号钙原子、24号铬原子、29号铜原
子和35号溴原子的价电子排布。
Ca 4s2 Cr 3d54s1 Cu 3d104s1 Br 4s24p5
[讨论]分析元素周期表回答: 1.主族元素原子的价电子排布与过渡元素原子的 价电子排布有什么区别? 2.同一主族元素原子的价电子排布有什么特点? 主族序数与什么有关? 3.同一族过渡元素原子的价电子排布有什么特点? 其族序数与什么有关?
②副族元素:以外围(n-1)d+ns的电子总数判断 A、电子总数为3~7,ⅢB~ⅦB B、电子总数为8~10,Ⅷ C、电子总数为11~12,ⅠB和ⅡB
规律:由元素的价电子结构判断.
1.nsX
n 周期 XA 族 (1S2为 0族)
2.ns2npX
n 周期 (2+X)A 族 (=8为0族)
3.(n-1)dXnsY
各族元素原子的价电子排布
族
第一主族 第二主族 第三副族 第四副族 第五副族 第六副族 第七副族 第八族
价电子 排布
价电子数
族
第一副族 第二副族 第三主族 第四主族 第五主族 第六主族 第七主族
零族
价电子排 布
价电子数
二、核外电子排布与族的划分
1)外围电子结构一般相同 2)元素所在族的判断:
①主族元素:主族序数=外围电子数=最外层电子数
6
7s,5f,6d,7p
7
2
特短周期
8
短周期
8
短周期
18
长周期
18
长周期
32
长周期
(32)
不完全周期
1)除第一周期外, 各周期均以填充 s 轨道 的元素开始, 并以填充满p 轨道的元素告终. (第一周期除外)
1s1 2s1 3s1 4s1 5s1 6s1
外围电子数有1
1s2 2s22p6 3s23p6 4s24p6 5s25p6 6s26p6
n 周期(X+Y)B 族 (X+Y≤7)
X+Y>7时为n 周期VIII族
4.(n-1)d10nsX
n 周期XB 族
练习:写出下列价电子结构所对3d54s1
C. 4d105s2
D. 5s1
E. 3d74s2
F. 6s26p6
G. 1s2
元
外围电子排布
周素
期 数 ⅠA-ⅡA ⅢB-Ⅷ ⅠB-ⅡB ⅢA- 0族
主族(ⅠA ~ Ⅶ A,7个纵行)
族
副族( ⅠB ~ Ⅶ B,7个纵行)
Ⅷ族(8,9,10纵行)
零族
七横十八纵,横行叫周期共有七周期,三四分长短,第七不完全; 纵行叫做族共有十六族(七主七副一八一零),八族最特殊三行 为一族。
[交流研讨]请根据1~36号元素原子的电子排布, 参照鲍林近似能级图,尝试分析原子中电子排 布与元素周期表中周期划分的内在联系。
目
ⅦA
12
1S1
1S2
28
2S1-2
2S22p1 -5 2S22p6
3 18 3S1-2
3S23p1 -5 3S23p6
4 18 5 32 6 32
4S1-2 5S1-2 6S1-2
3d1-9 4s2
4d1-9 5s2
4f1-14 5d1-10
3d104s1-2 4S24p1 -5 4S24p6 4d105s1-2 5S25p1 -5 5S25p6 5d106s1-2 6S26p1 -5 6S26p6
