高考化学一轮复习-氧化还原反应基本规律教案
氧化还原反应高三化学第一轮复习教案新课标人教版

氧化复原反响高三化学第一轮复习教案考点突破1、氧化复原反响概念的理解和判断2、氧化性、复原性的强弱判断3、氧化复原反响的规律4、有关氧化复原反响的计算夯基固本一、氧化复原反响概念:有电子转移〔得失或偏移〕的反响特征:化合价的变化氧化复原反响中的各种关系:失电子,化合价升高,被氧化〔氧化反响〕氧化剂+复原剂复原产物+氧化产物得电子,化合价降低,被复原〔复原反响〕二、氧化剂和复原剂:1、常见氧化剂是指易得到电子的物质。
主要有:①、活泼的非金属单质〔如 O2、Cl2等〕②、含处于最高价态或较高价态元素的化合物〔如 HNO3、MnO2、HClO3等〕③、高价态的金属阳离子〔如Fe3+、Cu2+等〕2、常见复原剂是指易得到电子的物质。
主要有:①、金属单质〔如 Na、K 等〕②、某些非金属单质〔 C、H2等〕③、含处于较低价或最低价的化合物〔FeCl2、CO 等〕④、非金属阴离子〔 S2-、I-等〕三、电子转移的表示方法双线桥:步骤:标变价联双桥写升降注得失含义 : 双线桥表示元素化合价的变化过程,但不表示电子转移的方向。
考前须知 : 1、线桥应跨越等号2、线桥箭头和箭尾要对准同种元素3、电子用“e-〞表示 ,且得失电子的总数相等 .单线桥:直接标出电子转移的方向和数目注意: 1、单线桥不跨越等号;2、线桥箭头和箭尾分别表示得电子和失电子的元素。
典例分析得 e-,化合价降低Cl2 + H2O = HCl + HClO Cl 2 + H2O = HCl + HClO 失 e-,化合价升高得 2×5e-,化合价降低2KMnO 4 + 16HCl == 2KCl + 2MnCl 2 + 5Cl2↑ + 8H2O失 2×5e-,化合价升高2KMnO 4 + 16HCl == 2KCl + 2MnCl 2 + 5Cl2↑ + 8H2O反响练习1、氧化复原反响的实质是〔〕,判断是否是氧化复原反响的方法是〔〕A、元素的原子是否有电子转移B、同一元素的化合反响前后是否有变化C、是否有氧元素参加D、是否是化合反响或分解反响2、以下说法正确的选项是否正确①、阳离子只具有氧化性,阴离子只具有复原性。
高中化学氧化还原反应教案

高中化学氧化还原反应教案教学内容:氧化还原反应的基本概念和应用教学目标:1. 理解氧化还原反应的基本概念和特征;2. 掌握氧化还原反应的基本原理和化学方程式的写法;3. 熟悉氧化还原反应在日常生活和工业生产中的应用。
教学重点和难点:重点:氧化还原反应的基本概念和特征;难点:氧化还原反应的化学方程式的写法。
教学准备:1. 教师准备:教案、教学课件、实验器材、教学实验、教学资源等;2. 学生准备:预习相关知识,带有习题和问题。
教学步骤:一、导入(5分钟)教师引入氧化还原反应的概念,通过实例和图表培养学生对氧化还原反应的兴趣和好奇心。
二、理论讲解(15分钟)1. 讲解氧化还原反应的定义和特点;2. 分析氧化还原反应的过程和特征;3. 解释氧化和还原反应的化学方程式写法。
三、示范实验(20分钟)1. 教师进行氧化还原反应的实验演示;2. 学生观察实验现象,记录数据和观察结果;3. 学生独立设计并完成一个氧化还原反应的实验。
四、练习和讨论(15分钟)1. 学生根据示范实验和讲解内容,完成相关习题;2. 学生之间相互讨论和交流,澄清疑问。
五、总结(5分钟)教师总结本节课的重点内容,强调氧化还原反应的重要性和应用。
六、作业布置(5分钟)布置相关作业,巩固学习内容。
教学反思:本节课的教学内容涵盖了氧化还原反应的基本概念和应用,通过理论讲解和实验示范,帮助学生掌握了氧化还原反应的基本原理和化学方程式写法。
在今后的教学中,需要更加注重学生的实践能力和创新思维,在实验中提升学生的动手能力和实验设计能力。
高中化学中的氧化还原教案

高中化学中的氧化还原教案
目标:
1. 理解氧化还原反应的基本概念;
2. 能够根据物质的氧化态变化判断其是否参与氧化还原反应;
3. 能够编写和平衡氧化还原反应方程式。
教学过程:
一、导入
1. 引入氧化还原反应的概念,解释其在化学中的重要性;
2. 通过简单的例子介绍氧化还原反应中的氧化和还原过程。
二、讲解
1. 讲解氧化和还原的定义和特征;
2. 介绍氧化态的概念和计算方法;
3. 解释氧化还原反应的基本过程;
4. 举例说明氧化还原反应在日常生活和工业生产中的应用。
三、实验
1. 进行一些简单的氧化还原反应实验,观察氧化还原反应的现象;
2. 让学生根据实验结果判断反应中的氧化和还原物质;
3. 引导学生编写和平衡氧化还原反应方程式。
四、练习
1. 分发练习题,让学生在课堂上进行练习;
2. 查漏补缺,帮助学生解决遇到的问题。
五、总结
1. 回顾本堂课的重点内容,强调氧化还原反应的重要性;
2. 引导学生思考氧化还原反应在生活中的应用;
3. 鼓励学生继续学习,深入了解氧化还原反应的更多知识。
六、作业
1. 布置作业,要求学生总结本课内容,写一份氧化还原反应的实验报告;
2. 提醒学生加强对氧化还原反应的理解和掌握。
§1-1氧化还原反应(第一轮复习教案)
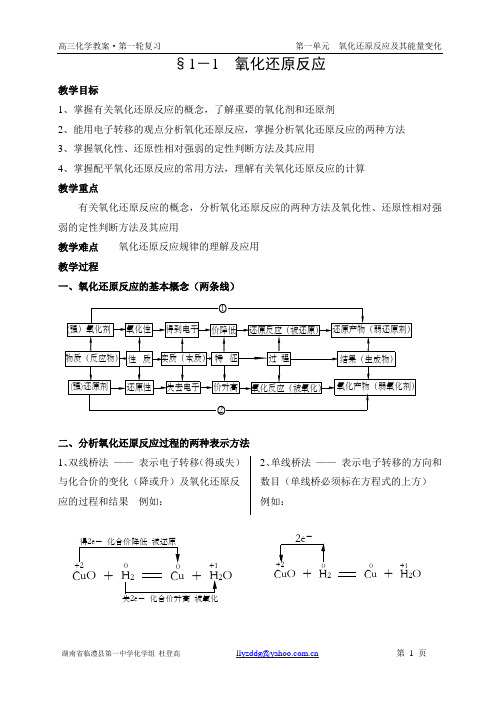
§1-1 氧化还原反应教学目标1、掌握有关氧化还原反应的概念,了解重要的氧化剂和还原剂2、能用电子转移的观点分析氧化还原反应,掌握分析氧化还原反应的两种方法3、掌握氧化性、还原性相对强弱的定性判断方法及其应用4、掌握配平氧化还原反应的常用方法,理解有关氧化还原反应的计算 教学重点有关氧化还原反应的概念,分析氧化还原反应的两种方法及氧化性、还原性相对强弱的定性判断方法及其应用教学难点 氧化还原反应规律的理解及应用 教学过程一、氧化还原反应的基本概念(两条线)二、分析氧化还原反应过程的两种表示方法 1、双线桥法 —— 表示电子转移(得或失)与化合价的变化(降或升)及氧化还原反应的过程和结果 例如:2、单线桥法 —— 表示电子转移的方向和数目(单线桥必须标在方程式的上方) 例如:CuO +O+1CuO + H 2Cu + H 2O+10-分析物质: CuO 是氧化剂,具有氧化性,被还原为Cu (还原产物是Cu ) H 2 是还原剂,具有还原性,被氧化为H 2O (氧化产物是H 2O ) 分析元素:(必须指明元素所在的物质及该元素的存在价态) CuO 中2+Cu 是氧化剂,具有氧化性,被还原为Cu 中0Cu H 2 中0H 是还原剂,具有还原性,被氧化为H 2O 中1+H归纳小结:氧化还原不可分,电子转移是根本,判断查看化合价,价降价升是特征; 失升氧和得降还,倘若问剂两相反,氧化剂和还原剂,相互转化紧联系。
失去电子 化合价升高 被氧化; 得到电子 化合价降低 被还原还原剂被氧化 ;氧化剂被还原。
三、氧化还原反应与化学反应基本类型的关系(两个一定两部分)四、氧化还原反应的基本类型1、 物质间的氧化还原(1)物质间不同价态、同种元素间的氧化还原反应(归中反应) 如:2H 2S + SO 2 2H 2O + 3S Fe + 2Fe 3+ 3Fe 2+(若归中到单质,则其一为负价,另一为正价,该元素必为非金属-金属无负价) (2)物质间不同种元素间的氧化还原反应Cu + 2Fe 3+Cu2++ 2Fe 2+Fe + Cu 2+Cu 2+ + Fe 2+2、 物质内的氧化还原反应(1)物质内不同种元素间的氧化还原反应 如: 2KClO 3 2KCl + 3O 2↑ (2) 物质内不同价态同种元素间的氧化还原反应(归中反应) 如:催化剂△5NH 4NO 3△2HNO 3 + 4N 2↑+ 9H 2O(3)物质内相同价态同种元素间的氧化还原反应(歧化反应) 如: 3Cl 2 + 6NaOH5NaCl + NaClO 3 + 3H 2O 五、氧化性、还原性相对强弱的定性判断及应用 1、根据氧化还原反应规律和化学方程式判断氧化性 (强)氧化剂(反应物 高价)>(弱)氧化剂(生成物 高价) 还原性 (强)还原剂(反应物 低价)>(弱)还原剂(生成物 低价)归纳: 氧化性,找高价,还原性,找低价;反应物,呈强性,生成物,呈弱性。
《氧化还原反应》教案

《氧化还原反应》教案教学目标:通过本节课的学习,学生将能够:1. 理解氧化还原反应的概念和基本原理;2. 掌握氧化还原反应的常见实例和实验方法;3. 学会运用氧化还原反应的理论知识解决实际问题;4. 培养创新思维和实验能力。
教学重难点:1. 掌握氧化还原反应中的基本概念和原理;2. 理解氧化剂和还原剂的概念和特点;3. 掌握氧化还原反应的实验方法和实际应用。
教学方法:1. 理论讲解结合实例分析法;2. 实验演示及小组讨论法;3. 问答互动法。
教学过程:一、引入老师可以通过实验演示或生活中的实际例子引出氧化还原反应,在引入中提出本节课的学习目标,让学生明确学习重点和难点。
二、概念和原理讲解教师通过板书或PPT向学生阐述氧化还原反应的基本概念和原理,并注重基本概念的深入理解和记忆,如氧化剂和还原剂的定义及反应方式的表示等。
三、实验演示及小组讨论老师进行氧化还原反应的实验演示,让学生在实验中对反应过程进行观察和分析,并在小组内讨论反应机理和反应方式的特点。
四、问题解答及问答互动教师根据学生在学习过程中出现的疑难问题进行解答,并进行问答互动,刺激学生的思维和创新能力。
五、课堂练习老师可设计适合课堂练习的题目,帮助学生强化对氧化还原反应的理解和记忆,同时培养学生的解决问题的能力。
六、总结通过课后总结和复习,让学生归纳本节课所学的知识和技能,加深对氧化还原反应的理解和记忆。
教学反思:本节课教师主要采用了理论讲解结合实验演示、小组讨论及问答互动等多种教学方法,让学生通过实践感受和理论学习相结合的方式掌握氧化还原反应的概念、原理和实际应用。
同时,注重在教学过程中引导学生思考和提问,培养其创新思维和实验能力,提高学生的综合素质水平。
2024届高考化学一轮复习教案(人教版)第一单元 物质及其变化 第3讲

第3讲氧化还原反应复习目标1.了解氧化还原反应的本质和特征。
2.了解常见的氧化剂和还原剂。
3.理解氧化性、还原性的比较方法。
考点一氧化还原的基本概念1.氧化还原反应的本质和特征2.相关概念及其关系例如,反应MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 中,氧化剂是13MnO 2,还原剂是14HCl ,氧化产物是15Cl 2。
盐酸表现的性质是16还原性和酸性。
3.氧化还原反应与四种基本反应类型间的关系(1)05有单质参加的化合反应属于氧化还原反应。
(2)06有单质生成的分解反应属于氧化还原反应。
4.常见的氧化剂和还原剂(1)常见的氧化剂包括某些活泼的非金属单质、变价元素中高价态元素的化合物或离子、过氧化物等。
氧化剂卤素单质X2HClO O2HNO3常见还原产物X-01Cl-或Cl2O2-、O2-2等02NO或NO2氧化剂浓硫酸MnO-4(H+)Fe3+Cr2O2-7常见还原产物03SO204Mn2+Fe2+或Fe Cr3+(2)常见的还原剂包括某些活泼的金属单质、某些非金属单质、变价元素中低价态元素的化合物或离子等。
还原剂Al H2SO2SO2-3H2S I-Fe2+氧化产物Al3+H+SO3或SO2-405SO2-4S或SO2I206Fe3+(3)既有氧化性又有还原性的物质:变价元素中间价态的化合物或离子。
如:具有中间价态的物质氧化产物还原产物Fe2+07Fe3+08FeSO2-309SO2-410SH2O211O212H2O其中,Fe2+、SO2-3主要表现13还原性,H2O2主要表现14氧化性。
请指出下列各说法的错因(1)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。
错因:化合价的升降可出现在同一种元素中。
(2)氧化还原反应中,反应物不是氧化剂就是还原剂。
错因:反应物也可不发生化合价变化,例:Cl 2+H 2O HCl +HClO 中的H 2O 。
(3)Na 2O 2与水发生氧化还原反应时,Na 2O 2只作氧化剂。
2025届高中化学一轮复习讲义第四讲 氧化还原反应的基本概念和规律(基础课)(解析版)

第四讲 氧化还原反应的基本概念和规律(基础课)复习目标 1.了解氧化还原反应的本质。
2.了解常见的氧化还原反应。
根据化学式判断元素化合价。
3.会用“单、双线桥”分析电子转移的方向和数目。
4.掌握氧化性、还原性强弱的比较及价态规律的应用。
知识点一 与氧化还原反应相关的概念1.本质和特征2.相关概念间的关系 (1)有单质参加或生成的化学反应不一定是氧化还原反应,如______________________________________________________________________________________________(符合题意即可)。
(2)分析:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
上述反应中,氧化剂是________,还原剂是________,氧化产物是________,还原产物是________,KMnO4发生________反应,HCl发生________反应,盐酸表现的性质是________性和________性;生成1 mol Cl2时转移电子数目为________,被氧化的HCl 的物质的量是________ mol 。
提示 (1)3O 2=====放电2O 3 (2)KMnO 4 HCl Cl 2 MnCl 2 还原 氧化 还原 酸 2 mol 23.电子转移的表示方法——双线桥法与单线桥法(1)双线桥法:①标变价,②画箭头,③算数目,④说变化。
用双线桥法标出铜和稀硝酸反应电子转移的方向和数目:。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
用单线桥法标出铜和稀硝酸反应电子转移的方向和数目:。
4.常见的氧化剂与还原剂(1)常见的氧化剂及还原产物预测氧化剂还原产物KMnO4Mn 2+(酸性);MnO 2(中性);MnO 2-4(碱性)K 2Cr 2O 7(酸性)Cr 3+浓硝酸NO 2稀硝酸NO X 2(卤素单质)X -H 2O 2OH -(碱性);H 2O(酸性)Na 2O 2NaOH(或Na 2CO 3)NaClO(或ClO -)Cl -、Cl 2NaClO 3Cl -、Cl 2、ClO 2PbO 2Pb 2+(2)常见的还原剂及氧化产物预测还原剂氧化产物S 2-(或H 2S)S 、SO 2(或SO 2-3)、SO 2-4H 2C 2O 4CO 2H 2O 2O 2I -(或HI)I 2、IO -3CO CO 2金属单质(Zn 、Fe 、Cu等)Zn 2+、Fe 2+(与强氧化剂反应生成Fe 3+)、Cu 2+Fe 2+Fe 3+(酸性);Fe(OH)3(碱性)SO 2(或H 2SO 3、SO 2-3)SO 2-4(3)如H 2O 2既可作氧化剂,又可作还原剂。
2013高考化学一轮复习教案-氧化还原反应基本规律(精)

第二章化学物质及其变化第八课时氧化还原反应基本规律复习目标:1、了解氧化还原反应的基本规律并运用其解题。
2、掌握几种氧化性、还原性判断的方法。
基础知识:一、基本规律1、价态律当元素具有可变化合价时,一般处于最高价态时只具有氧化性,处于最低价态时只具有还原性,处于中间价态时既具有氧化性又具有还原性。
女口:浓H2SO4的S只具有氧化性,H2S 中的S 只具有还原性,单质S 既具有氧化性又具有还原性。
2、强弱律在氧化还原反应中,强氧化剂+强还原剂=弱氧化剂(氧化产物)+弱还原剂(还原产物),即氧化剂的氧化性比氧化产物强,还原剂的还原性比还原产物强。
如由反应2FeC3+2KI=2FeC2+2KCI+2可知,FeC3的氧化性比I?强,KI的还原性比FeC2强。
一般来说,含有同种元素不同价态的物质,价态越高氧化性越强(氯的含氧酸除外),价态越低还原性越强。
如氧化性:浓H2S5 >SQ(H2SQ)> S;还原性:H2S>S>SO。
2+ 在金属活动性顺序表中,从左到右单质的还原性逐渐减弱,阳离子(铁指Fe )的氧化性逐渐增强。
3、优先律同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质。
如:将C2通入物质的量浓度相同的NaBr和Nal的混合液中,C2首先与Nal反应;将过量铁粉加入到物质的量浓度相同的Fe3+和Cu2+的混合液中,Fe首先与F『+反应。
4、价态归中规律含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价十低价T中间价”而不会出现交错现象。
5、歧化反应规律发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。
其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即中间价T高价十低价” 具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
黑龙江省哈尔滨市第一零九中学2013高考化学一轮复习氧化还原反应基本规律教案复习目标:1、了解氧化还原反应的基本规律并运用其解题。
2、掌握几种氧化性、还原性判断的方法。
基础知识:一、基本规律1、价态律当元素具有可变化合价时,一般处于最高价态时只具有氧化性,处于最低价态时只具有还原性,处于中间价态时既具有氧化性又具有还原性。
如:浓H2SO4的S只具有氧化性,H2S 中的S只具有还原性,单质S既具有氧化性又具有还原性。
2、强弱律在氧化还原反应中,强氧化剂+强还原剂=弱氧化剂(氧化产物)+弱还原剂(还原产物),即氧化剂的氧化性比氧化产物强,还原剂的还原性比还原产物强。
如由反应2FeCl3+2KI=2FeCl2+2KCl+I2可知,FeCl3的氧化性比I2强,KI的还原性比FeCl2强。
一般来说,含有同种元素不同价态的物质,价态越高氧化性越强(氯的含氧酸除外),价态越低还原性越强。
如氧化性:浓H2S04 >SO2(H2SO3)> S;还原性:H2S>S>SO2。
在金属活动性顺序表中,从左到右单质的还原性逐渐减弱,阳离子(铁指Fe2+)的氧化性逐渐增强。
3、优先律同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质。
如:将Cl2通入物质的量浓度相同的NaBr和NaI 的混合液中,Cl2首先与NaI 反应;将过量铁粉加入到物质的量浓度相同的Fe3+和Cu2+的混合液中,Fe首先与Fe3+反应。
4、价态归中规律含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价十低价→中间价”而不会出现交错现象。
5、歧化反应规律发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。
其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价十低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。
二、氧化性、还原性强弱的判断方法1.根据金属活动性顺序来判断:一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
(还原性逐渐减弱)金属的活动性逐渐减弱、、、、、、、、、、、、、、−−−−−−−−−−−−−−−−−→−Au Pt Ag Hg Cu H Pb Sn Fe Zn Mg Na K )(Al Ca氧化性逐渐增强、、、、、、、、、、、、、−−−−−−−−−−−−−−−−−−−−−→−+++++++++++++Ag Fe Cu H Pb Sn Fe Zn Mg Na K 322222322)(Al Ca2.根据非金属活动性顺序来判断:一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
3.根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:规律:氧化性:氧化剂的氧化性>氧化产物的氧化性还原性:还原剂的还原性>还原产物的还原性4.根据氧化还原反应发生的条件来判断:如:Mn02+4HCl(浓) MnCl 2+C12↑+2H 202KMn04+16HCl(浓)=2MnCl 2+5C12↑+8H 2O后者比前者容易(不需要加热),可判断氧化性 KMn04>Mn025.根据反应速率的大小来判断:如:2Na 2SO 3+O 2=2Na 2SO 4(快), 2H 2SO 3+O 2=2H 2SO 4(慢),322SO 2O SO 2催化剂∆+, 其还原性: Na 2SO 4>H 2SO 3>SO 2 6.根据被氧化或被还原的程度来判断:如:22CuCl Cl Cu 点燃+,S Cu S Cu 22∆+, 即氧化性:S Cl 2>。
又如:O H 2SO Br SO H HBr 2222)(42+↑+∆+浓,242228()44HI H SO I H S H O +=+↑+浓,即有还原性:H B r H I >。
7.根据原电池的正负极来判断:在原电池中,作负极的金属的还原性一般比作正极金属的还原性强。
8.根据电解池中溶液里阴、阳离子在两极放电顺序来判断。
如:Cl-失去电子的能力强于OH-,还原性:-->OHCl。
9.根据元素在周期表中位置判断:(1)对同一周期金属而言,从左到右其金属活泼性依次减弱。
如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
(2)对同主族的金属而言,从上到下其金属活泼性依次增强。
如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强。
(3)对同主族的非金属而言,从上到下其非金属活泼性依次减弱。
如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱。
10.根据(氧化剂、还原剂)元素的价态进行判断:元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。
如氧化性:Fe3+>Fe2+>Fe,S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4< HClO3< HClO2< HClO。
【注意】①物质的氧化性、还原性不是一成不变的。
同一物质在不同的条件下,其氧化能力或还原能力会有所不同。
如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。
②原子的氧化性一般都强于分子的氧化性。
如:氧化性F>F2、Cl>Cl2、O>O2等。
典型例题:【例1】(2009全国Ⅱ,13)含有a mol FeBr2的溶液中,通入x mol Cl2。
下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确...的是A.x=0.4a,2Fe2-+Cl2=2Fe3++2Cl-B.x=0.6a,2Br-+ Cl2=Br2+2Cl-C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-〖答案〗B【例2】根据下列方程式:⑴2Fe2++Cl2=2Fe3++2Cl-;⑵HClO+HCl=Cl2+H2O ;⑶2Fe3++Cu=2Fe2++Cu2+;⑷Fe+Cu2+=Fe2++Cu,判断下列各组物质氧化性强弱顺序正确的是A.Fe3+>HClO>Cl2>Fe2+>Cu2+ B.HClO>Cl2>Fe3+>Cu2+>Fe2+C.Cl2>HClO>Fe3+>Cu2+>Fe2+ D.HClO>Fe3+>Cl2>Cu2+>Fe2+〖解析〗此题看起来很复杂,但问题解决起来却非常简单,所依据的规律就是常说的“强制弱”规律。
所谓的“强制弱”规律,指的是氧化性(还原性)强的物质可以把还原性(氧化性)弱的物质制出来,具体到某一个特定反应中的意思是说,具有氧化性的氧化剂(还原性的还原剂)可以把具有氧化性的生成物(还原性的生成物)制出来。
由⑴可知,Cl2氧化性强于Fe3+,即Cl2>Fe3+,由⑵可知,HClO>Cl2,由⑶可知,Fe3+>Cu2+,由⑷可知,Cu2+>Fe2+。
由此可进一步推知,正确答案为B。
课后练习:1.根据反应:2H2S+O2===2S↓+2H2O,4NaI+O2+2H2SO4===2I2+2Na2SO4+2H2O,Na2S+I 2===2NaI +S↓.下列物质的氧化性强弱判断正确的是( )A .O 2>I 2>SB .H 2S>NaI>H 2OC .S>I 2>O 2D .H 2O>NaI>H 2S〖解析〗根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,由三个反应可知氧化性:O 2>S 、O 2>I 2、I 2>S ,故氧化性:O 2>I 2>S.〖答案〗A2.(2009·潮州月考)R 2O n -6在一定条件下可以把Mn 2+氧化成MnO -4,若反应后R 2O n-6转变为RO n -3.又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n 值为 ( )A .1B .2C .3D .4〖解析〗Mn 元素失去的电子数等于R 元素得到的电子数(也可以通过化合价计算,Mn 升高的化合价的数目等于R 元素降低的化合价数目).〖答案〗B3.在浓盐酸中H 3AsO 3与SnCl 2反应的离子方程式为:3SnCl 2+12Cl -+2H 3AsO 3+6H +===2As +3SnCl 2-6 +6M ,关于该反应的说法中正确的组合是 ( )①氧化剂是H 3AsO 3 ②还原性:Cl ->As ③每生成7.5 g As ,还原剂失去的电子为0.3 mol ④M 为OH - ⑤SnCl 2-6是氧化产物A .①③⑤ B.①②④⑤ C .①②③④ D.①③〖解析〗方程式中Sn 元素从+2价上升至+4价,SnCl 2是还原剂,SnCl 2-6 是氧化产物;As 元素从+3价下降到0价,H 3AsO 3是氧化剂,As 是还原产物.Cl 元素化合价没有发生变化,不能推出还原性:Cl ->As ,每生成7.5 g As ,还原剂失去电子的物质的量为7.5 g 75 g/mol ×3=0.3 mol.根据质量和电荷守恒推知M 应为H 2O 。
〖答案〗A4.(2009·汕头二模)做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO -4+C 2O 2-4 +H +―→CO 2↑+Mn 2++ ,关于此反应的叙述正确的是 ( )A .该反应的氧化剂是C 2O 2-4 B .该反应右边方框内的产物是OH -C .该反应电子转移总数是5e- D .配平该反应式后,H +的系数是16 〖解析〗该反应的氧化剂是MnO -4,选项A 错误.该反应右边方框内的产物是H 2O ,选项B 错误.配平该反应可得:2MnO -4+5C 2O 2-4+16H +===10CO 2↑+2Mn 2++ 8H 2O ,转移电子总数是10e -,选项C 错误.〖答案〗D5.(2011上海24)雄黄(As 4S 4)和雌黄(As 2S 3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:(1) As 2S 3和SnCl 2在盐酸中反应转化为As 4S 4和SnCl 4并放出H 2S 气体。
