注射用甲氨蝶呤标准操作规程2005
甲氨蝶呤临床应用

异位妊娠用法用量
50 mg /m2 ,单次肌内注射
甲氨蝶呤的应用科室-皮肤科
甲氨蝶呤具有抗炎、抗增值和免疫调节作用,是目前治疗银屑病最有效的 传统药物之一
银屑病用法用量
每周单次或分3次口服、肌内注射或静脉滴 注。起始剂量5~10 m萄倜;平均剂量10~ 15 ms/盾l;随着皮损改善,逐渐减量,每 4周减2.5 mg;老年人初始剂量2.5—5 mg 倜(不超过30 mg);剂量必须根据个体来决 定;必须进行血液学监测,每周应用1次 MTX,24 h后服用叶酸5 mg,之后每日1次 ,在不影响疗效的情况下可降低不良反应。
药理作用
1 :主要抑制二氢叶酸还原酶而使二氢叶酸不能还原成有生理活性的四氢叶酸,从 而使嘌呤核苷酸和嘧啶核苷酸的生物合成过程中一碳基团的转移过程受阻,导致 DNA的生物合成受到抑制。
2 :本品也有对胸腺核苷酸合成酶的抑制作用,但抑制RNA与蛋白质合成的作用则 较弱,本品主要作用于细胞周期的S期,属细胞周期特异性药物。
类风湿性关节炎用法用量
于1985年相继报道了小剂量 甲 氨 蝶 呤 脉冲疗 法治疗33倒严重的RA患者,治疗后半 数 以上 的病人关节疼痛及肿胀减轻,13%的病人疗 效显著。1989年国内学者葛民泽等也报道了 应用甲氨蝶呤治疗重症RA 35例,每次15mg至 20mg肌肉注射或口服治疗,每周1次,疗程6 个月。结果晨僵、握力、关节指数和关节功 能显著改善.红细胞沉降率下降,多数病例 类风湿因子转阴或滴度下降,缓解与明显缓 解率为69%,总有效率为97%。
妊娠性绒3.头毛颈膜部癌癌、支气管肺癌、各种软组织恶肉性瘤葡。萄胎
支气管肺癌
4.高剂量用于骨肉病,鞘内注射可用于预防和治疗脑膜白血病以及恶性淋巴瘤的神经侵
注射用甲氨喋呤

注射用甲氨喋呤药品名称:通用名称:注射用甲氨喋呤英文名称:Methotrexate for Injection商品名称:注射用甲氨喋呤成份:甲氨喋呤适应症:甲氨蝶呤具有广谱抗肿瘤活性,可单独应用或与其它化疗药物联合使用。
具体适应症如下:1.抗肿瘤治疗,单独使用:乳腺癌、妊娠性绒毛膜癌、恶性葡萄胎或葡萄胎。
2.抗肿瘤治疗,联合使用:急性白血病(特别是急性淋巴细胞性白血病或急性髓细胞性白血病)、Burketts淋巴瘤、晚期淋巴肉瘤(Ⅲ和Ⅳ期,Peter氏阶段系统)和晚期蕈样真菌病。
3.大剂量治疗:大剂量甲氨蝶呤单独应用或与其它化疗药物联合应用治疗下列肿瘤:成骨肉瘤、急性白血病、支气管肺癌或头颈部上皮癌,大剂量甲氨蝶呤应用时,必须应用甲酰四氢叶酸进行解救。
甲酰四氢叶酸(叶酸)是四氢叶酸酯的衍生物,可与甲氨蝶呤竞争进入细胞内,这种“甲酰四氢叶酸解救”可在大剂量甲氨蝶呤应用时保护正常组织细胞免受损害。
4.银屑病化疗:甲氨蝶呤可用于治疗严重、已钙化性、对常规疗法不敏感的致残性银屑病。
但因使用时有较大危险,应在经过活检及皮肤科医生确诊后使用。
规格:(1)5mg(2)0.1g(3)1g用法用量:抗肿瘤化疗:甲氨蝶呤可采用肌注、静脉途径给药。
绒毛膜癌及类似滋养层疾病,常规剂量是15~30mg/日,肌注5天。
通常一至数周后,在所有毒性反应全部消失后,再开始下一个疗程。
通常需要3~5个疗程。
治疗的有效性可采用24小时尿HCG(人绒毛膜促性腺激素)定量分析进行评估。
在第三次或第四次疗程后,HCG水平应回到正常或低于50IU/24h,通常可测定的病变在约4~6周后可完全消除。
在HCG水平恢复正常后,建议继续给予1或2个疗程甲氨蝶呤的治疗。
每个治疗开始前,必须进行仔细地临床评估,甲氨蝶呤可与其它抗肿瘤药物联合使用。
乳腺癌:对于淋巴结阳性的早期乳腺癌病人,作为乳房根治切除术后的辅助疗法,甲氨蝶呤与环磷酰胺、氟尿嘧啶联合应用,交替进行长期化疗可得到较好的疗效。
注射用甲氨蝶呤

[修订]注射用甲氨蝶呤Zhusheyong Jia’an DielingMethotrexate for Injection书页号:2005年版二部-121[增订]【鉴别】(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】溶液的澄清度取本品1瓶,加水2ml(5mg规格或0.1g规格)或10ml(1g 规格)使溶解,溶液应澄清;如显浑浊,与1号浊度标准液(5mg规格)或2号浊度标准液(0.1g规格或1g规格)(附录Ⅸ B)比较,不得更浓。
有关物质取装量差异项下的内容物适量(约相当于甲氨蝶呤10mg),精密称定,置10ml 量瓶中,用流动相溶解并稀释至刻度,摇匀(0.1g规格或1g规格),或取本品5瓶,用流动相将内容物溶解并转移至25ml量瓶中,用流动相稀释至刻度,摇匀(5mg规格),作为供试品溶液;精密量取1ml,置200ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
照含量测定项下的色谱条件测定。
取对照溶液50μl注入液相色谱仪,调节检测灵敏度,使甲氨蝶呤色谱峰的峰高为满量程的15%~20%,再精密量取供试品溶液与对照溶液各50μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。
供试品溶液色谱图中如有杂质峰,单个杂质峰的峰面积不得大于对照溶液主峰面积的2倍,各杂质峰峰面积的和不得大于对照溶液主峰峰面积的6倍。
细菌内毒素取本品,依法检查(附录Ⅺ E),每1mg甲氨蝶呤中含内毒素的量应小于0.2EU。
【增订】(3)1g[修订]按平均装量计算,含甲氨蝶呤(C20H22N8O5)应为标示量的85.0%~110.0%”改为“按平均装量计算,含甲氨蝶呤(C20H22N8O5)应为标示量的95.0%~110.0%”。
【检查】碱度取本品适量,加水溶解并稀释制成每1ml中约含2.5mg的溶液,依法测定(附录ⅥH),pH值应为7.0~9.0。
含量均匀度取本品(5mg规格)1瓶,用流动相将内容物溶解并转移至50ml量瓶中,用流动相稀释至刻度,摇匀。
mtx用法

mtx用法
MTX一般指甲氨蝶呤,是一种抗肿瘤药物。
其用法如下:
- 使用方法:包括口服药物和皮下注射等。
- 常用量:7.5mg-15mg,每周一次。
- 注意事项:
- 使用甲氨蝶呤后次日口服5mg叶酸(每周1次,每次5mg)有利于减少其潜在的副作用。
- 严重肾病、严重肝病、白细胞减少<3.0×10⁹/L、妊娠、哺乳、严重感染和严重间质性肺病等情况下,禁止使用甲氨蝶呤。
- 部分患者服药后会出现腹部不适、恶心、反酸等胃肠道症状,大多数患者会逐渐适应,无需停药。
如出现严重情况,应及时就诊调整药物。
- 甲氨蝶呤不是速效药物,一般需要持续使用1-3个月才能判断其是否有效,6个月时可达最大疗效,因此建议至少使用甲氨蝶呤3个月以上无效时,才考虑联合或者更换为其他药物。
- 使用甲氨蝶呤时,建议前3个月每隔2-4周查血常规、肝肾功能,当连续多次监测指标正常且剂量稳定后,可逐渐延长监测时间(如每3个月监测1次)。
- 服药期间应该严格避孕、避免哺乳。
- 当计划怀孕时,应该停药至少3-6个月以上。
小剂量甲氨蝶呤肌内注射致严重不良反应1例

2020年7月第27卷第13期小剂量甲氨蝶呤肌内注射致严重不良反应1例沈 杰 张彩宇 王丽洁 黄 涛1 病历摘要患者女,35岁,因停经40天,阴道出血5天,于2019年8月15日入安吉县妇幼保健院。
患者平素月经规则,孕2产1,流产1次。
患者于8月10日开始阴道出血,量少,色深红,无明显腹痛,持续5日未止,故来院就诊。
2008年行剖宫产术,术后恢复佳。
2015年患膜性肾病,一直服药至2017年停药,具体药物不详。
否认输血史,否认食物、药物过敏史。
入院体检:体温36.9℃,心率89次/min,呼吸19次/min,血压136/77mmHg。
实验室检查:WBC 6.1×109/L,中性粒细胞百分比57%,淋巴细胞百分比34.3%,Hb 122g/L,超敏C反应蛋白(Hs-CRP)<0.50mg/L。
血清人绒毛膜促性腺激素(HCG)742.6mU/mL。
B超示子宫肌瘤,右卵巢旁不均质回声。
患者诊断为异位妊娠,要求保守治疗。
于8月16日予注射用甲氨蝶呤(MTX)85mg,肌内注射,单次,当日实验室检查:血清白蛋白45.4g/L,尿素氮2.16 mmol/L,尿酸376μmol/L,肌酐42μmol/L,尿蛋白阴性,肝功能相关指标正常。
8月20日,患者感咽部疼痛,无口腔溃疡,体温正常,实验室检查:WBC 9.0×109/L,中性粒细胞百分比85.3%,淋巴细胞百分比12.6%,Hb 115g/L,hs-CRP 82.62mg/L,血HCG 1307.0mU/ml,血清白蛋白49.2g/L,尿素氮4.86mmol/L,尿酸470μmol/L,肌酐112μmol/L,尿蛋白阴性,直接胆红素8.5μmol/L,AST 44U/L,ALT 49U/L,γ谷氨酰基转移酶(GGT)93U/L。
患者食欲变差,胃部不适,予雷尼替丁对症治疗。
8月21日,患者咽痛加重,口腔出现少许溃疡,食欲差,予碳酸氢钠漱口治疗,继续予雷尼替丁。
注射用甲氨蝶呤说明书

通用名称:注射用甲氨蝶呤功能主治:1. 各型急性白血病,特别是急性淋巴细胞白血病;恶性淋巴瘤,非何杰金淋巴瘤和蕈样肉芽肿,多发性骨髓病。
2. 恶性葡萄胎、绒毛膜上皮癌、乳腺癌、卵巢癌、宫颈癌、睾丸癌。
3. 头颈部癌、支气管肺癌、各种软组织肉瘤。
4. 高剂量用于骨肉病,鞘内注射可用于预防和治疗脑膜白血病以及恶性淋巴瘤的神经侵犯,本品对银屑病也有一定疗效。
用法用量:1. 本品用注射用水2毫升溶解,可供静脉、肌内、动脉、鞘内注射。
2. 用于急性白血病:肌肉或静脉注射,每次10~30mg,每周1~2次;儿童每日20~30mg/m2,每周一次,或视骨髓情况而定。
3. 用于绒毛膜上皮癌或恶性葡萄胎:每日10~20mg ,亦可溶于5%或10%的葡萄糖注射液500ml中静脉滴注,一日1次,5~10次为一疗程。
总量80mg~100mg。
4. 用于脑膜白血病:鞘内注射甲氨蝶呤每次一般6mg/m2,成人常用于5~12mg,最大不>12mg,一日1次,5天为一疗程。
用于预防脑膜白血病时,每日10~15mg,一日1次,每隔6~8周一次。
5. 用于实体瘤(1) 静脉一般20mg/m2/次。
(2) 亦可介入治疗。
(3) 高剂量并叶酸治疗某些肿瘤,方案根据肿瘤由医师判定,如骨肉瘤等。
剂型:注射剂不良反应:1. 胃肠道反应,包括口腔炎、口唇溃疡、咽喉炎、恶心、呕吐、腹痛、腹泻、消化道出血。
食欲减退常见,偶见伪膜性或出血性肠炎等。
2. 肝功能损害,包括黄疸、丙氨酸氨基转移酶、碱性磷酸酶、γ-谷氨酰转肽酶等增高。
3. 大剂量应用时,由于本品和其它代谢产物沉积在肾小管而致高尿酸血症肾病,此时可出现血尿、蛋白尿、尿少、氮质血症甚至尿毒症。
4. 长期用药可引起咳嗽、气短、肺炎或肺纤维化。
5. 骨髓抑制:主要引起白细胞和血小板减少,尤以应用大剂量或长期口服小剂量后,引起明显骨髓抑制,贫血和血小板下降而致皮肤或内脏出血。
6. 脱发、皮肤发红、瘙痒或皮疹、后者有时为对本品的过敏反应。
甲氨蝶呤二钠盐质量标准

甲氨蝶呤二钠盐质量标准
1.产品名称:甲氨蝶呤二钠盐
2.成分:甲氨蝶呤二钠盐,化学式 C20H19N7Na2O5,相对分子质量 461.39。
含量应不低于 98.0%。
3.外观:白色或类白色结晶性粉末。
4.纯度:应符合下列要求:
(1)单一杂质的含量不得超过 0.5%。
(2)总杂质的含量不得超过 2.0%。
(3)重金属杂质(以铅计)含量不得超过 10ppm。
(4)水分含量不得超过 1.0%。
(5)有关杂质成分和其含量,应符合国家相关药典标准。
5.溶解性:应能在20℃的水中完全溶解。
6.理化性质:应符合下列要求:
(1)熔点:约230℃。
(2)比旋光度:+24.0°~+26.0°。
7.微生物限度:应符合国家药典中的相关要求。
8.包装及存储:应采用密封粉末包装,置于干燥、阴凉处保存。
9.使用期限:自生产日期起,有效期为 3 年。
10.安全注意事项:使用时应遵循化学品安全操作规程,避免直接接触皮肤、眼睛和呼吸道,注意避免误食。
备注:本标准为一般质量要求,并仅供参考,具体要求可根据实际生产、使用需要进行调整。
5 4高危药品滴速及用药注意事项
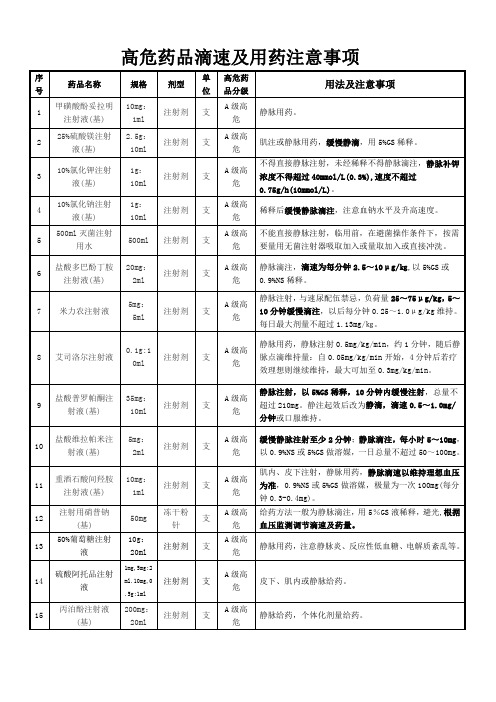
1g: 10ml
不得直接静脉注射,未经稀释不得静脉滴注,静脉补钾
A 级高
注射剂 支
浓度不得超过 40mmol/L(0.3%),速度不超过
危
0.75g/h(10mmol/L)。
10%氯化钠注射 4
液(基)
1g: 10ml
A 级高
注射剂 支
稀释后缓慢静脉滴注,注意血钠水平及升高速度。
危
500ml 灭菌注射
注射剂 支
0.5ml
危 盐水稀释。
2.5mg*
B 级高
34 华法林钠片
片剂 盒
口服,需要监测凝血指标,防止出血。
60 片
危
0.1g:
B 级高 肌注或静脉用药,本药含钙,故静脉注射速度不宜超过
35 亚叶酸钙注射液
注射剂 支
10ml
危 160mg/min。
150ug:1
ml
重组人粒细胞刺
B 级高
36
10 注射剂 支
2.培训人为护士长或邀请药学人员。
_____病区室高危药品使用知识培培训
时间
地点
主题
培训人
记录人
应到人数
实到人数
实到人
签名
主 要 内 容
注: 1.要求每年培训至少 2 次。
2.培训人为护士长或邀请药学人员。
1.5 万 U 注射剂 支
肌肉、皮下、动脉、缓慢静脉注射。
霉素
危
30mg:
B 级高 缓慢静脉滴注,不少于 3 小时,用生理盐水或 5%葡萄糖
60 紫杉醇注射液
注射剂 支
5ml
危 盐水稀释。
61 注射用吉西他滨 0.2g
B 级高 静脉滴注 30 分钟,0.9%NS 做溶媒,配制好后室温下保 注射剂 支
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.性状本品应为黄色或棕黄色疏松块状物或粉末.。
2.鉴别2.1所用试剂与试液:0.5%碳酸铵溶液:称取碳酸铵0.1g,加水20ml使溶解,摇匀。
盐酸溶液(9→1000):取盐酸9ml,加水使成1000ml,搅匀。
2.2所用仪器:紫外分光光度计,并已校验2.3操作方法:取供试品适量(应为含甲氨蝶呤5mg),置50ml量瓶中,加0.5%碳酸铵溶液1ml溶解后,加盐酸溶液(9→1000) 稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,加盐酸溶液(9→1000) 稀释至刻度,摇匀,制成每1ml中含10μg的溶液,在244nm与306nm的波长处有最大吸收,在234nm与262nm波长处有最小吸收。
3.检查3.1酸碱度3.1.1所用试剂及试液磷酸盐标准缓冲液:精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠3.55g与磷酸二氢钾3.40g,加水使溶解并稀释至1000ml。
硼砂标准缓冲液精密称取硼砂(Na2B4O7²10H2O)3.81g(注意避免风化),加水使溶解并稀释至1000ml。
置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。
3.1.2所用仪器:酸度计,酸度计每年检定一次,使精密度和准确度符合要求。
3.1.3原理电位法测定pH值是用饱和甘汞电极为参比电极,玻璃电极作指示电极(或复合电极),在供试液中组成原电池,测量电池电动势,以测溶液的pH值,借以控制该品的酸碱性。
3.1.4操作方法酸度计校正:先用硼砂标准缓冲液和磷酸盐标准缓冲液校正酸度计,在与测定供试液相同的温度下,用磷酸盐标准缓冲液充满测定池,将温度钮调到与溶液温度一致,斜率调节至100%,再调节定位控制钮,使测得的pH值与此温度时磷酸盐标准缓冲液标准值一致,用硼砂标准缓冲液充满测定池,在测定供试液相同的温度下测定pH值,硼砂标准缓冲液测得pH值与此温度时标准值之差应≤±0.07pH单位.若偏差大于0.07pH,应检查电极,如果电极不合格,应更换之.调节斜率或定位钮使测得值与标准值一致,用二种标准缓冲液重新校正,直到不再调节控制钮而二种标定用缓冲液与表中值之差不超过0.02pH单位.取供试品5mg与100mg为5瓶,1.0g为1瓶,各加水5mg为2ml,100mg为2ml,1.0g为400ml 溶解后,合并,摇匀,测定pH,应为7.0~9.0。
每次更换标准缓冲液或供试液前,应用纯化水充分洗涤电极,然后将水吸尽,也可用所换的标准缓冲液或供试液洗涤。
3.2 干燥失重3.2.1原理:药品的干燥失重,系指药品在规定的条件下干燥后所减失重量的百分率。
主要指水分、结晶水及其它挥发性物质如乙醇等,从减失的重量和取样量计算供试品的干燥失重。
3.2.2仪器与用具万分之一电子天平;真空减压干燥箱;并已校验扁形称量瓶收干燥器(普通)3.2.3试药与试液干燥剂为五氧化二磷。
干燥剂应保持在有效状态。
3.2.4操作方法:取本品约1.0g,平铺于100℃减压干燥至恒重后的扁形称量瓶中,精密称定,在100℃减压干燥, 以五氧化二磷为干燥剂,干燥时应将瓶盖取下,置于称量瓶旁,或将瓶盖半开,取出时须将瓶盖盖好,干燥后取出称量瓶,置干燥器中放冷至室温(约需30~60分钟),精密称定重量,重复操作,直至恒重,按下式计算干燥失重:A-B干燥失重=------------³100%A- W式中A为干燥前称量瓶与供试品重;gB为干燥后称量瓶与供试品重;gW为恒重的称量瓶重;g3.2.5结果判断:干燥失重应不得过5.0%3.2.6注意事项:a)结果按有效数字修约规则进行修约,有效位数应与标准中的规定相一致。
b)恒重,除另有规定外,系指连续两次干燥后的重量差异在0.3mg以下的重量。
干燥至恒重的第二次及以后多次称重,均应在规定条件下继续干燥1小时后进行。
c)当用减压干燥器或恒温减压干燥箱,除另有规定外,压力应在2.67kPa(20mmHg)以下;打开恒温减压干燥箱时,缓缓旋开活塞,以免造成气流,吹散供试品;称量瓶宜选用单层玻璃盖;供试品应置于临近温度计部位,以免因箱内温度不均匀造成的误差。
3.3 含量均匀度(5mg)3.3.1所用仪器;紫外分光光度计3.3.2所用试液:盐酸溶液(9→1000)3.4.3操作方法:取供试品10瓶, 分别加水1ml使内容物溶解,移置50ml量瓶中,用盐酸溶液(9→1000)稀释至刻度,摇匀,精密量取上述溶液1ml置10ml的量瓶中,用盐酸溶液(9→1000)稀释至刻度,摇匀,制成每1ml中约含甲氨蝶呤10ug的溶液,供为供试品溶液,用盐酸溶液(9→1000)作空白,在306nm的波长处分别测定吸收度A,,计算平均吸光度以及各瓶的吸光度与平均吸光度的差异值。
3.3.4结果与判断:每瓶的吸光度与10瓶的平均吸光度相比较,差异大于±15%的不得多于1瓶,并不得超过±25%。
3.4装量差异3.4.1所用仪器:分析天平:万分之一; 电热烘箱并已校验3.4.2操作方法:取供试品5瓶, 去铝塑复合盖和瓶签后,容器外壁用乙醇洗净,置干燥器内放置1~2小时,干燥后,分别编号,依次放于固定位置。
轻扣橡皮塞,使其上附着的粉末全部落下,开启容器(注意避免玻璃屑等异物落入容器中),分别迅速精密称定每瓶的重量,倾出内容物,容器用水、乙醇洗净,依次放回原固定位置,称重,加水溶去内容物后, 冲洗干净,置烘箱内烘干, 放冷至室温,或在干燥器内干燥较长时间,分别精密称定每一容器的重量,即可求出每1瓶的装量和平均装量。
3.4.3结果判断: 100mg规格的限度为±7%,1.0g规格的限度为±5%。
3.5可见异物检查3.5.1 检查装置及条件:澄明度检查仪光源:采用日光灯,于光照度2000~3000lx的位置,背景为不反光白色,在避光室或暗处用目检视。
层流工作台3.5.2操作方法:在层流净化台下,取供试品5瓶, 擦净容器外壁及橡皮塞表面,分别注入适量不溶性微粒检查用水,振摇溶解,将供试品至人眼距离25cm。
照可见异物检查法检查。
3.5.3结果判断:每瓶不得检出金属屑、玻璃屑、长度或最大粒径超过2mm纤毛和块状物等明显外来的可见异物,并在旋转时不得检出烟雾状微粒柱,如有一支发现其他可见异物(如2mm以下的短纤毛及点、块等)不多于3个,另取10瓶复检,均应符合规定.3.6不溶性微粒3.6.1所用仪器:不溶性微粒检测仪;层流净化台3.6.2试验环境及检测:先取约50ml微粒检查用水,照注射剂中不溶性微粒检查法(SOP-QM 102-40 00)采用光阻法检查,每10ml中含l0μm以上的不溶性微粒应在10粒以下,含25μm以上的不溶性微粒应在2粒以下。
否则表明微粒检查用水、玻璃仪器或试验环境不适于进行微粒检查,应重新处理,检测符合规定后方可进行供试品检查。
3.6.3 操作方法及结果判断取本品3瓶,各在净化工作台上精密加入适量微粒检查用水溶解及冲洗内容物于取样瓶中,总体积不得少于20ml,照注射剂中不溶性微粒检查法(SOP-QM 102-40 00)采用光阻法检查,计算每个容器所含的微粒数,每个供试品容器中含10μm以上的微粒不得超过6000粒,含25μm以上的微粒不得超过600粒。
3.7无菌检查无菌检查应在环境洁净度10000级和局部100级、单向流空气区域内进行。
3.7.1所用仪器及用具:a)培养箱恒温培养箱(30~35℃)、霉菌培养箱(23~28℃)b)灭菌器电热干燥箱(温度能达250℃)、高压灭菌器c)净化工作台、酒精灯、真空泵、无菌过滤器、注射器等3.7.2所用试剂及试液:a)消毒剂1%新洁尔灭溶液、75%酒精、甲酚皂液等。
b)金黄色葡萄球菌菌液取金黄色葡萄球菌[CMCC(B)26 003] 的营养琼脂斜面新鲜培养物1白金耳,接种至营养肉汤培养基内,在30~35℃培养18~24小时后,用0.9%无菌氯化钠溶液稀释至每1ml中含10~100个菌。
c)稀释剂:0.9%无菌氯化钠溶液d)冲洗液:pH7.0无菌氯化钠-蛋白胨缓冲液e)培养基:硫乙醇酸盐流体培养基、改良马丁培养基3.7.3培养基的准备按无菌检查法进行培养基的适用性检查:无菌检查和灵敏度检查应符合规定。
3.7.4操作方法取供试品(规格1.0g的为20瓶,100mg的为30瓶,5mg的为60瓶)各加入灭菌水制成2.5mg/ml溶液备用,取全封闭集菌过滤器5管,加pH7.0氯化钠-蛋白胨缓冲液30ml浸泡,将供试液平均吸入其中3管,过滤,每管加入800ml的pH7.0氯化钠-蛋白胨缓冲液冲洗滤膜,最后在两管中加入硫乙醇酸盐流体培养基100ml,其中一管加入菌量小于100CFU的1ml 的金黄色葡萄球菌菌液作为阳性对照杯,金黄色葡萄球菌的对照菌液的加入选择在阳性对照室进行,第三管加入改良马丁培养基100ml。
阴性对照同法操作,硫乙醇酸盐流体培养基置30~35℃培养,改良马丁培养基在23~28℃培养,阴性对照应置相应的培养条件培养,培养14天,逐日观察结果。
阳性对照置30~35℃培养48~72小时。
3.7.5结果判断当阳性对照管48~72小时显浑浊并确有细菌生长,阴性对照管呈阴性时,可根据观察所得的结果判定:硫乙醇酸盐流体培养基及改良马丁培养基均为澄清,或虽显浑浊但经证明并非有菌生长,判供试品符合规定;硫乙醇酸盐流体培养基及改良马丁培养基任何一管显浑浊并确证有菌生长,判供试品不符合规定当满足下列任何一个条件时,判断试验结果无效:1.对无菌检查试验相关设施的微生物监控数据表明其不符合规定。
2.对无菌试验过程的回顾,揭示了本操作程序是错误的。
3.阴性对照管有菌生长。
4.供试品管中生长的微生物经鉴定后,确证微生物生长是因为无菌试验中所使用的物品和(或)无菌操作技术不当引起的。
试验若经确认无效,应重试。
重试时,重新取同量供试品,依法重试,若无菌生长,判供试品符合规定;若有菌生长,判供试品不符合规定。
3.8细菌内毒素检查3.8.1试剂与试液:a)细菌内毒素工作标准品中国药品生物制品检定所生产,规格:10~200EU/支,贮藏:遮光,2~8℃保存。
b)鲎试剂每批新的鲎试剂在用前都要进行灵敏度复核。
规格:0.125EU/ml*0.1ml/支,贮藏:遮光,2~8℃保存。
c)细菌内毒素检查用水系指和0.015EU/ml 不产生凝集反应的灭菌注射用水。
3.8.2仪器与用具:a)电热干燥箱除外源性内毒素温度应能维持250℃以上至少一小时。
b)恒温水浴箱或适宜的恒温器,应能在37℃±1℃保持一小时。
c)水银温度计或酒精温度计,精度在1℃以下。
d)旋涡混合器3.8.3供试品干扰试验:取供试品1支(1.0g),加10ml鲎试验用水置旋涡混合器上使之充分溶解,精密量取供试品液1ml,加入鲎试验用水3ml,置旋涡混合器使之充分混匀制成4倍稀释液,再精密量取0.1ml,加入鲎试验用水7.9ml,置旋涡混合器使之充分混匀制成320倍稀释液其pH值在6~8范围内。
