酸性蓝黑B
常见指示剂的变色范围

序号 (No。
) 名称(Name)pH变色范围 (pH transition interval) 酸色 (Acid color) 碱色(Base color) pKa 浓度(Concentration)1 甲基紫(第一次变色)0。
13~0。
5 黄绿0.8 0.1%水溶液2 甲酚红(第一次变色) 0.2~1。
8 红黄- 0。
04%乙醇(50%)溶液3 甲基紫(第二次变色) 1。
0~1。
5 绿蓝—0.1%水溶液4 百里酚蓝(第一次变色) 1.2~2.8 红黄 1.65 0。
1%乙醇(20%)溶液5 茜素黄R (第一次变色)1。
9~3。
3 红黄—0.1%水溶液6 甲基紫(第三次变色) 2.0~3.0 蓝紫- 0.1%水溶液7 甲基黄 2.9~4.0 红黄3。
3 0。
1%乙醇(90%)溶液8 溴酚蓝 3.0~4。
6 黄蓝 3.85 0.1%乙醇(20%)溶液9 甲基橙 3.1~4.4 红黄3。
40 0.1%水溶液10 溴甲酚绿3。
8~5.4 黄蓝 4.68 0。
1%乙醇(20%)溶液11 甲基红 4.4~6。
2 红黄 4.95 0.1%乙醇(60%)溶液12 溴百里酚蓝6。
0~7。
6 黄蓝7。
1 0。
1%乙醇(20%)13 中性红 6.8~8.0 红黄7.4 0.1%乙醇(60%)溶液14 酚红 6.8~8.0 黄红7。
9 0.1%乙醇(20%)溶液15 甲酚红(第二次变色)7.2~8.8 黄红8。
2 0.04%乙醇(50%)溶液16 百里酚蓝(第二次变色)8。
0~9。
6 黄蓝8。
9 0。
1%乙醇(20%)溶液17 酚酞8.2~10。
0 无色紫红9.4 0.1%乙醇(60%)溶液18 百里酚酞9.4~10。
6 无色蓝10。
0 0。
1%乙醇(90%)溶液19 茜素黄R (第二次变色) 10.1~12.1 黄紫11.16 0。
1%水溶液20 靛胭脂红11.6~14。
0 蓝黄12。
2 25%乙醇(50%)溶液混合酸碱指示剂序号(No。
笔墨中的化学

笔墨中的化学摘要笔墨与我们的日常生活关系密切,无论读书、学习,还是标记、记录都离不开笔墨。
简单介绍了几种常见笔的结构、性质及其所用墨水的化学组成与使用。
关键词笔墨结构组成性质在文房四宝中“笔”与“墨”居前两位,可见从古至今笔墨对人类都具有重要的现实意义。
随着新材料的不断发现,各种各样的写字用笔与书写油墨随之产生,例如生活中常见的铅笔、粉笔、毛笔、钢笔、圆珠笔、记号笔、荧光笔、白板笔以及蜡笔等等。
笔离不开墨,本文还介绍了与上述笔相对应的书写墨水的一些化学知识。
1 铅笔与铅笔芯世界上第一支铅笔出现在英国,当时是把一种黑色软矿石做成棒状或条状,直接用于书写。
由于质软易断,后来人们将其缠上绳子或镶嵌在2片木槽中,这样就形成了最早的铅笔。
因为黑色的软矿石外观极像金属铅,所以该笔被称为“铅”笔。
后来黑矿石主要化学成分被证明是石墨,众所周知石墨呈层状结构,层与层之间距离较大,作用力较小,易于滑动,书写后可在纸上留下划过的痕迹。
由于石墨太软,容易断和磨损,所以目前所用的铅笔芯一般都在石墨中掺合一定比例的黏土。
根据铅芯中石墨的比例,铅笔芯主要有6H~1H、HB、1B~6B等规格。
其中H(Hard的首字母)表示硬度,代表掺入黏土较多,其前数值越大代表铅笔越硬越淡;B(Black的首字母)表示黑度,代表石墨的含量较多,其前数值越大代表铅笔越软越黑;HB软硬居中。
不同规格的铅笔用途不同,例如标有H的铅笔较硬,常用于工程绘图;标有B的铅笔较软,多用于画画;适于书写的是软硬适中标号HB的铅笔。
虽然铅笔芯主要化学成分是无毒的石墨而不是铅,但笔杆的油漆涂层常常含有铅,所以平时不要养成咬铅笔的习惯。
由于普通铅笔要消耗木材,会造成一定程度的浪费,所以出现了非木材外壳的活动铅笔,因装在细长塑料管内的铅笔芯可随着书写的磨损来调节而得名。
活动铅笔用的铅芯分黏土型(C型)石墨铅芯和树脂型(P型)石墨铅芯2种,其中树脂型铅芯软硬适中,不易折断,书写性能良好。
染料实验讲义

实验五 分散橙的合成
一.实验目的 掌握偶合组分为叔胺化合物的分散染料的合成方法 二.实验仪器与药品 搅拌、烧杯(100mL、250mL) 、温度计 对硝基苯胺、N,N-二乙基苯胺、亚硝酸钠、浓盐酸 三.实验原理
6
对硝基苯胺与亚硝酸反应,得到相应的重氮盐,然后与 N,N-二乙基苯胺偶 合,得到分散染料,过程如下:
O2N NH2
HCl NaNO2
O2N
N2Cl
N
O2N
N=N
N
四.实验内容 1.对硝基苯胺的重氮化 称量 1.38g 对硝基苯胺于 100mL 烧杯中,加入 20mL 水和 3.6mL 浓盐酸, 搅拌加热至 70℃溶解,冰浴下迅速加入少量碎冰于溶液中,有黄色细颗粒状固 体析出。称量 0.73g 过量 5%的亚硝酸钠于烧杯中,加入 5mL 水搅拌溶解,冰浴 下迅速加入到上述对硝基苯胺盐酸溶液中。 溶液为淡黄色, 刚果红试纸检测变蓝, 淀粉碘化钾试纸检测瞬间变蓝,冰浴 0-5℃下搅拌 30min。埃利希试剂渗圈检测 反应终点。加入少量氨基磺酸,除去过量亚硝酸,淀粉碘化钾试纸检测 3-5s 内 不变蓝。 2.偶合 称量 3.0g N, N-二乙基苯胺于 250mL 烧杯中, 加入 100mL 水和浓盐酸 1mL, 搅拌溶解得到澄清液体。将重氮盐溶液在 0.5h 内滴入,保持温度在 10℃以下, 搅拌 2h,渗圈检测。抽滤,干燥。 五.思考题 1.写出可能的副产品结构。
>0.5h
N2Cl + NaCl + 2H2O
OH N2Cl
+
<5 C, 2h
OH NH2 N N SO3H NO2
OH o
NaO3S
N N NaO3S
四.主要仪器和药品 电动搅拌器、温度计(0-100℃) 、烧杯(100mL、400mL) 、量筒(10mL、 100mL) 、布氏漏斗、吸滤瓶、表面皿、酸度计。 对硝基苯胺、苯胺、盐酸、亚硝酸钠、H 酸、磷酸二氢钠、氢氧化钠、碳酸 钠、氯化钠、间苯二酚溶液(1%) 五.实验内容 1.对硝基苯胺的重氮化 在 400mL 的烧杯中加入 3.6mL 的浓盐酸和 25mL 水,再加入 1.38g 对硝基 苯胺,加热至 70℃使其溶解,冰浴下迅速加入少量碎冰于溶液中,析出对硝基 苯胺细颗粒。称量 0.7g 的亚硝酸钠于烧杯中,加入 5mL 水搅拌溶解,冰浴下一 次性迅速加入到上述对硝基苯胺盐酸溶液中,然后不断用 pH 试纸及淀粉碘化钾 试纸检查,保持介质酸性和有微过量亚硝酸存在,在 10℃以下保持反应 10min。 2.单偶氮染料的制备 将 3.41g H 酸配成 15-20%的溶液,用碳酸钠调节 pH 为 7-8,然后将配制好 的 H 酸溶液慢慢滴加到已制备好的对硝基苯胺重氮盐中,加入 2g 磷酸二氢钠, 保持介质酸性,在 10℃左右反应至用间苯二酚溶液做渗圈试验有微量重氮盐, 用对硝基苯胺重氮盐检查无 H 酸存在为止。
常见指示剂变色范围

酸碱指示剂序号(No.) 名称(Name)pH变色范围 (pH transition interval)酸色 (Acid color)碱色(Base color) pKa 浓度(Concentration)1 甲基紫(第一次变色) 0.13~0.5 黄绿0。
80.1%水溶液2 甲酚红(第一次变色)0.2~1.8 红黄-0.04%乙醇(50%)溶液ﻫ3甲基紫(第二次变色) 1.0~1。
5绿蓝—0。
1%水溶液4百里酚蓝(第一次变色) 1.2~2.8 红黄 1.65 0.1%乙醇(20%)溶液5 茜素黄R (第一次变色) 1.9~3.3红黄- 0。
1%水溶液6 甲基紫(第三次变色)2.0~3.0 蓝紫—0。
1%水溶液7 甲基黄2.9~4.0红黄 3.3 0.1%乙醇(90%)溶液8 溴酚蓝3.0~4.6 黄蓝3.85 0.1%乙醇(20%)溶液ﻫ9甲基橙3。
1~4。
4红黄 3.40 0。
1%水溶液10溴甲酚绿3。
8~5.4黄蓝4。
68 0.1%乙醇(20%)溶液ﻫ11 甲基红4。
4~6。
2 红黄4。
95 0。
1%乙醇(60%)溶液ﻫ12溴百里酚蓝 6.0~7.6 黄蓝7.1 0.1%乙醇(20%)13 中性红 6.8~8.0 红黄7.4 0.1%乙醇(60%)溶液14 酚红6.8~8。
0 黄红7.9 0。
1%乙醇(20%)溶液15 甲酚红(第二次变色)7.2~8。
8 黄红8.2 0。
04%乙醇(50%)溶16百里酚蓝(第二次变色)8.0~9。
6 黄蓝8.9 0.1%乙醇(20%)液ﻫ溶液17酚酞8。
2~10.0 无色紫红9.40。
1%乙醇(60%)溶液18百里酚酞9.4~10.6无色蓝10.0 0.1%乙醇(90%)溶19茜素黄R (第二次变色) 10.1~12.1 黄紫11.160.1%水溶液液ﻫ20靛胭脂红11.6~14.0 蓝黄12.225%乙醇(50%)溶液混合酸碱指示剂序号(No.) 指示剂名称(Indicator name) 浓度 (Concentration) 组成 (Co nstitution) 变色点pH(Transition point pH)酸色 (Acid color)碱色(Base color)1 甲基黄0。
第六章 酸性染料、

从机理上:不同pH值上染原理不同,而如何选择合适的 pH值主要取决于染料,不同的染料上染时所选择的pH 也不同,每一类染料都有一个吸附临界pH值,其含义 为当pH高于吸附临界值时,染料很少吸附,pH低于临 界pH值时,染料才能发生吸附,而pH过低则发生超当 量吸附,易造成染色不匀和湿牢度降低。
所以强酸性染料 pH=2-3,耐缩绒酸性染料 pH=4-5 或 pH=5-6
于当量吸附。
第四节 酸性染料对羊毛、蚕丝和锦纶的染色工艺
酸性染料目前的染色工艺(染色方法)通常采用浸染的方 法,而在浸染中易产生的质量问题主要为染色不匀或称
为色花。根据孔道扩散模型,D与dCp/dCa关系为:
D
dC Dp dC
p a
在强酸性浴中,染料在纤维上吸附符合朗格缪尔吸附等温 线,当纤维上浓度超过一定数值后, dCp/dCa→∞ ,D 急剧上升,所以上染速率剧增,一旦造成染色不匀,则
子结构中-NH2和-COOH的含量各不相同,纤维的分
子结构也不同,因此它们的上染性能也不一样。
NH3 F COOH
OH H
+
NH3 OH F H COO-
+
NH2 F COO-
pH<pI
pH=pI
pH>pI
• 羊毛纤维:
1. —NH2含量与—COOH含量基本相等, pI=4.2-4.8 • pH=1左右,羊毛纤维中,
2.温度选择:
从两方面讨论:
染料:分子结构小,聚集度低,溶解度大,相应的△E 小,上染温度低。 纤维:羊毛的磷片层,使扩散活化能大,所以羊毛染色 最高温度一般均为100℃。
但要控制初染温度和升温速率。
低于50 ℃羊毛的溶胀度较小,染料扩散速率低,因此 羊毛初染温度一般在50℃。 对弱酸性染料在60~80℃,染料聚集体解聚,扩散速率 提高,在此阶段应控制升温速率。
2.荧光光度法测定维生素B2的含量

2.荧光光度法测定维生素B2的含量荧光光度法测定维生素B2的含量一、实验目的1、学习荧光分光光度法测定维生素B2的分析原理;2、掌握荧光分光光度计的操作技术和测定维生素B2的方法。
二、实验原理1.荧光光度法原理(1)常温下,处于基态的分子吸收一定的紫外可见光的辐射能成为激发态分子,激发态分子通过无辐射跃迁至第一激发态的最低振动能级,再以辐射跃迁的形式回到基态,发出比吸收光波长长的光而产生荧光。
在稀溶液中,荧光强度IF与物质的浓度c有以下的关系:IF?2.303?I0?bc当实验条件一定时,荧光强度与荧光物质的浓度成线性关系:IF?Kc这是荧光光谱法定量分析的理论依据。
(2)荧光分析法的特点:a. 与紫外-可见分光度法比较,荧光分析法具有更高的灵敏度。
b. 选择性好。
荧光法既能依据发射光谱,又能依据吸收光谱来鉴定物质。
c. 所需试样量少、操作方法简便。
(3)荧光光谱激发光谱:固定测量波长(选最大发射波长),化合物发射的荧光强度与照射光波长的关系曲线。
激发光谱曲线的最高处,处于激发态的分子最多,荧光强度最大。
发射光谱:固定激发光波长(选最大激发波长), 化合物发射的荧光强度与发射光波长关系曲线。
固定发射光波长进行激发光波长扫描,找出最大激发光波长,然后固定激发光波长进行荧光发射波长扫描,找出最大荧光发射波长。
激发光波长和发射荧光波长的选择是本实验的关键。
(4)荧光分析仪器常用的荧光分析仪器由激发光源、单色器、液槽、检测器和显示记录器五部分构成,如下图所示:2. 荧光光度法测定多维葡萄糖粉中维生素B2的含量维生素B2(又叫核黄素,VB2)是橘黄色无臭的针状结晶,其结构式为:OHI0 单色器光源I 液槽If 单色器I0 显示器检测器*****H3**********CO维生素B2易溶于水而不溶于乙醚等有机溶剂,在中性或酸性溶液中稳定,光照易分解,对热稳定。
维生素B2溶液在430~440 nm 蓝光的照射下,发出绿色荧光,荧光峰在535 nm。
化学经典趣味小故事

化学经典趣味小故事化学姐说huaxue「保持初心」生活离不开化学,化学服务于生活。
下面是日常生活中关于化学的十则经典小故事,看完再次爱上化学有木有?1. 古老的新印章有一批古画,变得灰黄而没有光泽,但它上面的印章却鲜红,像新盖上去的一样,这是什么原因呢?考古学家经过认真地研究和科学地测定,发现绘画的颜料大多使用了铅白,随着时间的推移,极易发生化学反应,生成新的氧化物,而古代印章使用的印泥是用朱砂和麻油搅拌而成,在空气中不容易发生化学反应,所以保持了原有红润鲜艳的颜色。
朱砂的化学成分是硫化汞,硫化汞的化学性质非常稳定,在日光下长期暴晒也不变色,而且能耐酸、耐碱,正因为这样,被用作颜料。
有些纸张时间放得久了就会变成黄色,这是因为纸张内部还有一部分杂质没有清除掉,日子久了,受到空气和日光的作用,就会发生变化,使纸张渐渐变黄,并且容易破裂。
如果在制造纸张时能用氧气或漂白粉漂白纸浆,那就可以防止这种现象的发生。
为了使纸张容易吸收墨汁,防止书写或印刷时墨汁化开,可以加入适当的胶汁,如动物胶、明矾、松香等。
如果要使制造的纸张表面光滑,能两面写字,那就要加入一些填料如淀粉、碳酸钙、滑石粉、白陶土等,使纤维素之间的空隙填满,从而可防止墨汁化开。
2. 纯蓝墨水与蓝黑墨水翻开我们以前写的作业,发现有些字迹已经模糊不清了,而有的却清清楚楚,同一时期的字迹,为什么会有如此大的差别呢?原来,字迹不清的是用纯蓝墨水写的,日子长了,会被氧化,颜色渐渐变浅,甚至完全消失;而这种清楚的是用蓝黑墨水写的,蓝黑墨水被氧化后,能逐渐生成一种永不退色的化学物质——黑色的鞣酸铁,所以,字迹比较清楚。
一般,蓝黑墨水里还加入了可溶性蓝色有机染料、硫酸、苯酚、甘油和香料。
加入硫酸,是使墨水保持酸性,防止墨水沉淀;苯酚的俗名叫苯酚,是著名的防腐剂,能杀菌,使墨水不至于腐化发臭;甘油的化学成分是丙三醇,是常用的防冻剂,加入甘油后,就可以大大降低水的冰点,使墨水在冬天不易结冰;至于加入香料,则是使墨水芳香宜人。
蓝墨水汁迹久置变色现象的探讨
蓝墨水汁迹久置变色现象的探讨作者:***来源:《化学教学》2018年第12期摘要:对生活中蓝墨水书写的汁迹久置会变色的异常现象进行实证研究,发现颜色能加深的墨水主要为蓝黑墨水,纯蓝墨水汁迹久置反而会变浅褪色。
结合市售蓝墨水类别及通用化学配方的调研,从理论层面分析和揭示了相关变色的成因。
在研究的基础上,进一步设计了蓝墨水污渍消除、茶叶末自制蓝黑墨水等系列生活化、趣味化的实验拓展活动。
关键词:纯蓝墨水; 蓝黑墨水; 汁迹变色; 实验探究文章编号: 10056629(2018)12009405中图分类号: G633.8文献标识码: B1问题提出近年来,尽管文具市场上圆珠笔、签字笔、水笔等品种琳琅满目,但钢笔仍然是很多中学生喜爱的书写工具。
曾有几位细心的学生指出,用蓝墨水书写的汁迹初始还呈鲜艳的蓝色但隔夜后就会明显加深为蓝黑色甚至黑色,并据此咨询笔者汁迹久置变色有何玄机,现象背后蕴含的化学原理究竟是什么。
为此,笔者让有探索意向的学生组建了化学课题兴趣小组,利用学生课余及假期的时间,通过实验探究、市场调查、文献阅读等方式开展了系列课外学习活动,研究了当前市场上主流蓝墨水的常见配方及性能,分析了蓝墨水汁迹久置变色可能的原因,并进一步组织了系列诸如蓝墨水污渍消除、茶叶末自制蓝墨水等的拓展性实验活动。
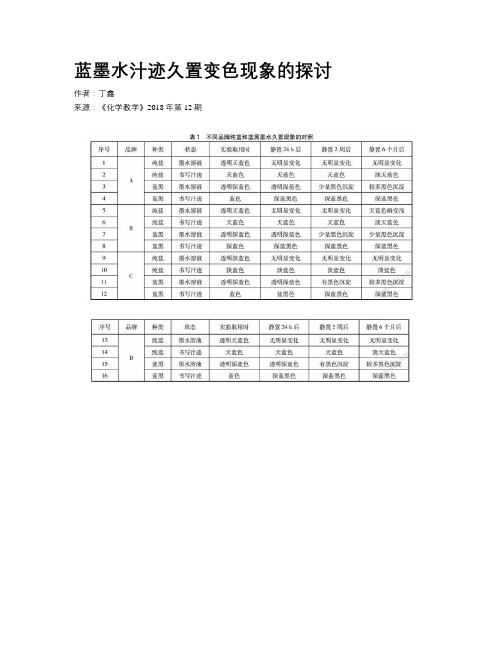
2实证探索2.1实验1:不同品牌纯蓝和蓝黑墨水汁迹变色的对比随机购买了市场上常见的A、 B、 C、 D等4个品牌的纯蓝和蓝黑各两款墨水。
在约25℃室温、自然通风的实验室条件下,将新开封后的两组蓝色墨水溶液(置于带胶塞的试管中)及其书写汁迹在放置不同时间段后的现象进行影像留底并对照,具体实验结果见表1。
实验表明,不同品牌的纯蓝墨水溶液及书写汁迹性质较稳定,并不存在久置颜色加深的现象,反而纯蓝墨水书写的文字在放置6个月后都出现了不同程度变浅的问题,不适宜长期保存;蓝黑墨水隔夜放置汁迹颜色即会从(深)蓝色明显变为深蓝黑色,长期(6个月以上)自然放置无褪色情况发生,当不同品牌的蓝黑墨水溶液久置时则会不同程度地出现黑色沉淀的现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸性蓝黑B
目的要求
了解双偶氮染料的反应原理和合成方法
原理
(1)对硝基苯胺重氮化
(2)第一次偶合(酸性耦合)
(3)苯胺重氮化
(4)第二次耦合(碱性偶合)
主要试剂及仪器
对硝基苯胺H酸苯胺盐酸亚硝酸钠碳酸钠烧杯搅拌器温度计滴液漏斗等
实验步骤
在250毫升烧杯内加入1.8克对硝基苯胺、60毫升水和7.5毫升30%盐酸。
稍微加热,使对硝基苯胺全部溶解。
再将溶液冷却至0℃,一次加入0.9克亚硝酸钠,并在5—10℃搅拌半小时,得澄清淡黄色溶液。
它应对刚果红试纸呈蓝色;淀粉碘化钾试纸呈微蓝色。
过量的亚硝酸用少量尿素破坏,并应对淀粉碘化钾试纸不变色。
在150毫升烧杯中加入4.7克H酸、25毫升水,逐渐加入0.7克碳酸钾,使H酸全部溶解。
将此溶液慢慢加入到上述重氮盐溶液中。
加毕反应液,PH应在3—4之间,然后在5—10℃下搅拌3.5小时,直至反应液中重氮盐消失为止。
最后将反应液倒入600毫升烧杯中,搅拌下慢慢加入8.8克碳酸钠,冷却至5℃待用。
