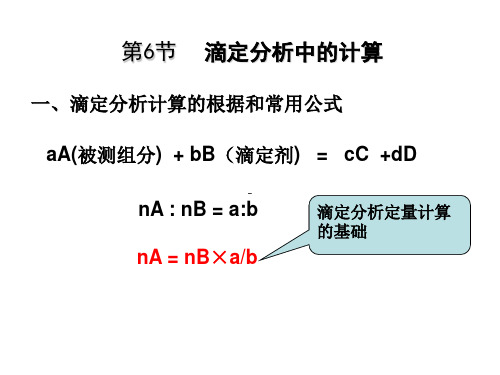
滴定分析计算
滴定分析的计算

0.5000×V+0.09760×4800 = 0.1000 ×(4800+V)
V=28.80mL
2. 标定溶液浓度的有关计算
基本公式:
mA a cBVB MA b
例1: 称取邻苯二甲酸氢钾(KHP)基准物质0.4925
克,标定NaOH溶液,终点时用去NaOH溶液 23.50mL,求NaOH溶液的浓度。MKHP=204.2 解: NaOH + KHP = NaKP + H2O
已知:M(KHP)=204.22 g.mol-1,
M(H2C2O4.2H2O)=126.07 g.mol-1
解:以邻苯二甲酸氢钾(KHP)为基准物质, 其滴定反应为: KHP + NaOH = KNaP + H2O 即 nKHP nNaOH
mKHP (cV )NaOH M KHP
V=20 mKHP=0.10 g.mol-1 2010-3L204.22 g.mol-1=0.40g V=25 mKHP=0.10 g.mol-1 2510-3L204.22 g.mol-1=0.50g
3.被测物质的质量和质量分数的计算
基本公式:
a m A cBVB M A b m A a cBVB M A wA mS b mS
例1: 测定工业纯碱Na2CO3的含量,称取
0.2560g试样,用0.2000mol.L-1 HCl标液滴
定,若终点时消耗HCl标液22.93mL,计 算试样中Na2CO3的百分含量。
解: Ca2+ + C2O42- = CaC2O4
CaC2O4 + H2SO4 = CaSO4 + H2C2O4 = 10CO2 +2MnSO4+K2SO4 + 8H2O
分析化学第三章滴定分析

• C(1/6K2Cr2O7)=? C(K2Cr2O7) • v(1/6K2Cr2O7)=? V(K2Cr2O7) • m(1/6K2Cr2O7)=? m(K2Cr2O7)
配制C(1/6K2Cr2O7)=0.05000mol/L重铬酸钾 标准溶液1L,应称取纯K2Cr2O7多少克?
解:滴定反应2HClNa2CO32NaClCO2 H2O
n
Na2CO3
1 2
nHCl
1 2
cHClVHCl
wNa2CO3
mNa2CO3 m样
100%
1 2
cHClVHCl
M
m样
Na2CO3
100%
0.50.207121.45103106.0100% 95.82%
根据滴定度的概念可得 T=C(KMnO4)×1mL×10-3×5×M(Fe) =0.02718×0.001×5×55.845=0.007590g/mL
2019/7/23
第五节 滴定分析结果的计算
1. 方法一、 根据被测物的物质的量nA与滴定剂的物 质的量nB 的关系
aA+bB = cC+dD 当达到化学计量点时amolA恰好与bmolB作用完全
2019/7/23
二 滴定操作方式
1.直接滴定 标准溶液直接滴定被测物质。最基本的一种滴定方式 。能够应用于直接滴定的化学反应,必须符合:
(1)反应定量; (2)反应必须完全,通常达到99.9%以上; (3)反应必须迅速; (4)有确定滴定终点的简便方法。
2019/7/23
2.返滴定
反应虽可进行完全,但速度慢。 先准确加入过量的一种标准溶液,充分反应后用 另一种标准溶液滴定过量的第一种标液。 根据两标液的物质的量和计量关系式推算出被测 组分的含量。 例如,HCl滴CaCO3
第6节 滴定分析的计算

第六节 滴定分析的计算
第六节
滴定分析的计算
一、基本单元的概念
SI和国家标准规定,基本单元可以是分子、原 子、离子、电子等基本粒子,也可以是这些基本粒 子的特定组合。在滴定分析中,通常以实际反应的 最小单元为基本单元。对于质子转移的酸碱反应, 通常以转移一个质子的特定组合作为反应物的基本 单元。
第四章
第六节 滴定分析的计算
二、计算示例
1、两种溶液间的滴定计算 在滴定分析中,若以cA表示待测组分A以A为基本 单元的物质的量浓度,cB表示滴定剂B以B为基本单元 的物质的量浓度,VA、VB分别代表A、B两种溶液的体
积,则达到化学计量点时,依据等物质的量规则,应
存在下列等式:
cAVA = cBVB
第四章
习题
4-6 已知盐酸的质量浓度为1.19g/mL,其中HCl的质 量分数为36%,求每升盐酸中所含有的n(HCl)及盐酸的
c(HCl)各为多少?
问应称取基准碳酸钠多少克?
4-7 欲配制0.1000mol/L的碳酸钠标准滴定溶液500mL, 4-8 准确移取25.00mL硫酸溶液,用0.09026mol/L氢
V—试液的体积,L。
第四章 4、有关滴浓度的计算
第六节 滴定分析的计算
滴定度是指1mL标准滴定溶液B相当于待测组分A的质 量,以TA/B表示,单位为g/mL。 滴定度和物质的量浓度之间的换算关系为: cB M A TA/B ═ (4-23) 1000 式中 cB—标准滴定溶液B以B为基本单元的物质的 量浓度,mol/L; TA/B—标准滴定溶液B对待测组分A的滴定度, g/mL; MA—待测组分A以A为基本单元的摩尔质量, g/mol。
第四章
习题
4-3 一铜矿试样,经两次测定,铜的质量分数为 24.87%,24.93%,而铜的实际质量分数为24.95%,求分 析结果的绝对误差和相对误差? 4-4 分析铁矿中铁的含量,得到如下数据:37.45%, 37.20%,37.50%,37.30%,37.25%。计算该组数据的平 均值、平均偏差、标准偏差和变异系数。 4-5 测定某有机样品中的氯含量,得到下列结果: 15.48%,15.51%,15.52%,15.53%,15.52%,15.56%, 15.53%,15.54%,15.68%,15.56%,试用Q检验法判断有 无可疑值需弃去(置信度为90%)?
第三节 滴定分析的计算

n
A
t
n
T
例如:已知基准物质的质量mT,求被滴定溶液的浓 度CA ,则用:nA = CA VA nT = mT/MT
即:
am CV t M
A A
T
T
本节小结
1、滴定液配制的计算 配置前物质的状态是固体: CTVT = mT/MT 配置前物质的状态是液体: C1V1 = C2V2 2、滴定分析的计算 反应式:aA + tT cC + dD A为待测物质,T为滴定液 基本计算公式:aA = a/t ·nT ①若待测物A为液体,滴定剂B为液体,即液-液反应,则:
C1V1=C2V2
一、滴定液配制的计算 (二)应用实例 例1 准确称取基准K2Cr2O7 5.001g,溶解后稀释至1000ml 的容量瓶中,则配成的K2Cr2O7浓度是多大? C(K2Cr2O7) = m/MV = 0.01670 mol/L 例2 欲配制浓度为0.1mol/L盐酸溶液1000ml,应取浓度为 12mol/L的浓盐酸的体积为多少毫升? VHCI = C2V2/C1 = 8.3(ml) 例3 市售浓盐酸密度为1.19g/ml,质量分数为0.37,求浓 盐酸物质的量浓度。 1000ρω
V(NaOH) = 23.80(ml) 2、滴定液的标定 (1)用基准物质标定滴定液 例2 为标定HCI溶液,去硼砂(Na2B4O7· 10H2O) 0.4709g,用HCI滴定至化学计量点,消耗HCI25.20ml,求 HCI溶液的物质的量浓度。 C(HCI)=0.09803(mol/L)
例1
(二)应用实例 2、滴定液的标定 (2)用另一已知准确浓度的滴定液标定 例3 20.00ml未知浓度的NaOH溶液,用0.09984mol/L的 HCI滴定液滴定,达到计量点时用去22.40ml HCI溶液,计 算此NaOH溶液的物质的量浓度。 3、含量计算 C(NaOH)= 0.1118(mol/L)
第4章2滴定分析计算

2、分析氢氧化钠的纯度时,如果欲使 0.1500mol/LHCl标准溶液的体积(以ml为单位)乘 以2等于试样中NaOH的百分含量,问分析时应称取 试样的质量为多少克?
S=(0.1500×4.00g)/2
=0.3000g 答: 应称取试样的质量为0.3000g
约为37%。计算(1)每升浓盐酸中所含HCl的物质
的量浓度;(2)欲配制浓度为0.10mol/L的稀盐酸
500ml,需量取上述浓盐酸多少毫升?
解:(1) nHCll=(m/M)HCl=1.19×1000×0.37/36.46 =12 mol
cHCl=nHCl/VHCl=(m/M)HCl/ VHCl =(1.19×1000×0.37/36.46)/1.0=12 mol/L
=0.6740 g
第十四讲
第四章 滴定分析法概论
14-5
(二) 标定溶液浓度的有关计算
基本公式 mA / M A (a / b)cBVB
例3 用Na2B4O7·10H2O标定HCl溶液的 浓度,称取0.4806g硼砂,滴定至终点时消耗 HCl溶液25.20ml,计算HCl溶液的浓度。
解:Na2B4O7+2HCl +5H2O = 4H3BO3 +2NaCl n(Na2B4O7)=(1/2)n(HCl)
=0.006702 g/ml
同理可得:
c(K2Cr2O7)/1000=(1/3)T K2Cr2O7/Fe2O3/MFe2O3 T K2Cr2O7/Fe2O3= c(K2Cr2O7)×MFe2O3×3/1000
=0.009581 g/ml
4.6 滴定分析的计算

3.求待测组分 的质量分数及质量浓度 求待测组分A的质量分数及质量浓度 求待测组分
设测定时称取试样的质量为ms (g) 设测定时称取试样的质量为 则待测组分的质量分数为
mA wA = ms
c BV B M A wA = ms
量取试液的体积为Vs (L) 量取试液的体积为 待测组分的质量浓度为
mA cBVB M A ρA= = Vs Vs
基本单元的确定
2HCl + Na2CO3 2NaCl + H2O + CO2↑
反应中盐酸给出一个质子,碳酸钠接受2 反应中盐酸给出一个质子,碳酸钠接受2个 1 质子,因此分别选取 选取HCl和 Na2CO3 作为 质子,因此分别选取 和 2 基本单元。 基本单元。由于反应中盐酸给出的质子数必 定等于碳酸钠接受的质子数, 定等于碳酸钠接受的质子数,因此根据质子 转移数选取基本单元后, 转移数选取基本单元后,反应到达化学计量 点时: 点时: 1 n(HCl) = n( Na2CO3)
解: 反应过程如下
2Fe2++MnO2(s)+4H+ 2Fe3++Mn2++2H2O Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
由反应式可知
1 2+)-n( 1 K Cr O ) n( MnO2)=n(Fe - 2 6 2 2 7 1 c( 6 K2Cr2O7) =6c(K2Cr2O7)
例1:
溶液500.00mL,需用 2C2O4 · 2H2O 需用Na 溶液 需用 多少克? 多少克 已知Na 解: 已知 2C2O4 · 2H2O的Mr=170.0 则 的
第六节 滴定分析中的计算
HCl 和NaOH溶液的浓度分别为 1.000 mol / L 和 1.200 mol / L
23.已知1.00mL某HCl标准溶液中含氯化氢0.004374g/mL,试计算: (1) 该HCl溶液对NaOH的滴定度THCL/NaOH; (2) 该HC1溶液对CaO的滴定度THCl/CaO。
解:(1)
THCl
NaOH
cHCl M NaOH 1000
1 0.004374 40.00 36.461000 1000
=0.004794g· -1 mL (2)
THCl CaO
cHCl M CaO 1000
1 0.004374 56.08 1 36.461000 1 2 1000 2
=0.003361g· -1 mL
25. 在1.000gCaCO3试样中加入0.5100 mol· -1HC1溶液50.00 ml, L 待完全反应后再用0.4900mol· -1NaOH 标准溶液返滴定过量的HC1溶液, L 用去了NaOH溶液25.00 mL。求CaCO3的纯度。
解:5C2O42- + 2MnO4- +16H+ = 10CO2 +2Mn2+ +8H2O
因此 n(Na2C2O4)=(5/2)n(KMnO4) (cV)(Na2C2O4)=(5/2)(cV)(KMnO4) 根据题意,有VNa2C2O4=VKMnO4,则 cNa2C2O4=(5/2)cKMnO4=2.5×0.02012mol.L-1 =0.05030 mol.L-1 mNa2C2O4=(cVM)Na2C2O4 =0.05030mol.L-1×100.0×10-3L×134.00g.mol-1 =0.6740 g
滴定分析的计算

.6 滴定分析的计算4.6.1 原料药含量测定结果计算原料药含量一般用百分含量(g/g)来表示。
例如:对氨基水杨酸钠含量测定取样品约0.4g,精密称定,用水18ml和盐酸溶液(1→2)15ml溶解,用亚硝酸钠标准液(L)滴定,每1ml的亚硝酸钠标准液(L)相当于的无水对氨基水杨酸钠。
假设取样量0.4326g,亚硝酸钠标准液浓度为L,终点时消耗,计算其含量(干燥失重%)。
实验测得的量含量=───────×100%供试品量已知,实验测得的量=VFT 供试品的量=W/N标准为终点时消耗标准液的体积(ml)其中V标准W 为称样量F 为浓度因数T 为滴定度N 为稀释倍数稀释倍数的意义为:第一次取样量为最后测定用供试品量的倍数。
原料药中一般为1。
原料药含量计算公式V标准×F×T×N V标准×C实际×T×N含量=────────×100%= ──────────×100%W W×C理论一般原料药含量是以干品计算,则原料药含量计算公式为:V标准×C实际×T×N含量=─────────────────×100%W×C理论×(1-干燥失重百分数)×××1则对氨基水杨酸钠含量=─────────────×100%=%。
××(1-%)4.6.2 液体制剂的含量测定结果计算液体制剂含量一般以相当于标示量的百分数表示。
标示量对固体制剂,即每一个单元制剂中所含药品的规定量;对液体制剂,最常用的表示方法为:每1ml中含有药物的规定量,或者本制剂的规定浓度。
例如:氯化钾注射液,规格为10ml:1g,它的标示量为0.1g或10%。
其含量测定方法;精密量取本品10ml,置100ml量瓶中,加水至刻度,摇匀,精密量取10ml,加水40ml,加糊精溶液(1→50)5ml,与指示剂5~8滴,用硝酸银标准液(L)滴定即得。
