imagej荧光定量方法
如何使用ImageJ测量荧光强度
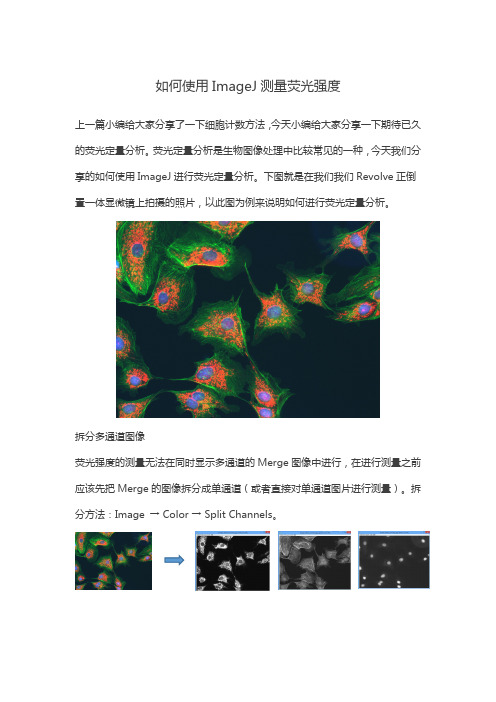
如何使用ImageJ 测量荧光强度上一篇小编给大家分享了一下细胞计数方法,今天小编给大家分享一下期待已久的荧光定量分析。
荧光定量分析是生物图像处理中比较常见的一种,今天我们分享的如何使用ImageJ 进行荧光定量分析。
下图就是在我们我们Revolve 正倒置一体显微镜上拍摄的照片,以此图为例来说明如何进行荧光定量分析。
拆分多通道图像荧光强度的测量无法在同时显示多通道的Merge 图像中进行,在进行测量之前应该先把Merge 的图像拆分成单通道(或者直接对单通道图片进行测量)。
拆分方法:Image →Color →Split Channels。
图像分割在图像计算的角度而言,图像分割(Image Segmentation)便是将图片分割为多个片段的过程,其目的是简化图像不同部分的象征意义以便于图像分析。
常用的图像分割技术主要用来定位图像中的目标物体并勾画出其边界。
ImageJ中可通过多种方法实现图像分割,在此我们先介绍一下最基本的一种-手动图像分割。
此种方法主要通过控制图像直方图中的强度阈值来实现,分割出阈值范围内的图像区域,并进行后续的测量分析。
实现方法:Image→Adjust→Threshold,红色蒙版即代表选中区域。
测量荧光强度实现方法:Analyse→Measure。
注意:默认数值显示的是整张图片的荧光强度和面积,我们需要进行参数设定才可以显示所选区域的统计值。
如果需要导出数据或者设定测量参数,点击右键(也可以通过Analyse→Set Measurement实现),选中Limite to threshold和Area fraction。
好啦,现在进行Analyse→Measure,就可以得到想要的统计值了。
imagej荧光定量方法

1、安装后首先打开ImageJ:2、打开要分析图片:File>open(热键为Ctrl+O)3、转换成8bit的灰度图:Image>Type>8-bit4、黑白反转(因为对于光密度(OD)来说越白数值越小,纯白为0;越黑数值越大,纯黑理论上是无限大。
因此我们需要将上一步所转换的灰度图进行黑白反转,不然的话测出来的数值就会荧光越亮反而数值越小):Edit>Invert(热键为Ctrl+Shift+I)5、校正光密度(软件默认为测量灰度,因此我们要改为更加适用的光密度,其中原理不是一两句话能说得清的,这里忽略):Analyze>Calibrate在弹出来的界面的Function选择Uncalibrated OD,并下界面左下方勾选Global calibration,然后点击右下角的OK点击OK后会跳出校正后的光密度曲线:如不勾选Global calibration,光密度的校正只对这张图片有效,一般分析都要分析多张图片,所以需要勾选,勾选后在打开另一图片时会提示是否将此校正应用于所有图片,不勾选Disable Global Calibration,勾选Disable these Messages6、选择测量单位(一般选择象素,如有明确的比例,也可以选择相应单位):Analyze>Set scale点击后在弹出的界面里点击中间的click to Remove Scale,并勾选下面的Global(同样的,如不选Global这个测量单位的选择只对这张图片有效),最后点击OK7、选择测量项目:Analyze>Set Measurements在弹出界面中选择我们需要测量的项目Area、Integrated density,并勾选下面的Limit to threshold (这个选项是指只测量我们选中的范围,如不勾选侧会测量整张图片数据),选择后点击OK8、选择测量域值:Image>Adjust>Threshold(热键为Ctrl+Shift+T)滑动弹出界面中间的滑块选择适合的域值,以使的你图片中的细胞或待测目标刚好全部被选中,选好之后点击右下角的Set在弹出来的界面点击OK9、测量:Analyze>Measure(热键为Ctrl+M或直接按M)10、记录数据并计算:结果中的Area为选择范围的面积,如果是测量的是细胞的话就是细胞在图中的面积;IntDen就是所选范围的IOD(光密度的总和)。
imagej荧光共定位细胞计数

imagej荧光共定位细胞计数什么是荧光共定位细胞计数?荧光共定位细胞计数是一种通过荧光显微镜观察和计数具有特定荧光信号的细胞的方法。
在荧光共定位实验中,研究人员会用不同的荧光标记物标记细胞内的特定组分或标记蛋白质,然后使用荧光显微镜观察并计数这些特定标记物的细胞数量。
荧光共定位细胞计数的步骤:1. 提取和准备细胞样品首先,我们需要提取或准备需要观察的细胞样品。
这可以是细胞培养物、组织切片或是染色后的细胞。
确保样品制备的质量良好,以避免结果的误差。
2. 标记荧光探针在荧光共定位细胞计数实验中,荧光探针用于标记需要研究的细胞组分或蛋白质。
通常,我们会使用荧光染料或荧光标记的抗体标注感兴趣的分子。
确保选择的荧光探针具有明亮、稳定的荧光信号。
3. 孵育样品将标记有荧光探针的细胞样品与适当的培养基混合,并在恒温孵育箱中以适当的时间和温度进行孵育。
孵育的目的是使探针与样品充分结合,以获得可观察的荧光信号。
4. 制备玻璃载玻片在细胞孵育的同时,我们需要在玻璃载玻片上制备样品。
通常,可以通过将准备好的细胞悬液滴在载玻片上,然后用封闭剂封闭样品,以防止样品干燥和污染。
5. 荧光显微镜观察使用荧光显微镜观察荧光共定位细胞计数实验的样品。
通过显微镜可以放大和记录样品中荧光信号的图像。
确保设置合适的荧光滤光片和适当的显微镜参数,以获得高质量的荧光显像图像。
6. 细胞计数和分析在荧光显微镜下观察到的荧光信号是特定标记物的细胞。
使用图像分析软件或手动计数的方法计算并记录荧光共定位细胞的数量。
此步骤的关键是准确选择感兴趣的细胞类型或特定的荧光信号。
7. 数据统计和分析将细胞计数结果进行统计和分析。
根据实验的设计和研究的问题,可以使用适当的统计学方法对结果进行处理。
需要注意的是,荧光共定位细胞计数是一项复杂而精细的实验技术,需要研究者具备一定的实验技巧和经验。
此外,选择合适的荧光标记物和显微镜参数也是确保实验结果准确性的关键。
image j 荧光强度计算单位

image j 荧光强度计算单位
摘要:
一、Image J软件介绍
二、荧光强度计算方法
三、具体操作步骤
四、注意事项
正文:
一、Image J软件介绍
Image J是一款广泛应用于生物图像分析的免费开源软件。
它具有强大的图像处理和分析功能,尤其在荧光图像分析方面有着出色的表现。
本文将详细介绍如何利用Image J测量荧光强度。
二、荧光强度计算方法
在Image J中,荧光强度的计算是基于像素值的。
每个像素的荧光强度可以通过其对应的强度值(灰度值)来表示。
强度值的范围通常是从0(黑色)到255(白色)。
荧光强度计算公式为:荧光强度(A.U)=(最大强度值-最小强度值)/总像素数。
三、具体操作步骤
1.打开图片:启动Image J软件,点击“文件”-“打开”,选择需要分析的荧光图片。
2.颜色通道分割:点击“图像”-“颜色”-“分割通道”,将颜色分割为红色、绿色和蓝色通道。
根据需要选择相应的颜色通道进行分析。
3.阈值调整:点击“图像”-“调整”-“阈值”,勾选“黑暗”,调整阈值范围以优化荧光信号的显示。
4.测量荧光强度:在调整好的图像上,点击“测量”-“区域测量”,选择合适的测量区域,软件将自动计算并显示荧光强度。
四、注意事项
1.确保光源稳定,避免荧光强度测量误差。
2.在图像处理过程中,避免过度调整阈值,以免影响荧光强度的准确性。
3.对于多个荧光通道的图像,可以分别进行荧光强度测量,以便后续的数据分析。
细胞荧光怎么定量?

细胞荧光怎么定量?总觉得将荧光图放在文章中,瞬间就找到了高大上的感觉!今天我们将给大家分享一项科研必备技能—ImageJ之细胞荧光定量(简单6步,保证你能学会哦)以计算下图荧光强度为例(同一条件下拍摄):1、导入图片:File→open:打开要测量的荧光图2、转换图片格式:Image→Type→16-bit (调成灰度图片,此步骤非常重要,但可根据需要调成8或32bit)3、设置需测量参数:Analyze→Set Measurements在弹出的设置选项框中勾选测量对象:1面积(Area);2平均灰度值(Mean);3累积光密度(IntDen)后,点击OK(PS:累积光密度=面积x平均灰度值,即:IntDen=Area * Mean)4、调出ROI Manager界面:Analyze→Tools→ROI Manger5、在图片上选择测量对象(带荧光的细胞以及背景)并计算a 点击主界面的套索工具b 点击test1图,用套索工具在图上勾画出一个荧光细胞轮廓后,在ROI Manager界面点击Add,在下图框2处会出现一个对象,点中后选择框3的Rename,重命名对象,因为是测量的第一个细胞,此例按顺序重命名为1点击OKc 按照步骤b继续用套索工具在test1图上勾选出多个测量对象,并按照顺序以及目的重命名,如:本例勾画了6个待测对象以及3个背景对象,如下图所示,选择好对象后,在ROI Manager界面中的框1处,按住shift键选择所有测量对象,然后点击框2处Measured点击Measure后,弹出下框结果值,其中Area列举了每个对象的面积;Mean为每个对象的平均灰度值;IntDen表示为每个对象的累积光密度6 、整理数据将步骤5得到的结果图拷贝至EXCEL表格中,由于1-6号为待测细胞,7-9号为背景对象,我们求出背景7、8、9的平均光密度后,校正后的累积光密度=累积光密度-待测细胞面积*背景平均光密度即IntDen(校正)=IntDen-Area*Mean(背景)7、同理重复上述步骤继续测量test2或其它图片的荧光强度将得到的结果进行整理,即可做出用于发表的图片啦,当然为了结果尽可能的准确你需要选取更多的测量对象这次分享的ImageJ新技能,你学会了吗?你们还有哪些技能想要get呢?欢迎文末留言,小张团队将继续为您分享神器技能笔记!。
imagej 免疫荧光 细胞数 区域

imagej 免疫荧光细胞数区域免疫荧光技术已经成为生物医学领域中一项不可或缺的重要技术,通过对细胞内某种特定蛋白的荧光标记,可以使其在显微镜下呈现出明亮的荧光信号,从而帮助研究人员观察和分析细胞内不同分子的位置和数量。
在免疫荧光实验中,ImageJ软件作为一款功能强大且免费开放的图像处理软件,被广泛应用于细胞数的统计以及区域的分析。
在免疫荧光实验中,经常需要对细胞进行计数以及对感兴趣的细胞区域进行定量分析。
细胞数的统计可以帮助研究人员了解不同实验组之间细胞数量的差异,而区域的分析则可以帮助研究人员对细胞内特定分子的表达情况进行定量研究。
在这一过程中,ImageJ软件提供了一系列的功能和工具,使得细胞数和区域的分析变得更加高效和准确。
首先,使用ImageJ软件进行免疫荧光细胞数的统计,研究人员首先需要加载荧光显微镜拍摄的图像,并对图像进行预处理,包括调整图像的亮度、对比度以及去除背景噪音等操作,以确保后续的图像分析能够更加准确。
接着,利用ImageJ软件的计数功能,研究人员可以通过手动或自动方式对荧光图像中的细胞进行计数,同时软件还可以提供细胞数的统计结果,并生成相应的统计图表,方便研究人员对实验结果进行分析和比较。
其次,ImageJ软件在对细胞区域进行定量分析方面也发挥着重要作用。
通过使用软件中的区域分析功能,研究人员可以对Fe的感兴趣区域进行选择和标记,并对该区域中的荧光强度或面积等参数进行测量和分析。
通过这些定量分析,研究人员可以了解感兴趣区域中特定蛋白的表达水平以及分布情况,为进一步研究提供重要参考。
除此之外,ImageJ软件还具有丰富的插件和脚本功能,可以进一步扩展软件的功能和应用范围。
例如,通过安装适当的插件,研究人员可以对细胞中多个荧光通道进行分析,从而实现多种荧光蛋白标记在同一细胞中的定量分析。
此外,通过编写自定义的脚本,研究人员还可以实现对复杂图像分析算法的自动化操作,提高图像分析的效率和准确性。
如何使用ImageJ测量荧光强度

如何使用ImageJ 测量荧光强度上一篇小编给大家分享了一下细胞计数方法,今天小编给大家分享一下期待已久的荧光定量分析。
荧光定量分析是生物图像处理中比较常见的一种,今天我们分享的如何使用ImageJ 进行荧光定量分析。
下图就是在我们我们Revolve 正倒置一体显微镜上拍摄的照片,以此图为例来说明如何进行荧光定量分析。
拆分多通道图像荧光强度的测量无法在同时显示多通道的Merge 图像中进行,在进行测量之前应该先把Merge 的图像拆分成单通道(或者直接对单通道图片进行测量)。
拆分方法:Image →Color →Split Channels。
图像分割在图像计算的角度而言,图像分割(Image Segmentation)便是将图片分割为多个片段的过程,其目的是简化图像不同部分的象征意义以便于图像分析。
常用的图像分割技术主要用来定位图像中的目标物体并勾画出其边界。
ImageJ中可通过多种方法实现图像分割,在此我们先介绍一下最基本的一种-手动图像分割。
此种方法主要通过控制图像直方图中的强度阈值来实现,分割出阈值范围内的图像区域,并进行后续的测量分析。
实现方法:Image→Adjust→Threshold,红色蒙版即代表选中区域。
测量荧光强度实现方法:Analyse→Measure。
注意:默认数值显示的是整张图片的荧光强度和面积,我们需要进行参数设定才可以显示所选区域的统计值。
如果需要导出数据或者设定测量参数,点击右键(也可以通过Analyse→Set Measurement实现),选中Limite to threshold和Area fraction。
好啦,现在进行Analyse→Measure,就可以得到想要的统计值了。
imageJ测荧光
这里是它的官网:/ij/正题1、安装后首先打开ImageJ:2、打开要分析图片:File>open(热键为Ctrl+O)3、转换成8bit的灰度图:Image>Type>8-bit4、黑白反转(因为对于光密度(OD)来说越白数值越小,纯白为0;越黑数值越大,纯黑理论上是无限大。
因此我们需要将上一步所转换的灰度图进行黑白反转,不然的话测出来的数值就会荧光越亮反而数值越小):Edit>Invert(热键为Ctrl+Shift+I)以下为从左到右分别为原图、8bit灰度图及反转后的图:5、校正光密度(软件默认为测量灰度,因此我们要改为更加适用的光密度,其中原理不是一两句话能说得清的,这里忽略):Analyze>Calibrate在弹出来的界面的Function选择Uncalibrated OD,并下界面左下方勾选Global calibration,然后点击右下角的OK点击OK后会跳出校正后的光密度曲线:如不勾选Global calibration,光密度的校正只对这张图片有效,一般分析都要分析多张图片,所以需要勾选,勾选后在打开另一图片时会提示是否将此校正应用于所有图片,不勾选Disable Global Calibration,勾选Disable these Messages6、选择测量单位(一般选择象素,如有明确的比例,也可以选择相应单位):Analyze>Set scale点击后在弹出的界面里点击中间的click to Remove Scale,并勾选下面的Global(同样的,如不选Global 这个测量单位的选择只对这张图片有效),最后点击OK7、选择测量项目:Analyze>Set Measurements在弹出界面中选择我们需要测量的项目Area、Integrated density,并勾选下面的Limit to threshold(这个选项是指只测量我们选中的范围,如不勾选侧会测量整张图片数据),选择后点击OK8、选择测量域值:Image>Adjust>Threshold(热键为Ctrl+Shift+T)滑动弹出界面中间的滑块选择适合的域值,以使的你图片中的细胞或待测目标刚好全部被选中,选好之后点击右下角的Set在弹出来的界面点击OK9、测量:Analyze>Measure(热键为Ctrl+M或直接按M)10、记录数据并计算:结果中的Area为选择范围的面积,如果是测量的是细胞的话就是细胞在图中的面积;IntDen就是所选范围的IOD(光密度的总和)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、安装后首先打开ImageJ:
2、
3、
4、黑白反转(因为对于光密度(OD)来说越白数值越小,纯白为0;越黑数值越大,纯黑理论上是无限大。
因此我们
5、校正光密度(软件默认为测量灰度,因此我们要改为更加适用的光密度,其中原理不是一两句话能说得清的,这里
在弹出来的界面的Function选择Uncalibrated OD,并下界面左下方勾选Global calibration,然后点击右下角的OK
点击OK后会跳出校正后的光密度曲线:
如不勾选Global calibration,光密度的校正只对这张图片有效,一般分析都要分析多张图片,所以需要勾选,勾选后在打开另一图片时会提示是否将此校正应用于所有图片,不勾选Disable Global Calibration,勾选Disable these Messages
6、
量单位的选择只对这张图片有效),最后点击OK
7、
只测量我们选中的范围,如不勾选侧会测量整张图片数据),选择后点击OK
在弹出来的界面点击OK
9、
10、记录数据并计算:
结果中的Area为选择范围的面积,如果是测量的是细胞的话就是细胞在图中的面积;IntDen就是所选范围的IOD (光密度的总和)。
结果界面中的数据可以复制到Excel等软件中进行计算。
(/pixel)用IntDen的数值除以Area的数值得出来的就是这张图片中细胞的平均光密度,以这张图片的数据为例,即:
同法测量多张图的平均光密度值后就可以进行半定量比较。
以下附上分别应用Image-Pro Plus及ImageJ对五张图片进行分析的结果对比:
从结果的对比看来ImageJ与IPP(Image-Pro Plus)的分析结果是基本一致的。
