仪器分析技术W3201-4-微教材
《仪器分析》简编教材

前言本书是根据《仪器分析》教学大纲要求,结合我校质量监督与检验专业教学需要,并根据编者多年的仪器分析教学实践而编写的。
适用于三年制中专质量监督与检验专业、食品专业及其它相关专业使用。
仪器分析方法很多,实践性也较强。
本书力求结合中职教育的特点,少理论,多实践,重实用,深入浅出,易学易懂,并突出培养学生的动手能力和创新思维。
本书所选用的仪器分析方法是质量监督与检验工作中常用的分析方法,书中介绍了其方法的原理、仪器使用与维护、定量分析与实验操作技术等知识点;为提高学生的动手和思考解决问题能力,每章后附有大量的习题和基本实验,用以帮助理解巩固所学内容。
本书在编写过程中,突出以学生为主体的教学思想,以拓宽学生知识面、激发学生求知欲、培养学生创新思维为己任,增强内容的科学性和趣味性;每章后列有本章知识要点和重点,以帮助学生自学掌握。
本书经闫桂甫校长、陆霞主任在百忙中审阅并提出宝贵意见,在此深表谢意。
本书在编写过程中,还受惠于汪建、徐慧琴及其它教师的指导和大力协助,,一并表示感谢。
限于编者水平和经验,书中难免存在缺点和错误,恳请专家和读者批评指正,将不胜感谢。
编者2009年元月目录1.绪论 (1)1.1 仪器分析法概述 (1)1.2 仪器分析法的基本内容和分类 (1)1.3 仪器分析的作用 (2)2. 比色及紫外可见分光光度法 (5)2.1 概述 (5)2.2 基本原理 (6)2.4 目视比色法与比浊法 (11)2.5 紫外-可见分光光度法 (13)2.6 显色与操作条件的选择 (19)实验部分 (27)实验2.1 目视比色法测定高锰酸钾含量 (27)实验2.2 目视比浊法测定氯化铵中硫酸根含量 (28)实验2.3 分光光度计波长的校正和吸收曲线测绘 (30)实验2.4 邻菲罗啉分光光度法测定微量铁 (32)实验2.5 邻菲罗啉法测定铁条件实验 (35)实验2.6 水中正磷酸盐含量的测定(国家行业标准) (38)实验2.7 水中六价铬的测定(二苯碳酰二肼分光光度法) (41)实验2.8 高锰酸钾和重铬酸钾混合液的测定 (44)实验2.9 分光光度法测定混合液中的钴和铬 (47)实验2.10 紫外吸收光谱的测绘应用 (50)实验 2.11 紫外分光光度法测定水中硝酸盐氮含量 (52)实验2.12 紫外分光光度法测啤酒中双乙酰的含量 (54)实验2.13 粉条中二氧化硫残留量的测定 (57)实验2.14 分光光度法测定果、蔬中维生素C含量 (60)附1. 可见分光光度计的原理、结构和使用方法 (63)附2 比色皿使用方法 (66)附 3 紫外分光光度计特点及操作方法 (66)3.电位分析 (70)3.1 概述 (70)3.2. 指示电极与参比电极 (71)3.3 溶液 pH值的测定 (73)3.4 离子选择性电极测定离子的浓度 (75)实验部分 (78)实验3.1 水样pH值的测定 (78)实验3.2 电位法测定水中氟离子含量 (81)附4 酸度计的原理与使用方法 (84)附5 仪器分析实验要求 (88)附6 分析仪器及设备使用的一般规则 (90)附 7 实验室规则 (91)附8 实验室安全规则 (92)主要参考文献 (1)1.绪论1.1 仪器分析法概述分析化学是研究检测物质的结构、组成的科学,它包括化学分析和仪器分析两部分,化学分析是根据物质的化学性质,通过化学反应来测定物质组成及相对含量的,如滴定分析、称量分析等;而仪器分析则是根据物质的物理性质或物理化学性质,通过精密仪器的测定来确定物质组成、结构及含量的,因此化学分析和仪器分析是分析化学的两种手段,化学分析是基础,仪器分析是发展方向。
生产环境与农业品投入检测W3202-4-肥料分析样品制备微教材

《肥料分析样品制备》课程-微教材肥料分析样品的制备一、肥料样品制备概述(一)肥料样品制备的概念肥料样品的制备是指通过缩分、研磨、过筛等操作,将取得的原始肥料样品制备成供分析用的实验室样品。
(二)肥料样品制备的原理通过缩分器或者四分法等方法将样品分成两个相等部分,借弃去部分样品和混合部分样品已将样品缩小至需要量,然后研磨至通过规定筛孔,以获得均匀的、有代表性的、供分析用的实验室样品(通称试样)。
(三)肥料样品制备的目的1.便于运输或储存。
2.使样品均匀化。
3.增强代表性以利于分析测试。
(四)肥料样品制备需注意事项1. 防止样品号码错乱。
2. 样品制备方案确定后,操作过程中不能任意改动。
3. 疏松物样品在第一次过筛前一般不要研磨。
4. 不同样品要严格区分处理工具,严禁污染。
二、肥料样品制备的方法(一)样品缩分1. 样品缩分的概念样品缩分(sample splitting)是化学分析等样品加工的步骤之一,是按一定的要求,将破碎到一定颗粒直径的样品,分为若干份具有同等可靠性的样品,或在加工、破碎以前对原始样品进行缩减的操作过程。
2. 样品缩分的前提样品缩分的目的,是在保证样品可靠性的前提下,减少后续破碎的工作量或原始样品的运输量,加快样品的加工速度。
样品每进行一次缩分前,均需将样品充分混匀。
缩分后所得样品的重量,必须大于当时颗粒直径情况下所要求的样品最小可靠重量。
3. 样品缩分的方法介绍四分法缩分(sample quartering)是一种重要的缩分方法。
即将各个采集回来的样品进行充分混合均匀后,堆为一堆,从正中划“十”字,再将“十”字的对角两份分出来,混合均匀再从正中划“十”字,这样直至达到所需要的数量为止即为检验样品。
(二)样品研磨样品研磨是指通过研磨工具对样品的研磨,使样品颗粒能通过规定筛孔,以获得符合实验要求的粒度。
(三)样品过筛样品过筛是指将经过研磨的样品过筛,以获得均匀的、有代表性的、供分析用的实验室样品。
仪器分析技术W4502-4-微教材
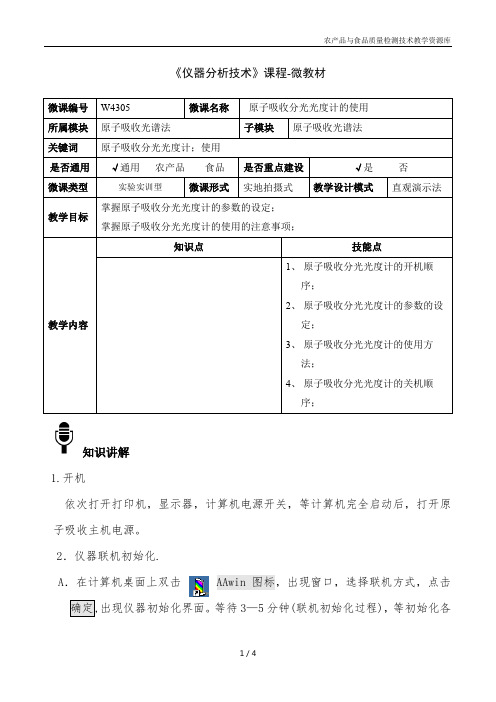
《仪器分析技术》课程-微教材知识讲解1.开机依次打开打印机,显示器,计算机电源开关,等计算机完全启动后,打开原子吸收主机电源。
2.仪器联机初始化.A .在计算机桌面上双击 AAwin 图标,出现窗口,选择联机方式,点击出现仪器初始化界面。
等待3—5分钟(联机初始化过程),等初始化各项出现确定后,B.依照用户需要选择工作灯和预热灯(双击元素灯位置,可更改所在灯位置上的元素符号)。
点C.可以根据需要更改光谱带宽,燃气流量,燃烧器高度等参数,(一般工作灯电流,预热灯电流和负高压以及燃烧器位置不用更改。
)D.不要更改默认的波长值,直接点击寻峰。
将弹出寻峰窗口,(根据所选元素灯元素不同,整个过程需要时间不同,一般在1—3分钟)等寻峰过程完成3.设置样品点击A.选择校正方法(一般为标准曲线法),曲线方程(一般为一次方程),和浓度B.输入标准样品的浓度和个数(可依照提示增加和减少标准样品的数量),点CD.输入待测样品数量,名称,起始编号,以及相应的稀释倍数等信息,点击4.设置参数点击A均值)选择测量方式(手动或自动,一般为自动),输入间隔时间和采样延时(一般均为1秒)B0—0.7)以及刷新时间(一般300秒)C设置计算方式(一般火焰吸收为连续或峰高,石墨炉多用峰面积),以及积分时间和滤波系数。
(火焰积分时间一般为1滤波系数为0.3秒,石墨炉多用5秒和1秒)D(适用于带自动进样的设备)5.火焰吸收的光路调整光路平行并位于光路正下方。
(如不平行,可以通过用手调节燃烧头角度来6.火焰吸收的测量A:依次打开空气压缩机的风机开关,工作开关,调节压力调节阀,使得空气压力稳定在0.2—0.25MPa后,打开乙炔钢瓶主阀,调节出口压力在0.05—0.06MPa (点火前后出口压力可能有变化,这里的出口压力在0.05—0.06MPa指点火后的压力)检查水封,B.点击,),等火焰稳定后首先吸喷纯净水。
以防止燃烧头结盐。
或 ),依次吸标准溶液和未知C果不再需要继续测量其他元素,请关闭乙炔钢瓶主阀,让火焰自动熄灭),1分钟,清洗燃烧头,防止燃烧头结盐。
仪器分析资料完整版

名词解释1固定相:由层析基质组成,包括固体物质(如吸附剂、离子交换剂)和液体物质(如固定在纤维素或硅胶上的液体),这些物质能与相关的化合物进行可逆性的吸附、溶解和交换作用。
2流动相:在层析过程中推动固定相上的物质向一定方向移动的液体或气体。
3保留时间:指被测组分从进样开始到柱后出现浓度最大值所需的时间。
4迁移时间:粒子在外加电场作用下在缓冲液中定向移动所消耗的时间。
5灵敏度:一定浓度或者一定质量的试样进入检测器后,产生一定的响应信号。
响应信号对进样量的变化率即为灵敏度。
6校准曲线:表示被测“量”的实际值与计量器具的示值之间的关系(或特性)曲线。
7分离选择性:用某种分析方法分离测定某组分时,能够避免样品中其他共存组分干扰的能力。
8紫外截止波长:小于该波长辐射通过溶剂时,溶剂对此波长产生严重吸收。
9调整保留时间:指扣除死时间后的保留时间。
10保留因子:指一定温度、压力下,在两相间达分配平衡时,组分在固定、流动相两相间的分子数或物质的量之比。
11选择性因子:指组分2的调整保留值与另一组分1的调整保留值之比。
12检出限:也称敏感度,是指检测器恰能产生和噪声相鉴别的信号时,在单位体积或时间需向检测器进入的物质质量。
13定量校正因子:为了使检测器产生的响应信号能真实地反映物质的含量而对响应值进行校正的量。
14正相-液液色谱法:即流动相的极性小于固定液极性的液-液法。
15电渗流:是一种电动现象。
当一个电场加在一个带电荷的表面(例如川>3的玻璃毛细管的内壁)或者多孔的固体介质(例如土壤)的两端,同时该表面或介质处在电解质溶液中的时候,溶液会以某一固定的速度流动。
16电泳:在外加电场的影响下,带电的胶体粒子或离子在介质中作定向移动的现象。
17淌度:离子在给定介质中单位时间和单位场强下移动的距离。
与粒子的净电荷、半径及介质粘度等有关。
18焦耳热:由两端高电压引起的电解质离子流的自热。
载流导体中产生的热量Q。
19临界胶束浓度:表面活性剂分子在溶剂中缔合形成胶束的最低浓度即为临界胶束浓度。
仪器分析技术W2203-4-微教材
农产品与食品质量检测技术教学资源库
1 / 3 《仪器分析技术》课程-微教材 微课编号
W2203 微课名称 酸度计测定pH 的电池组成 所属模块
电位分析法基本原理 子模块 离子选择性电极 关键词
参比电极、玻璃电极、复合电极 是否通用
√通用 农产品 食品 是否重点建设 √是 否 微课类型
总结型 微课形式 讲授型 教学设计模式 PPT 动画式 教学目标 掌握酸度计电池的组成及测定原理
教学内容 知识点
技能点
1.pH 计的结构
2.复合电极的结构
3.pH 计的测量原理
知识讲解
一、pH 计的结构
pH 计包括玻璃电极、参比电极、电流计。
参比电极的基本功能是维持一个恒定的电位,作为测量各种偏离电位的对照。
银-氧化银电极是目前pH 中最常用的参比电极。
玻璃电极,其电位取决于周围溶液的pH 。
玻璃电极的功能是建立一个对所测量溶液的氢离子活度发生变化作出反应的电位差。
把对pH 敏感的电极和参比电极放在同一溶液中,就组成一个原电池,该电池的电位是玻璃电极和参比电极电位的代数和。
E 电池=E 参比+E 玻璃,如果温度恒定,这个电池的电位随待测溶液的pH 变化而变化,而测量pH 计中的电池产生的电位是困难的,因其电动势非常小,且电路的阻抗又非常大1-100M Ω;因此,必须把信号放大,使其足以推动标准毫伏表或毫安表。
一个电流计,该电流计能在电阻极大的电路中测量出微小的电位差。
电流计的功能就是。
微生物学及操作技术W3201-1-微设计
视频,实拍,PPT
3
酵母菌的繁殖方式
视频、动画、实拍、PPT
4
酵母菌的生活史
实拍,PPT,图片
1
酵母菌的菌落培养特征
视频、实拍、PPT,图片
2
课程内容总结
实拍、PPT,
1
小计
14
PBL讨论
无
设计者
汪洪涛,江苏经贸职业技术学院
版本号
01(2015.9.30)
附:
1、微课类型(限填项):讲授型、实验实训型、答疑型、总结型、其它;
教学内容
知识点
技能点
酵母菌的形态、大小和基本结构;
酵母菌的繁殖方式;
酵母菌的培养特征。
设计思路
教学步骤
呈现形式与素材
时长(min)Biblioteka 通过提出问题导入酵母菌的概况学习任务
实拍
0.5
酵母菌的概况整体内容介绍
实拍,PPT,图片
0.5
酵母菌的定义与特征
实拍,PPT,图片
1
酵母菌的形态与大小
实拍,PPT,图片
1
2、微课形式:画中画式、讲坛式、录播教室实录式、讨论式、访谈式、实地拍摄式、可汗学院式、PPT动画式、Prezi动画式、二维动画式、三维动画式、虚拟抠像式、混合拍摄式、师生形象的处理、混合拍摄式等(可参考给的学习资料),应根据课程的特点,选用丰富的形式;
3、微课教学设计模式:讲授法、直观演示法、任务驱动法、讨论法、案例分析法、角色扮演法等;
《微生物学及操作技术》课程-微设计
微课编号
W3201
微课名称
酵母菌的概述
所属模块
酵母
子模块
酵母菌的概述
关键词
仪器分析技术W3201-5-微测试

《仪器分析技术》课程-微测试一、单选题1、透光率是指()。
A.入射光强度B.透射光强度C.入射光强度与透射光强度之比D.透射光强度与入射光强度之比参考答案:D难度:中2、当一束平行单色光通过单一均匀的、非散射的吸光物质溶液时,溶液的吸光度与溶液浓度和液层厚度的乘积()。
A.成正比B.成反比C.无确定关系参考答案:A难度:低3、吸光度是指()。
A.入射光强度B.入射光强度与透射光强度之比C.透光率的倒数D.透光率的负对数参考答案:D难度:中二、多选题1、朗伯比尔定律的物理意义是,当一束平行单色光通过单一均匀的、非散射的吸光物质溶液时,溶液的吸光度与()的乘积成正比。
A.溶液体积B.液层厚度C.溶液浓度D.吸光系数参考答案:B;C;D难度:中三、判断题1、由朗伯一比尔定律知:溶液的吸光度A与溶液的浓度C之间呈线性关系。
参考答案:T难度:低2、透光度为透射光与入射光强度之比称为透光率。
参考答案:T难度:低四、填空题1、透光度为透射光与入射光强度之比称为。
参考答案:透光率难度:低五、简答题1、朗伯-比尔定律的物理意义是什么?参考答案:当一束平行单色光通过单一均匀的、非散射的吸光物质溶液时,溶液的吸光度与溶液浓度和液层厚度的乘积成正比。
难度:高2、什么是透光度?什么是吸光度?二者之间的关系是什么?参考答案:透光度为透射光与入射光强度之比T = I t/I0;吸光度A = -lg T;。
一个表示对光透过的程度,一个表示对光的吸收程度,关系为A = -lg T。
难度:高六、综合题1、请结合课堂讲解说说摩尔吸收系数的物理意义是什么?其大小和哪些因素有关?参考答案:κ(或ε)是吸光物质在一定波长和溶剂中的特征常数,反映该吸光物质的灵敏度。
其大小和产生吸收的物质的分子,原子结构,使用的溶剂,显色剂,温度及测定的波长等因素有关。
难度:高。
仪器分析技术W5301-4-微教材
技能点
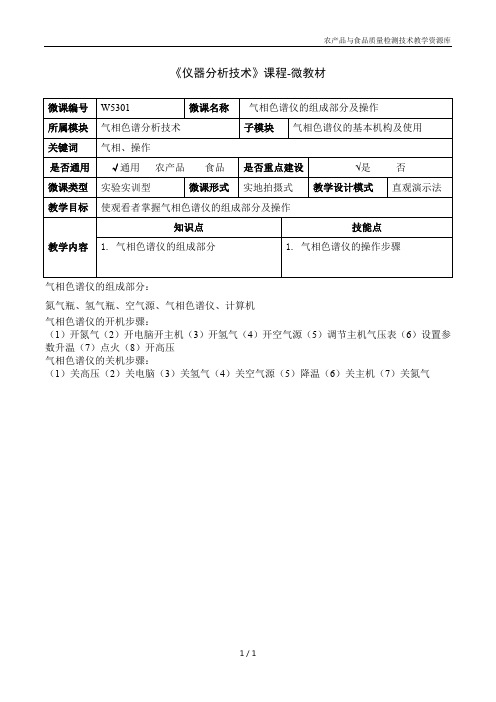
1.气相色谱仪的组成部分
1.气相色谱仪的操作步骤
气相色谱仪的组成部分:
氮气瓶、氢气瓶、空气源、气相色谱仪、计算机
气相色谱仪的开机步骤:
(1)开氮气(2)开电脑开主机(3)开氢气(4)开空气源(5)调节主机气压表(6)设置参数升温(7)点火(8)开高压
气相色谱仪的关机步骤:
(1)关高压(2)关电脑(3)关氢气(4)关空气源(5)降温(6)关主机(7)关氮气
《仪器分析技术》课程-微教材
微课编号
W5301
微课名称
气相色谱仪的组成部分及操作
所属模块
气相色谱分析技术
子模块
气相色Байду номын сангаас仪的基本机构及使用
关键词
气相、操作
是否通用
√通用农产品食品
是否重点建设
√是否
微课类型
实验实训型
微课形式
实地拍摄式
教学设计模式
直观演示法
教学目标
使观看者掌握气相色谱仪的组成部分及操作
教学内容
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《仪器分析技术》课程-微教材
知识讲解
1. 透光率与吸光度
透光率(transmittance ):当一束平行的单色光通过某一均匀的有色溶液时,光的一部分被比色皿的表面反射回来,一部分被溶液吸收,一部分则透过溶液。
如图1所示。
在分光光度法中,由于采用相同质地的比色皿,反射光的强度基本相同,其影响可以相互抵消,不予考虑。
图1 有色溶液与光线关系
设入射光的强度(incident light intensity )为,吸收光强度(absorptive light intensity )为a I ,透射光的强度(transmission intensity )为,则
I 0= I a +I t
透射光强度与入射光强度之比称为透光率(transmittance ),用T 表示,
T = I t /I 0
透光率越大,溶液对光的吸收越少;反之,透光率越小,溶液对光的吸收越多。
吸光度(absorbance):透光率的负对数称为吸光度,用符号A表示。
A越大,溶液对光的吸收越多。
A = -lg T =-lg(I t/I0)= lg(I0/I t)
2.朗伯比尔定律
物质对光吸收的定量关系很早就受到了科学家的注意并进行了研究。
皮埃尔·布格(Pierre Bouguer)和约翰·海因里希·朗伯(Johann Heinrich Lambert)分别在1729年和1760年阐明了物质对光的吸收程度和吸收介质厚度之间的关系;1852年奥古斯特·比尔(August Beer)又提出光的吸收程度和吸光物质浓度也具有类似关系,两者结合起来就得到有关光吸收的基本定律——布格-朗伯-比尔定律,简称朗伯-比尔定律。
朗伯定律指出:当一定波长的单色光通过一固定浓度溶液时,其吸光度A与光通过的溶液层厚度b成正比关系。
朗伯定律适用于任何均匀、有吸光质点的溶液、气体、固体。
比尔定律指出:当一定波长的单色光通过溶液时,若溶液厚度一定,则吸光度与溶液浓度c成正比,与被测物质的性质、入射光波长、溶剂、液层厚度及温度有关。
当溶液浓度大到一定值时,有色溶液的解离或聚合程度会发生变化,导致吸光度与浓度不能保持严格的正比关系。
所以比尔定律只适用于稀溶液。
如果同时考虑液层厚度和溶液浓度对光吸收的影响,则上述两个定律可合并为朗伯-比耳定律,当一适当波长单的单色光通过溶液时,若液层厚度一定,则吸光度与溶液浓度呈正比,并且与吸光物质种类、溶剂、入射光波长、液层厚度和溶液温度有关,且对所以的均匀介质(即低浓度溶液)和单色光都适用。
表示为
A=Kbc
式中,b为液层厚度,一般以 cm 为单位;为溶液浓度;K称为吸光系数。
当c的单位为g/L,b的单位为cm时,K用a表示,比例系数a称为质量吸收系数,单位L·g-1·cm-1。
它与入射光波长、物质的本性及溶液的温度等有关。
A = abc
当c的单位为mol/L,b的单位为cm时,K用ε表示,比例系数ε称为摩尔吸收系数,数值上ε等于a与吸光物质的摩尔质量的乘积,即ε=a·M,单位是L·mol-1·cm-1。
A = εbc·cm-1
在给定单色光、溶剂和温度等条件下,摩尔吸光系数表示物质对某一特定波长光的吸收能力。
ε越大表示该物质对某波长光的吸收能力越强,测定灵敏度越高。
因此进行测定时,为了
提高分析的灵敏度,必须选择摩尔系数大的有色化合物进行测定,选择具有最大ε值的波长作入射光。
一般ε值大于103即可进行分光光度法测定。
例题:有一溶液,每升含有5.00×10-3g 溶质,该溶质的摩尔质量为125g ·mol -1将此溶液放在厚度为2.00cm 的吸收池内,测得吸光度为0.500,求该溶质的a 和ε。
解:b=2.00cm ,c=5.00×10-3g ·L -1,A=0.500,M=125g ·mol -1 a=bc A =3
1000.500.2500.0-⨯⨯ L ·g -1·cm -1=5.00×105 L ·g -1·cm -1 ε=aM=5.00×105×125 L ·mol -1·cm -1=6.25×107 L ·mol -1·cm -1
3. 偏离朗伯比尔定律的原因
(1)朗伯-比耳定律广泛应用于紫外、可见、红外光区的吸收测量该定律不仅适用于溶液,也适用于其他均匀、非散射的吸光物质(包括气体和固体)。
对于多组分体系,若体系中各组分间无相互作用,则各组分的吸光度有加和性。
即
A = A 1 + A 2 + A 3 + ……+A n = ∑n
n A 1
因此,该定律即可用于单组分分析,也可用于多组分的同时测定。
应用光吸收定律时必须符合三个条件:一是入射光为平行单色光且垂直照射;二是被测样品为均匀介质;三是在吸收过程中,吸光物质之间无相互作用;
(2)什么叫标准曲线“偏离朗伯一比尔定律现象”?有哪些原因?
由朗伯一比尔定律知:溶液的吸光度A 与溶液的浓度C 之间呈线性关系。
在光度分析中正是利用这种关系,采用标准曲线法,可以很方便地测定溶液中某组分的含量。
但是在分析过程中,常常会出现标准曲线偏离直线的情况,这种情况称为“偏离朗伯一比尔定律现象”,如图2所示。
图2 标准曲线的弯曲
引起标准曲线偏离朗伯一比尔定律的原因,主要有如下几个:
①入射光为非单色光
从理论上讲,朗伯一比尔定律只适用于单色光。
但在分析实践中人们发现,分光光度计得到的入射光实质上都是某一波长的复合光。
由于物质对不同波长光的吸收程度不同,导致标准曲线对朗伯-比尔定律的偏离。
为了克服上述情况的发生,在光度测定中通常选择被测物最大吸收波长的光作为人射光。
这样不仅可以提高测定时的灵敏度,而且由于此处的吸收曲线比较平坦,偏离朗伯一比尔定律的程度也较小。
②化学反应引起的偏离
溶液中的化学反应溶液中的化合物,常因离解、聚合、形成新的化合物或异构体等化学变化而改变浓度,从而导致对朗伯一比尔定律的偏离。
因此严格控制显色反应的条件、维持溶液中的化学平衡,是防止偏离朗伯一比尔定律的主要措施。
③比尔定律的局限性引起偏离
比尔定律是一个有限定律,它只适用于浓度小于0.01mol/L的稀溶液,当溶液中待测组分浓度较稀(例:小于0.01mol/L)时,溶液吸光度A与溶液浓度C基本服从朗伯一比尔定律;但当待测组分浓度超过0.01mol/L时,“偏离现象”就比较严重。
这是因为随着待测组分浓度的增加,溶液中吸光粒子数目增多,粒子间平均距离减小,粒子的电荷发生改变,使吸光粒子的摩尔吸光系数发生变化,从而导致“偏离现象”的发生。
当被测溶液中其他组分浓度高时,也会产生类似效应。
因此要保证光度分析的准确性,待测组分的浓度应控制在0.01mol/L以下,并注意待测溶液中其他组分对测定的干扰。
④测定条件
测定条件主要包括显色剂用量,溶液酸度、温度、时间、溶剂效应的影响等。
