胰蛋白酶溶液(0.25%)
Eppendorf SciVario

Jorge L. Escobar Ivirico and Ma Sha Eppendorf, Inc., Enfield, CT, USAContact:********************************摘要引言使用灵活的SciVario ® twin 双联生物反应器生产干细胞外泌体,满足您的生物工艺需求间充质干细胞(MSC )来源的外泌体是一种新的组织和器官恢复物质,弥补了干细胞疗法相关的局限性。
MSC 来源外泌体参与细胞间通讯和组织重建相关的MSC 旁分泌功能,使得细胞自我更新和分化。
尽管使用干细胞具有诸多优点,但也存在一些局限性,比如如何模拟良好的细胞生长的条件进行大规模生产。
因此,下一步需要在可控环境下增加外泌体产量。
在本研究中,我们将SciVario ® twin 生物反应器控制系统和BioBLU ® 1c 一次性罐体组合使用,作为生物反应器大规模生产外泌体的案例。
SciVario twin 是Eppendorf 开发的一种“永不过时”的生物反应器控制系统。
该控制器遵循灵活性的开发原则,目前设计的最大工作体积为3.7L ,但该系统的灵活性使得未来可以通过硬件和软件的更新将工作体积升级至40L 。
在本应用指南中,我们监测和分析了人源诱导多能干细胞(hiPSC )的代谢产物以及细胞贴壁状态和形态,结果显示我们实现了长期的良好细胞生长环境。
此外,我们还对MSC 产生的外泌体进行分离、纯化、定量(使用CD63 ELISA 试剂盒)。
再生医学是关于组织和器官的结构工程学与功能工程学的多学科领域。
由于可以迁移至受伤部位并通过旁分泌因子(分泌体蛋白质组)促进组织再生,间充质干细胞已成为此类研究使用最广泛的干细胞类型[1-3]。
但是,细胞分化控制不足和目标组织中细胞存活率较低的相关问题导致MSC 吸引力下降。
最近, 旁分泌因子的关注度日益增加,其有望克服MSC 的局限性。
实验五 细胞染色体数目分析

中,置55℃~60℃水浴1.5h~2h后,加甲醇50mL, 静置24h以上,过滤即成姬姆萨染色液原液,装于 棕色瓶内保存备用。 10% Giemsa染液:取原液1份加入9份 0.01mol/L pH7.2 PBS中混匀。
6、细胞:Marc-145细胞
7、载玻片:4℃预冷
三、操作方法
秋水仙素处理,使细胞停止分裂 取对数生长期的Marc-145细胞一瓶,加入秋 水仙素到培养液内使终浓度为0.4μg/ml。 37℃温箱中继续培养2.5-3h。 收集处理的细胞 倾出秋水仙素处理液,用0.25%胰酶溶液消 化细胞,细胞消化好后加入DMEM培养液将细 胞吹下。 1600r/min离心5min收集细胞。
实验五
细胞染色体分析
(秋水仙素裂解法)
一、原理
细胞处于分裂中期时染色体的长短和大小恰
到好处,是研究染色体最好时期。
秋水仙素能破坏细胞纺锤体,并阻止其形成, 使分裂的细胞停留在分裂中期。 秋水仙素使染色体收缩,形成清晰的轮廓。 低渗液处理可使细胞肿胀,染色体分散 空气干燥使细胞和染色体展平。
二、实验材料
1、有丝分裂抑制剂 100×浓缩的秋水仙素(20μg/ml):将0.1mg
秋水仙素溶于5ml重蒸水中,分装后冰冻保存。
2、细胞消化液:0.25%胰蛋白酶溶液
3、低渗溶液:0.075mol/L KCl
4、固定液:甲醇∶冰乙酸(3∶1混合)
5、染液(Giemsa 吉姆萨染液)
姬姆萨染色液原液:姬姆萨染料0.6g加于50mL甘油
再 次 加 入 固 定 液 800μl , 轻 轻 混 匀 , 静 置 2030min或4℃过夜,1600r/min离心5min,弃l固定液,混匀。 吸取50μl细胞悬液于4℃预冷的干净载玻片上, 轻吹液滴,使细胞悬液铺展于玻片上,室温下自 然干燥。(在显微镜下观察,如果细胞均匀地铺 开,细胞不重叠,则用同样细胞浓度制备细胞样
胰蛋白酶

胰蛋白酶简介一、介绍胰蛋白酶(C6H15O12P3)为蛋白酶的一种。
在脊椎动物中,作为消化酶而起作用。
在胰脏是作为酶的前体胰蛋白酶原而被合成的。
作为胰液的成分而分泌,受肠激酶,或胰蛋白酶的限制分解成为活化胰蛋白酶,是肽链内切酶,它能把多肽链中赖氨酸和精氨酸残基中的羧基侧切断。
它不仅起消化酶的作用,而且还能限制分解糜蛋白酶原、羧肽酶原、磷脂酶原等其它酶的前体,起活化作用。
是特异性最强的蛋白酶,在决定蛋白质的氨基酸排列中,它成为不可缺少的工具。
牛的胰蛋白酶氨基酸残基223个,分子量23800,活性部位的丝氨酸残基是不可缺少的丝氨酸蛋白酶。
除存在于脊椎动物外,还存在于蚕、海盘车、蝲姑、放线菌等范围广泛的生物体中。
另外与高等动物的血液凝固和炎症等有关的凝血酶、纤溶酶、舒血管素等蛋白酶在化学结构和特异性等方面与胰蛋白酶具有密切的关系,可以认为这些酶是从共同的祖先酶在进化过程中分化而来的。
胰糜蛋白酶与弹性蛋白酶在结构和催化机制方面也具有密切关系,但其特异性则完全不同。
胰蛋白酶系自牛、羊或猪胰中提取的一种蛋白水解酶。
中国药品标准规定按干燥品计算,每1mg 的效价不得少于2500单位。
由牛、羊、猪胰脏提取而得的一种肽链内切酶,只断裂赖氨酸或精氨酸的羧基参与形成的肽键。
白色或米黄色结晶性粉末。
溶于水,不溶于乙醇、甘油、氯仿和乙醚。
分子量24 000,pI 10.5,最适pH值7.8~8.5左右。
pH>9.0不可逆失活。
Ca2+对酶活性有稳定作用;重金属离子、有机磷化合物、DFP、天然胰蛋白酶抑制剂对其活性有强烈抑制。
临床用于抗炎消肿,工业上用于皮革制造、生丝处理、食品加工等。
胰蛋白酶的分子量与其酶原接近(23300),其等电点约为pH10.8,最适pH7.6~8.0,在pH=3时最稳定,低于此pH时,胰蛋白酶易变性,在pH>5时易自溶。
Ca2+离子对胰蛋白酶有稳定作用。
重金属离子,有机磷化合物和反应物都能抑制胰蛋白酶的活性,胰脏、卵清和豆类植物的种子中都存在着蛋白酶抑制剂。
Hoechst33258 荧光染色法
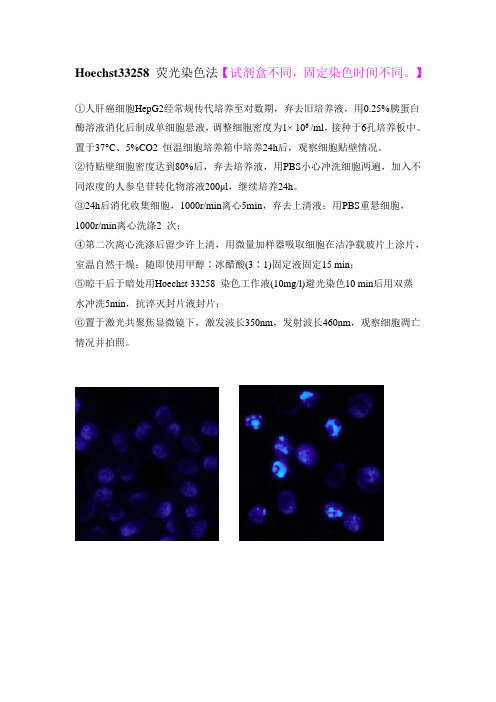
Hoechst33258 荧光染色法【试剂盒不同,固定染色时间不同。
】
①人肝癌细胞HepG2经常规传代培养至对数期,弃去旧培养液,用0.25%胰蛋白酶溶液消化后制成单细胞悬液,调整细胞密度为1× 106 /ml,接种于6孔培养板中。
置于37°C、5%CO2 恒温细胞培养箱中培养24h后,观察细胞贴壁情况。
②待贴壁细胞密度达到80%后,弃去培养液,用PBS小心冲洗细胞两遍,加入不同浓度的人参皂苷转化物溶液200μl,继续培养24h。
③24h后消化收集细胞,1000r/min离心5min,弃去上清液;用PBS重悬细胞,1000r/min离心洗涤2 次;
④第二次离心洗涤后留少许上清,用微量加样器吸取细胞在洁净载玻片上涂片,室温自然干燥;随即使用甲醇∶冰醋酸(3∶1)固定液固定15 min;
⑤晾干后于暗处用Hoechst 33258 染色工作液(10mg/l)避光染色10 min后用双蒸
水冲洗5min,抗淬灭封片液封片;
⑥置于激光共聚焦显微镜下,激发波长350nm,发射波长460nm,观察细胞凋亡情况并拍照。
①人肝癌细胞HepG2经常规传代培养至对数期,弃去旧培养液,用0.25%胰蛋白酶溶液消化后制成单细胞悬液,调整细胞密度为5×105/ml,接种于6孔培养板中。
置于37℃、5%CO2 恒温细胞培养箱中培养24h后,观察细胞贴壁情况。
②待贴壁细胞密度达到80%后,弃去培养液,用PBS小心冲洗细胞两遍,一孔加入含10%胎牛血清的完全培养液,其余各孔分别加入高、中、低3个浓度的人参皂苷转化物溶液与顺铂溶液200μl,继续培养48h。
③倒置显微镜下观察各组细胞生长情况和形态变化。
细胞计数法

细胞计数法细胞计数法是用来计数细胞悬液中细胞数量的一种方法。
一般利用计数板(血球计数板)进行。
即可用于分离(散)细胞培养接种前计数所制备的细胞悬液中的细胞数量,也可用于对培养物的细胞数量进行计数。
不论计数的对象如何,均须制备分散的细胞悬液。
1、制备细胞悬液对于悬液培养的细胞,可直接进行下面的步骤2(计数与计算过程)。
如果计数对象为贴壁生长的细胞,首先需将培养物制备成细胞悬液。
1)、终止培养,将培养液吸出,用PBS洗培养物一次。
2)、给培养瓶内加入1ml 0.25%胰蛋白酶溶液,于37℃消化3~5min 。
期间不断在镜下观察。
当细胞变圆接近脱壁时,弃消化液。
3)、加入一定量的培养液(如果这些培养细胞不再有用,可加PBS),用吸管吹打,使细胞脱壁而制成细胞悬液。
2、计数与计算过程1)、在细胞计数板中央放置计数专用的盖玻片。
2)、用玻璃虹吸管吸取细胞,让虹吸管在盖玻片上或下侧的计数板凹蹧处流出悬液,至盖玻片被液体充满为止。
3)、置显微镜下计数四角大方格内的细胞总数。
对于压线的细胞只计数在上线和左线者,对于细胞团按单个细胞计数。
4)、按下式计数细胞悬液的密度:细胞密度=(4个大格细胞总数/4)×104个/ml表示不计数:注意事项:1)、务必使分散成单个细胞,取样计数前,充分混匀细胞悬液。
2)、显微镜下计数时,遇到2个以上细胞组成的细胞团,应按单个细胞计算。
如果细胞团>10%,说明细胞分散不充分; 或细胞数<200个/10mm2或>500个/10 mm2 时,说明稀释不当,需重新制备细胞悬液。
细胞计数实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:一.准备工作:取一瓶传代的细胞,按照《传代细胞培养(消化法)》中的传代方法繁殖细胞,待长成单层后以被使用。
二.细胞悬液制备:细胞悬液的制备方法是用0.25%的胰蛋白酶液消化、PBS液洗涤后,加入培养液(或Hanks 液或PBS等平衡盐溶液),吹打制成待测细胞悬液。
细胞培养实验记录

细胞培养实验记录细胞培养实验是生物学研究中常用的实验方法之一,通过将细胞在体外培养,可以模拟细胞在体内的生长和分化过程,为研究细胞的生理功能和疾病机制提供重要的数据支持。
本文将详细记录一次细胞培养实验的步骤、结果和分析,以及可能存在的问题和改进方向。
实验目的:本次实验旨在培养人类肺癌细胞株A549,并观察其生长曲线和细胞形态的变化,为后续的细胞功能研究提供基础数据。
实验材料和方法:1. 材料:- A549细胞株(来源:细胞库)- DMEM培养基(含10%胎牛血清)- 0.25%胰蛋白酶/EDTA溶液- 无菌PBS缓冲液- 无菌离心管、培养皿和移液器等实验器具2. 方法:1) 细胞的传代:将A549细胞株从细胞库中取出,用DMEM培养基悬浮细胞,离心收集,用PBS缓冲液洗涤细胞沉淀,再用DMEM培养基重新悬浮细胞,根据需要将细胞传代至新的培养皿中。
2) 细胞的培养:将传代后的细胞转移到含有DMEM培养基的培养皿中,放入37℃恒温培养箱中,培养基每两天更换一次。
3) 细胞的观察:每天观察细胞的生长情况,记录细胞的形态、颜色和聚集情况等。
4) 细胞计数:使用细胞计数板和显微镜,计数细胞数目,计算细胞的生长曲线。
实验结果和分析:1. 细胞的形态变化:在培养的早期,A549细胞呈现单个悬浮状态,细胞体积较小,形态规则;随着培养时间的延长,细胞逐渐聚集成片状生长,细胞体积增大,形态呈现多样性。
2. 细胞的生长曲线:根据每天计数的细胞数目,绘制细胞的生长曲线,可以看出细胞的增殖速率。
通常细胞在培养的早期呈现指数增长,然后逐渐趋于平稳,最后进入平台期。
3. 细胞的健康状况:观察细胞的颜色、透明度和附着情况等指标,可以初步判断细胞的健康状况。
正常的细胞应该呈现鲜艳的颜色,透明度高,附着牢固。
实验问题和改进方向:1. 细胞的污染:在细胞培养实验中,细胞的污染是一个常见的问题。
为了避免细胞污染,应该在实验过程中严格遵守无菌操作的要求,定期检测培养基的污染情况。
肝组胚实验报告(3篇)

第1篇一、实验目的1. 了解肝组织结构及其在体内的分布。
2. 掌握肝组胚切片的制作方法。
3. 学习显微镜下观察肝细胞、肝血窦、肝内胆管等结构。
二、实验原理肝脏是人体最大的实质性器官,具有代谢、解毒、储存、分泌等多种功能。
肝组胚切片的制作,是观察肝组织结构的重要方法。
通过显微镜观察,可以了解肝细胞、肝血窦、肝内胆管等结构,从而了解肝脏的功能和疾病发生机制。
三、实验材料与仪器1. 实验材料:新鲜猪肝、酒精、甲醛、蒸馏水、石蜡、切片机、显微镜等。
2. 仪器:解剖显微镜、显微镜、切片机、切片夹、染色缸、载玻片、盖玻片等。
四、实验步骤1. 取新鲜猪肝,用手术刀将其切成2-3cm的块状。
2. 将肝组织块放入10%甲醛溶液中固定2小时。
3. 将固定好的肝组织块放入70%酒精溶液中脱水。
4. 将脱水后的肝组织块放入95%酒精溶液中脱水。
5. 将脱水后的肝组织块放入无水酒精中脱水。
6. 将脱水后的肝组织块放入二甲苯中透明。
7. 将透明后的肝组织块放入石蜡中包埋。
8. 将包埋好的肝组织块放入切片机中切片,切片厚度为5-7μm。
9. 将切片放入载玻片中,用显微镜观察肝组织结构。
五、实验结果1. 肝细胞:肝细胞呈多角形,细胞核位于细胞中央,细胞质内含有线粒体、内质网、高尔基体等细胞器。
2. 肝血窦:肝血窦为不规则腔隙,内衬内皮细胞,内皮细胞间有窗孔,有利于物质交换。
3. 肝内胆管:肝内胆管为单层上皮细胞组成,细胞核位于细胞基底部。
4. 肝窦周隙:肝窦周隙位于肝细胞与肝血窦之间,含有丰富的血管、神经、淋巴等组织。
六、实验讨论1. 肝细胞是肝脏的主要细胞,具有代谢、解毒、储存、分泌等多种功能。
肝细胞内含有丰富的线粒体、内质网、高尔基体等细胞器,有利于完成各种生理功能。
2. 肝血窦是肝细胞与血液交换物质的重要场所,内皮细胞间有窗孔,有利于物质交换。
3. 肝内胆管是胆汁生成和排泄的重要通道,细胞核位于细胞基底部,有利于分泌胆汁。
小鼠胚胎干细胞培养实验步骤

小鼠胚胎干细胞培养实验步骤以下是小鼠胚胎干细胞的培养实验步骤:1.准备培养基和细胞培养器材:-将培养基预热至37摄氏度。
-准备含有培养基的无菌试管、离心管和细胞培养板。
-洗手并戴上合适的培养操作手套。
2.预处理培养皿:-用无菌PBS(磷酸盐缓冲液)将细胞培养板彻底洗涤,去除残留的培养基和细胞残留物。
-用0.1%胰蛋白酶溶液或0.25%胰蛋白酶-EDTA溶液将细胞培养板上的细胞进行脱落。
-将细胞均匀地分布在预处理的培养皿中,使其形成单层细胞。
3.检查细胞数目和品质:-用显微镜检查细胞的形态和活力。
-用细胞计数计算细胞的数目。
-计算细胞的分裂倍增时间。
4.细胞传代:-按照需要的细胞密度将细胞从一个培养皿转移到另一个培养皿。
-用0.05%胰蛋白酶-EDTA将细胞从培养皿上脱落。
-投入适当比例的培养基到新的培养皿中,使其形成单层细胞。
5.制备小鼠胚胎纤维母细胞:-从小鼠胚胎体内收集纤维母细胞。
- 将纤维母细胞转移到含有DMEM(Dulbecco's Modified Eagle Medium)和10%胎牛血清的细胞培养皿中。
-培养纤维母细胞在37摄氏度、5%二氧化碳的培养箱中直至细胞接触起离皿表面。
6.制备和维持小鼠胚胎干细胞:-转接分裂期的小鼠胚胎干细胞到新的培养皿中。
-用无菌吸管或离心管的尖端轻轻挑取细胞克隆。
-将细胞克隆转移到含有mESC培养基(如DMEM、15%胎牛血清、2mML-谷氨酰胺和1×LIF(小鼠白细胞介素-6)的细胞培养板中。
-在体外细胞培养中维持小鼠胚胎干细胞的自我更新和增殖。
7.细胞培养的常规维护:-定期更换新鲜的培养基。
-检查细胞的形态和活力。
-定期传代细胞,以保持其细胞数目和活力。
-控制培养基和细胞的污染。
以上是小鼠胚胎干细胞培养的一般步骤,实验过程可能因研究目的和实验室的要求而有所不同。
为了保证实验的准确性和可重复性,建议在实验过程中随时记录和保留实验数据,并使用正确的实验操作和生物安全规范。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
南京森贝伽生物科技有限公司 网址:http://www.senbeijia.com/
第1页
仅供科研 版本号:180320
胰蛋白酶溶液(0.25%)
【产品组成】
Component SBJ-0103S Store at
Trypsin solution(0.25%) 100ml -20℃
【保存条件】
-20℃,12个月
【产品概述】
胰蛋白酶(Trypsin)是由胰脏产生没有活性的胰蛋白酶原分泌到小肠后,小肠内的肠肽酶会活化该酶原,
形成胰蛋白酶。胰蛋白酶的特点在于已经活化的胰蛋白酶,能够继续活化更多胰蛋白酶原,这种过程即自动
催化。胰蛋白酶在小肠工作,它会将蛋白质水解为肽,进而分解为氨基酸,其最适温度约为37℃。
Trypsin solution(0.25%)主要由0.25%胰酶组成,不含EDTA,经过滤除菌。本试剂可以直接用于培养
细胞的消化,或者一些组织的消化,通常室温下1min左右就可以消化下大多数贴壁细胞。
【使用方法】
1、贴壁细胞的消化
①吸除培养液,用无菌PBS、Hanks液或无血清培养液洗涤细胞一次,以去除残余的血清。
②加入少量Trypsin solution,略盖过细胞即可,室温放置0.5~2min,不同的细胞消化时间有所不同。
③显微镜下观察,细胞明显收缩,并且肉眼观察培养器皿底部发现细胞的形态发生明显的变化;或者用
枪吹打细胞发现细胞刚好可以被吹打下来,吸除胰酶细胞消化液。加入含血清的完全细胞培养液,吹打下细
胞,即可直接用于后续实验。
④如果发现消化不足,则加入Trypsin solution重新消化。
⑤如果发现细胞消化时间过长,未及吹打细胞,细胞已经有部分直接从培养器皿底部脱落,直接用胰酶
细胞培养液把细胞全部吹打下来。1000~2000g离心1min,沉淀细胞,尽量去除胰酶细胞消化液后,加入含
血清的完全培养液重新悬浮细胞,即可用于后续实验。
2、组织的消化
不同的组织需要消化的时间相差很大,通常以消化后可以充分打散组织为宜。
【注意事项】
1、尽量减少反复冻融的次数,以免失效。
2、在Trypsin solution过程中,要特别注意避免消化液被细菌污染。
3、Trypsin solution消化细胞时间不宜过长,否则细胞铺板后生长状况会较差。
4、为了您的安全和健康,请穿实验服并戴一次性手套操作。
南京森贝伽生物科技有限公司 网址:http://www.senbeijia.com/
第2页
