醛酮的自身羟醛缩合
第十一章 醛酮
O CH3 C CH2CHCH3
CH3
4 _ 甲 基 _ 2 _ 戊 酮
CH3COCHCO3CH
CH2CH=CH2
3_烯丙基_2,4 _戊二酮
O
= CH3 C CH C CH3
CH3
4 _ 甲 基 _ 3 _ 戊 烯 _ 2 _ 酮
O C CH CH3
CH3
2 _ 甲 基 _ 1 _ 环 己 基 _ 1 _ 丙 酮
8
O
CH3
C CH=C CH3
CH3
CH3
3 _ 甲 基 _ 1 _ 2 ' , 4 ' _ 二 甲 基 苯 基 _ 2 _ 丁 烯 _ 1 _ 酮
练习: 写出下列化合物的名称或结构式:
(1). H= C CCH 2CC = H CH HCH (2)O . C3HCC2HCC3H
C3H
OO
=
=
= =
R C OH M 3 O +R C g O X 3 ° 醇 H
R
RR ' '
RR ' '
例:选择适当的原料合成2-甲基-2-戊醇。
24
4、与醇的加成反应
R H CO+
( R' )
无水HCR l OH
R''OH
C
H OR''
( R' )
R''OH R C OR''+H2O 干HCH l OR''
( R' )
OH
(C3H)2CC2H NH 2
OH
20
2、与饱和亚硫酸氢钠的加成反应
醇 钠 O C O+NaO-S-OH C ONa
醛、酮的亲核加成反应

缩醛(酮 ),双醚结构。 对碱、氧化剂、还原剂稳定, 可分离出来。 酸性条件下易水解
醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用 1,2-二醇或1,3-二醇则易生成缩酮。
上述反应可以看成是1mol醛与2mol醇分子间脱去1mol水,生 成缩醛。
比如:
H3C C
H
H OC2H5 O+
H OC2H5
2.与饱和亚硫酸氢钠(40%)的加成
R C O + H SO3Na
(CH 3)H
R C
(CH 3)H
OH SO3Na
α -羟基磺酸盐
产物α -羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠 溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、 酮。故此反应可用以提纯醛、酮。
α- 羟基磺酸钠如果在酸或碱存在下,加水稀释,产物又可 分解成原来的醛或酮。
例题: 2-己酮中含有少量3-己酮,试将其分离除去。
CH3CCH2CH2CH2CH3 O
2-己 酮
CH3CH2CCH2CH2CH3 O
3-己 酮
(1)加 NaHSO3饱 和 溶 液
(2)分 离
沉淀
滤液
SO3Na
CH3CCH2CH2CH2CH3
OH
(1)加 HCl溶 液
CH3CH2CCH2CH2CH3 , H2O, NaHSO3 O
CH3CHCH2 CH3
CH2OH
(3)写出合成路线。
HCHO + CH3CHCH2MgBr 干 醚 CH3
CH3CHCH2CH2OMgBr CH3
H2O CH3CHCH2CH2OH CH3
若合成仲醇 OH 因连有羟基的碳原子上R和Rˊ两个烃基故
RCHR'
大学有机化学第11章__醛和酮

O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
醛酮反应机理二
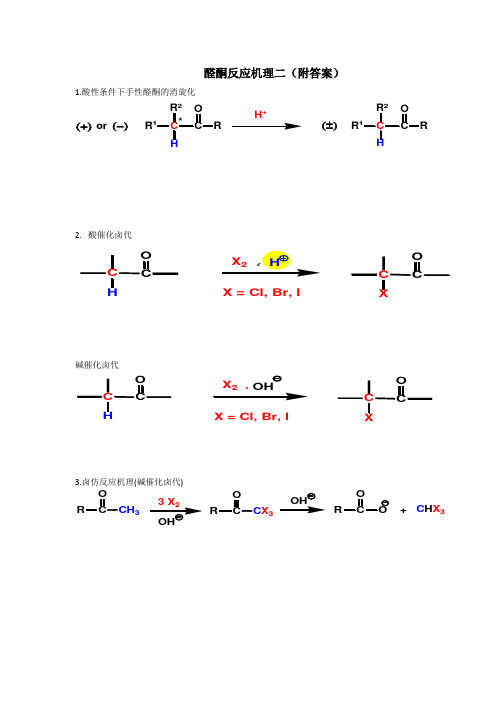
醛酮反应机理二(附答案)1.酸性条件下手性醛酮的消旋化RR 12CRR 1HR 2*H+(±)or (+)(-)2. 酸催化卤代碱催化卤代X,X = Cl, Br, I3.卤仿反应机理(碱催化卤代)3C C X 3CRC H X 3CR+OHX = Cl, Br, I4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)5.酸催化下的羟醛缩合机理:CH3CH3O2H3H3CH CH3+2Al[O(CH3)3]3OOOHOClHCl(Lewis 酸催化)6.Mannich反应(胺甲基化反应)CH 2R'+CH2O H+CHR'2NH1酸催化过氧酸氧化 —— 生成酯 ( Baeyer-Villiger 反应)(“O ”如何插入C -C 键)“O ”插入取代基多的基团一边(取代基多的基团易迁移)R 1R2R 1R 2R 122.Wolff-Kishner 还原酮羰基至亚甲基机理RR'O RCH 2R'NH -NH , Na N 2+3. Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH 3(过量)O R'(H)ROH R'(H)4.醛酮被金属还原至醇或二醇Na or LiRR'(H)RC OH R'RC OH R'RR'O2Mg (Hg)5.Cannizzaro 反应(歧化反应)R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O7. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 32不饱和醛、酮,1. α, β-不饱和醛酮与亲核试剂的亲核加成反应。
1, 2 – 加成为主(Nu - : 强亲核试剂,如 RLi, 炔基钠, LiAlH4等)1β2. 与亲核试剂的1, 4 – 加成机理α, β-不饱和醛酮与亲电试剂的亲电加成反应 3.α, β-不饱和醛酮的羟醛缩合(插烯规则) 4.Michael加成COCC+碱4. Diels-Alder 反应+例 1:写出下列合成的路线1酸性条件下手性醛酮的消旋化RR 12CRR 1R 2*H+(±)or (+)(-)CO RR 1R R 2H H RR 1C RR 2R 1C R 1R2*2+H 3(±)H H2.酸催化卤代O+CXC烯醇化C HH 2O X+H X碱催化卤代X ,X = Cl, Br, IX = Cl, Br, ICHCXOH3.卤仿反应机理(碱催化卤代)3C C X3CR C H X3CR+OH23R3COHC H X3+2RXCHXX3HOR CHRXX4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)CCHH CHOHCOHO5.酸催化下的羟醛缩合机理:CH3O2H 3H 3CHCH 3+23)3]3O OHHCl(Lewis 酸催化)C HH+CHH +烯醇化H 2OCOH HCHHOH 2OH 2O++H +3O8. Mannich 反应(胺甲基化反应)CH 2+CH 2OR"NR"H+CH R'CH 2NR"HRCHR'H RRHC HHCR"NR"HH2CO HNH2NH2R"NR"OHR CHOHR"NR"CHR"NR"R'1酸催化过氧酸氧化——生成酯(Baeyer-Villiger反应)(“O”如何插入C-C键)“O”插入取代基多的基团一边(取代基多的基团易迁移)R1R2R1O R2R1O R2R1R2RCO O H+R1R2HH OR1C R2O HO+ OR1C R2O HOδ+~ R1OR C R2O HOH++OHR1O R2H+R1O R2(来自过氧酸)R迁移2.Wolff-Kishner 还原酮羰基至亚甲基机理R R'OR CH2R'NH-NH, Na~ 200CN2+R R'ONH2-NH2R C R'ONH-NH2R C R'OHN-NH2HOHRCR'HOH RCR'R CH2R' RCHR'N N HOHRCHR'225.Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH3(过量)OR'(H)ROHR'(H)AlOOCHδRCOCH3C CH3+OH+AlO3)2 3333334.醛酮被金属还原至醇或二醇Na or LiR R'(H)R R'(H)e CO NaCORHR'eHO Na HRC OH RC OH RCR'O2Mg (Hg)自由基二聚RC O RC ORC OH RC OH PinacolH ORR'2eMg RC ORC O6. Cannizzaro 反应(歧化反应)RC OROHOHR +~ H ROO +HRC OH负H 迁移练习R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O9. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 3Ph 3P2R 2+Ph 3Ph 3C C O RPh 3C C R制备烯烃232OH或CH2Ph3P+3+或PPh3CH3I+PPh3+2CH3I(1) PPh32Ph323不饱和醛、酮共振式,OOE ENu Nu2.α, β-不饱和醛酮与亲核试剂的亲核加成反应。
羟醛缩合反应在有机化学中的应用1

Aldol反应反应在有机化学中的应用摘要:Aldol反应是一个重要的有机化学反应,它在有机合成中有着广泛的应用。
Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛酮或酸,或进一步脱水得到α,β-不饱和醛酮或酸酯的反应。
①分子间的羟醛缩合经常被用来合成一些β-羟基化合物,如1,3-丙二醇、l,3-丁二醇和新戊二醇等。
其可作为进一步生产香料、药物等多聚物或聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二酯(PBT)和聚对苯二甲酸丙二醇酯(PTT)等高聚物的单体;缩合脱水产物α,β-不饱和醛氧化得到相应的可广泛用作精细化工生产原料的羧酸,如2,2-二羟甲基丙酸可用作水性氨脂扩链剂以及制备聚酯、光敏树脂和液晶,2-甲基-2-戊烯酸是具有水果香味的食用香料,可广泛用于食品加工业和其它日化香精产业;此外,α,β-不饱和醛完全氢化时得到饱和伯醛,可用作溶剂或制造洗涤剂、增塑剂。
②关键词:羟醛缩合有机反应应用Aldol反应的机理:Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛或酸。
有α氢原子的化合物如醛、酮、羧酸和酯分子中,由于羰基的吸电子诱导作用以及碳氧双键和α碳上碳氢σ键之间的σ-π超共轭效应,使得α碳上氢上的电子云密度较低,具有较强的酸性和活性。
Aldol反应既可以在酸催化下反应,也可以在碱催化下反应。
在酸催化下,羰基转变成烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β-羟基化合物。
由于α氢同时受两个官能团的影响,其化学性质活泼,在经质子转移、消除可得α,β-不饱和醛酮或酸酯。
在碱性催化剂下,首先生成烯醇负离子,然后烯醇负离子再对羰基发生亲核加成,加成产物再从溶剂中夺取一个质子生成β-羟基化合物。
得到的β-羟基化合物在碱作用下可失水生成α,β-不饱和醛酮或酸酯。
有机化学:第十章 醛 酮(1)
(2) O
O
C OC2H5
H+
O
HOCH2CH2OH
O
O C OC2H5
LiAlH4 (C2H5)2O
O
O
CH2OH H+, H2O
O
CH2OH + HOCH2CH2OH
上海交通大学化学化工学院
(3) 维尼纶:聚乙烯醇含有多个亲水基团,为了提高其耐水性能,可用 甲醛使其部分缩醛化,得到性能优良的合成纤维——维尼纶。
(Ph)3P
- R1 C
R2
上海交通大学化学化工学院
G.Wittg于1953年开始系统研究了它与醛酮的反应,并应用在合 成上。建立了独特的结构和合成方法。
R1 C O + Ph3P C
R2
Ph3P + C
O- C
(Ph)3PO +
R1 CC
R2
缩醛对氧化剂、还原剂、碱稳定,对酸不稳定。
上海交通大学化学化工学院
应用:保护羰基。
(1) CH2 CHCHO
CH2 CH CHO OH OH
2C2H5OH
CH2 CHCH
OC2H5
[O]
OC2H5 H2O
H+, H2O
CH2 CH OH OH
OC2H5 OC2H5
SJTU
第十章 醛 酮
上海交通大学化学化工学院
(一)结构和命名:
1. 结构:
通式:CnH2nO ,醛、酮互为同分异构体。
官能团:
O
O
C H 醛基
C
羰基
碳原子采用sp2 杂化,三个σ键共 平面,羰基碳原子和氧原子上的p轨道 在侧面重叠生成π键 ,氧原子上还有 两对未共用电子。
醛酮及其性质

RCHO
与金属化合物反应
NaCCR
1 R'MgX
O RCC CR'
O 2 H2O RCR'
O
C6H5CdCl or (C6H5)2Cd RCC6H5
R’2CuLi
O
RCR'
O
O
-H+
+ CR
AlCl3 低温
Cl-
CR
Cl O CR
Company Logo
2 、 由酰胺和腈制备
ArCN
-H2O
O ArCNH2
二元酮
Company Logo
2、醛酮的命名
(1、)普通命名法
醛按氧化后生成的羧酸命名,酮看作是甲酮的衍生物。
CH3CH2CHO 丙醛
CH2=CHCHO 丙烯醛
BrCH2CH2CH2CHO γ-溴丁醛
O CH3CCH2CH3
甲基乙基甲酮 (甲乙酮)
Company Logo
(2、) 系统命名法
O CH3CCH2CH2CHO
Company Logo
3)、防腐溶液 甲醛是由(即甲醛亚硫酸氢钠)在60℃以上分解释放出的一种
物质,它无色,有刺激气味、易溶于水。35%~40%的甲醛水 溶液俗称福尔马林,具有防腐杀菌性能,可用来浸制生物标本, 给种子消毒等。 甲醛具有防腐杀菌性能的原因主要是构成生物 体(包括细菌)本身的蛋白质上的氨基能跟甲醛发生反应。 4)、食品行业 利用甲醛的防腐性能,加入水产品等不易储存的食品中
此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H)较活泼, 能发生一系列反应。
亲核加成反应和α-H的反应是醛、酮的两类主要化学性质。醛、酮的反应与结构
醛酮缩合

用碱作催化剂的羟醛缩合反应的机理:
交叉羟醛缩合
如果两个反应物都具有a-H,则将得到四个产物
用一种有α-H的醛或酮和一种过量的无αH的醛或酮反应,可得到一种主产物
克莱森-斯密特(Claisen-Schmidt)缩合
芳香醛与含有α-氢原子的醛、酮在碱催 化下所发生的羟醛缩合反应,脱水得到产率 很高的α,β-不饱和醛、酮,这一类型的反应, 叫做克莱森-斯密特(Claisen-Schmidt)缩合 反应。
反应机理:
Darzen反应
醛、酮与α-卤代酸酯在强碱(RONa, NaNH2, (CH3)3COK)催化作用下互相作用, 生成α,β-环氧酸酯的反应称为达参(Darzen, G.)反应
α,β-环氧酸酯
反应机理:
Reformasky反应
羟醛(Aldol)缩合反应
又称醇醛缩合反应。含 α活泼氢原子的醛 或酮,在酸或碱的催化下生成β-羟基醛或β羟基酮的反应。
该反应于1872年由C.-A.孚兹首先发现
β-羟基醛(酮)在热、酸(或碱)的作 用下极易进一步脱水转变为α,β-不饱和醛 (酮)。所以,羟醛缩合反应的产物实际上 往往是α,β-不饱和醛(酮)
俗称安息香(Benzoin)
反应机理:
Mannich反应(胺甲基化反应)
含有α -活泼氢的醛、酮(或羧酸、酯、 硝基、腈的α-H,炔氢,芳环的活性氢如酚和 芳胺的邻对位氢)与甲醛(或其它醛)及胺( 伯胺、仲胺或氨)反应,结果一个a-活泼氢被 胺甲基取代,此反应又称为胺甲基化反应, 所得产物称为Mannich碱
若提供α -活泼氢的为不对称酮,则产物为混合物
反应机理:
反应实例:
柯诺瓦诺格(Knoevenagel) 反应
含活泼亚甲基的化合物与醛或酮在弱碱 性催化剂(氨、伯胺、仲胺、吡啶等有机碱)存 在下缩合得到a,b-不饱和化合物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②醚化
24
25
26
③ 酯化
④ 绝大多数酚和烯醇式化合物(C=C—OH)均呈阳性反应
27
2、芳环上的反应
溴水退色
28
OH H2SO4 15~25℃
H2SO4 100℃
OH SO3H
OH
SO3H
29
OH (CH3 )2 SO4
NaOH
OCH3 HNO3
OH
OH
HI
NO2
+
OCH3 +
NO2
醇、酚、醚
结构性质比较:
醇
βα
氧化
C C O H 酸性
δ+
HH
酯化
脱水
SN
酚
氢键、酸性
OH
ArSE
醚
R O R' 性质稳定
1
烯醇(Enols)
OH CC
互变异构
烯醇式 不稳定
O CC
H
酮式
注意区分
OH
酚 (Phenol)
特点: 羟基与芳环相连
2
一、醇的性质
物理性质 b.p高——氢键作用;<C4醇和叔丁醇可与水混溶;
多元醇的特性 1 )HIO4 或 Pb(OAc)4 氧化
应用:断裂一个邻二醇键需1molHIO4——定量反应, 推测结构
CH2CHCH2 OH OH OH
HIO4
O
2 HCHO + HOCH
2)Pinacol重排
O H2SO4
OH OH
Pinacol
Pinacolon烃水解等
CrO3 H+ O
+ Cr+Ⅲ
兰绿色——醇的第二鉴别。叔醇不氧化
CrO3· 2Py
n— C5H11C≡ CCH2OH
n— C5H11C≡ CCHO
14
其它氧化剂
KMnO4 RCH2OH H+ RCOOH
OH 新 配 MnO2
CHO
H
Cu R C OH
RC O
or Ag or Ni
工业脱H
15
Oppenauer(欧芬脑尔)氧化法
35
O CH3OH H2SO4
OH OCH3
36
醚的制备
OH OH
H+ H2O
Williamson合成法 ONa + ClCH2 Ph
O
OCH2Ph
ONa + CH3I
OCH3
37
RX +
O R'
亲核取代
R O R'
用反合成分析(Retrosynthetic analysis)法描述:
BBFBF3H3B3F3
LLiAiAlHLlHi4A4lHHH24O2OH2OHHOOCHCHOH2CC2CHHH22CO2OHHH2OH HH++H+
HHOOCHCHOH2CC2CHHH22CN2NHHH22N2 HHH2NNHHH2N2 H2 OO O RROOHRHOHRROOCRCHOH2CC2CHHH22CO2OHHH2OH
EtOH
浓H2SO4
130℃ 浓H2SO4
170℃
EtOEt CH2=CH2
9
H2SO4
HO
80℃
H2SO4 OH △
机理如下:
10
单分子消除反应
E1——单分子消除反应
机理:两步反应,C+——伴随重排
反应活性:3°> 2°> 1°
消除规律:查氏规则
H+
OH
12
4)酸性 水溶液:H2O > RCH2OH > R2CHOH > R3COH ( 溶剂化) 气相: R3COH > R2CHOH > RCH2OH > H2O
HHCCNHNCN HHOOCHCHOH2CC2CHHH22CC2CHNN2CN
RRMMgRgXMXgXHHXXHX oor rRRoLrLi iRLi XXCCHXH2CC2CHHH22CO2OHHH2OH RRCoCHorRH2rRCC2Ro2CHHCr2HC22RuCO2uL2OHMLCi Mi2ugOLgXMiXgHXH3O3OH++3OR+RCCHRH2CC2CHHH22CO2OHHH2
O
OH +
32
萘酚 的制备
H2SO4 100℃
H2SO4 150℃
SO3H NaOH(s)
△
SO3H
ONa
OH OH
33
3、醚
除小环醚外,其余醚不活泼, 只可以进行酸 解和自动氧化。
C2H5OC2H5 + H2SO4
+
C2H5OC2H5 + HSO4-
H2O
C2H5OC2H5
H
醚能溶于浓硫酸
强酸:HI 能使醚键断裂
ROH + Na → H2 + RONa Me3C—OH + KH → Me3C—OK + H2
(ButOK——不亲核碱) i—PrOH + Al—Hg → (i—PrO)3Al 异丙醇铝
13
5 ) 氧化和脱氢——α—H 的主要反应 CrO3·Py——Sarret试剂:伯醇、仲醇→醛、酮
HO 橙色
H2O H3 PO4 OH
NaOH
Cl H2O
OH
O
RMgBr +
RCH2CH2OH
21
二、酚
1.酚羟基的反应
①酸性 H2CO3 >
OH
> ROH
PKa 7.12
10
18~19
OH
ONa
OH
Na2CO3
CO2
H2O
22
OH
OH
OH
OH
OH
>
>
>
>
NO2
Cl
CH3
O
OH
OH
OH
OH
Cl
Cl
NO2
NO2
OCH3 NO2
NO 2
3.氧化
OH
O
[O]
酚的制备
O
苯酚 1)磺酸盐碱熔法
对 苯 醌 (黄 色 )
conc. H2SO4
Na2SO3 SO3H
H2O
ONa
OH
NaOH(s)
SO2
325~400℃
H2O
SO3Na
31
2)氯苯水解
H2O
Cl 400~500℃
OH
Ca3(PO4)2
3)异丙苯氧化法
H2O H+
<C6醇与MgCl2、CaCl2生成结 晶醇
1)亲核取代反应SN :HX SOCl2等 ROH + HX →RX + H2O Lucas试剂:浓盐酸 + ZnCl2 适用于< C6—醇的鉴别
叔醇、烯丙醇、苄醇:立即出现混浊 仲醇:5min出现混浊 伯醇:加热出现混浊
4
醇活性: 3° > 2° > 1° (R3COH、 R2CHOH 、RCH2OH)
HBr Br
O
Br
34
环氧化合物(小环醚)的特性
CCHH3CC3CHHH32CO2OHHH2OH
(C(CHH3(CC3CHHH32CO2OH)4)2A4OAlL)lL4i Ai lHLHi3O3OH++3OCC+HH3CC3CHHH32CO2OHHH2O
HH2O2OH2O (C(CHH3(CC3CHHH32CO2OH)3)2B3OB)3B
HCl OH ZnCl2
Cl 产物不溶于反应液
5
NaBr
H2SO4 OH
Br
100% ~CH3
醇在酸性环境下才可被X-取代
HCl OH
~R
Cl
瓦格涅尔—梅尔外因重排 (Wagneer—Meerwein)
与SOCl2作用
2)酯化反应 EtOH + HOAc
O H+
CH3COEt
3)脱水
脱水剂:H2SO4、H3PO4、TsOH、 Al2O3(固体,不重排)
