王镜岩《生物化学》名词解释(打印版).
王镜岩生化名词解释

王镜岩生化名词解释点击次数:78 发布时间:2011-4-14王镜岩生化名词解释1.核小体(nucleosome):用于包装染色质的结构单位,是由DNA链缠绕一个组蛋白核构成的。
2.DNA变性(DNAdenaturation)在理化因子的作用下,DNA双螺旋的两条互补链松散而成为单链,从而导致DNA的理化性质及生物学性质发生改变,这种现象称DNA的变性。
3.DNA复性:变性的DNA在适当的条件下又可使两条分开的链重新缔合成为双螺旋结构的过程。
4.熔解温度(melting temperature,Tm):在DNA热变性中,紫外吸收增加的中点值所对应的温度。
或称热解链温度。
5.增色效应hyperchromic effect: 当DNA变性后,对260nm处紫外光光吸收度增加的现象。
6.减色效应(hypochromic effect):随着核酸复性,紫外吸收降低的现象。
7.核酸内切酶(exonuclease): 核糖核酸酶和脱氧核糖核酸酶中能够水解核酸分子内磷酸二酯键的酶。
8.核酸外切酶(exonuclease):从核酸链的一端逐个水解核甘酸的酶。
9.限制性内切酶(restriction endonuclease):一种在特殊核甘酸序列处水解双链DNA的内切酶。
Ⅰ型限制性内切酶既能催化宿主DNA的甲基化,又催化非甲基化的DNA的水解;而Ⅱ型限制性内切酶只催化非甲基化的DNA的水解。
10.重组DNA技术(recombination DNA technology):也称之为基因工程(genomic engineering).利用限制性内切酶和载体,按照预先设计的要求,将一种生物的某种目的基因和载体DNA重组后转入另一生物细胞中进行复制、转录和表达的技术。
11.基因(gene):泛指被转录的一个DNA片段。
在某些情况下,基因常用来指编码一个功能蛋白或DNA分子的DNA片段。
12.新陈代谢:生物体与外界环境不断进行的物质和能量交换过程。
王镜岩生化真题名词解释整理汇总情况

王镜岩——生物化学名词解释(2013年~2002年)【2013年】1.寡聚蛋白质(oligomeric protein):两条或两条以上具有三级结构的多肽链组成的蛋白质。
(也称多聚蛋白质)。
如:血红蛋白(两条α链,两条β链)、己糖激酶(4条α链)。
附:仅由一条多肽链构成的蛋白质称为单体蛋白质。
如:溶菌酶和肌红蛋白【第三章蛋白质】(上159)2.酶的转换数(turnover number,TN):即K3,又称催化常数(catalytic constant,K cat)是指在一定条件下每秒钟每个酶分子转换底物的分子数。
(通常来表示酶的催化效率)附:[ 或每秒钟每微摩尔酶分子转换底物的微摩尔数] ,大多数酶对它们的天然底物的转换数的变化围是每秒1到104(上321)【第四章酶】3.糖的变旋现象(mutarotation):是当一种旋光异构体,如糖溶于水中转变为几种不同的旋光异构体的平衡混合物时,发生的旋光变化的现象。
【第一章糖类】(上8;2013、2008)4.油脂的酸值(acid number):是指中和1g油脂中的游离脂肪酸所消耗KOH 的毫克数。
【第二章脂类和生物膜】(上95)5.激素受体:位于细胞表面或细胞,结合特异激素并引发细胞响应的蛋白质。
【第六章维生素、激素和抗生素】6.乙醛酸循环(glyoxylic acid cycle ,GAC):是一种被修改的三羧酸循环,在两种循环中具有某些相同的酶和产物,但代谢途径不同,在乙醛酸循环中乙酰CoA首先和草酰乙酸缩合成柠檬酸,然后转变为异柠檬酸,再裂解为琥珀酸和乙醛酸,在这一循环中产生乙醛酸,故称乙醛酸循环。
【第八章糖代谢】(这个循环除两步由异柠檬酸裂合酶和苹果酸合酶催化的反应外,其他的反应都和“柠檬酸循环”相同。
)(2013、2012)资料2:又称三羧酸循环支路,该途径在动物体不存在,只存在于植物和微生物中,主要在乙醛酸循环体中和线粒体中进行。
乙醛酸循环从草酰乙酸与乙酰CoA缩合形成柠檬酸开始,柠檬酸经异构化生成异柠檬酸,与TCA循环不同的是异柠檬酸经异柠檬酸裂解酶裂解为琥珀酸和乙醛酸。
考研有用的生物化学名词解释集锦(王镜岩)

优秀资料欢迎下载!生物化学名词解释集锦第一章蛋白质1.两性离子(dipolarion)2.必需氨基酸(essential amino acid)3.等电点(isoelectric point,pI)4.稀有氨基酸(rare amino acid)5.非蛋白质氨基酸(nonprotein amino acid) 6.构型(configuration)7.蛋白质的一级结构(protein primary structure)8.构象(conformation)9.蛋白质的二级结构(protein secondary structure)10.结构域(domain)11.蛋白质的三级结构(protein tertiary structure)12.氢键(hydrogen bond)13.蛋白质的四级结构(protein quaternary structure)14.离子键(ionic bond)15.超二级结构(super-secondary structure) 16.疏水键(hydrophobic bond)17.范德华力( van der Waals force) 18.盐析(salting out)19.盐溶(salting in)20.蛋白质的变性(denaturation)21.蛋白质的复性(renaturation)22.蛋白质的沉淀作用(precipitation) 23.凝胶电泳(gel electrophoresis)24.层析(chromatography)第二章核酸1.单核苷酸(mononucleotide)2.磷酸二酯键(phosphodiester bonds)3.不对称比率(dissymmetry ratio)4.碱基互补规律(complementary base pairing)5.反密码子(anticodon)6.顺反子(cistron)7.核酸的变性与复性(denaturation、renaturation)8.退火(annealing)9.增色效应(hyper chromic effect)10.减色效应(hypo chromic effect)11.噬菌体(phage)12.发夹结构(hairpin structure)13.DNA 的熔解温度(melting temperature T m)14.分子杂交(molecular hybridization)15.环化核苷酸(cyclic nucleotide)第三章酶与辅酶1.米氏常数(K m 值)2.底物专一性(substrate specificity)3.辅基(prosthetic group)4.单体酶(monomeric enzyme)5.寡聚酶(oligomeric enzyme)6.多酶体系(multienzyme system)7.激活剂(activator)8.抑制剂(inhibitor inhibiton)9.变构酶(allosteric enzyme)10.同工酶(isozyme)11.诱导酶(induced enzyme)12.酶原(zymogen)13.酶的比活力(enzymatic compare energy)14.活性中心(active center)第四章生物氧化与氧化磷酸化1.生物氧化(biological oxidation)2.呼吸链(respiratory chain)3.氧化磷酸化(oxidative phosphorylation)4.磷氧比P/O(P/O)5.底物水平磷酸化(substrate level phosphorylation)6.能荷(energy charg第五章糖代谢1.糖异生(glycogenolysis)2.Q 酶(Q-enzyme)3.乳酸循环(lactate cycle)4.发酵(fermentation)5.变构调节(allosteric regulation)6.糖酵解途径(glycolytic pathway)7.糖的有氧氧化(aerobic oxidation)8.肝糖原分解(glycogenolysis)9.磷酸戊糖途径(pentose phosphate pathway) 10.D-酶(D-enzyme)11.糖核苷酸(sugar-nucleotide)第六章脂类代谢1.必需脂肪酸(essential fatty acid)2.脂肪酸的α-氧化(α- oxidation)3.脂肪酸的β-氧化(β- oxidation)4.脂肪酸的ω-氧化(ω- oxidation)5.乙醛酸循环(glyoxylate cycle)6.柠檬酸穿梭(citriate shuttle)7.乙酰CoA 羧化酶系(acetyl-CoA carnoxylase)8.脂肪酸合成酶系统(fatty acid synthase system)第八章含氮化合物代谢1.蛋白酶(Proteinase)2.肽酶(Peptidase)3.氮平衡(Nitrogen balance)4.生物固氮(Biological nitrogen fixation)5.硝酸还原作用(Nitrate reduction)6.氨的同化(Incorporation of ammonium ions into organic molecules)7.转氨作用(Transamination)8.尿素循环(Urea cycle)9.生糖氨基酸(Glucogenic amino acid)10.生酮氨基酸(Ketogenic amino acid)11.核酸酶(Nuclease)12.限制性核酸内切酶(Restriction endonuclease)13.氨基蝶呤(Aminopterin)14.一碳单位(One carbon unit)第九章核酸的生物合成1.半保留复制(semiconservative replication)2.不对称转录(asymmetric trancription)3.逆转录(reverse transcription)4.冈崎片段(Okazaki fragment)5.复制叉(replication fork)6.领头链(leading strand)7.随后链(lagging strand)8.有意义链(sense strand)9.光复活(photoreactivation)10.重组修复(recombination repair)11.内含子(intron)12.外显子(exon)13.基因载体(genonic vector)14.质粒(plasmid)第十一章代谢调节1.诱导酶(Inducible enzyme)2.标兵酶(Pacemaker enzyme)3.操纵子(Operon)4.衰减子(Attenuator)5.阻遏物(Repressor)6.辅阻遏物(Corepressor)7.降解物基因活化蛋白(Catabolic gene activator protein)8.腺苷酸环化酶(Adenylate cyclase)9.共价修饰(Covalent modification)10.级联系统(Cascade system)11.反馈抑制(Feedback inhibition)12.交叉调节(Cross regulation)13.前馈激活(Feedforward activation)14.钙调蛋白(Calmodulin)第十二章蛋白质的生物合成1.密码子(codon)2.反义密码子(synonymous codon) 3.反密码子(anticodon)4.变偶假说(wobble hypothesis)5.移码突变(frameshift mutant)6.氨基酸同功受体(isoacceptor)7.反义RNA(antisense RNA)8.信号肽(signal peptide)9.简并密码(degenerate code)10.核糖体(ribosome)11.多核糖体(poly some)12.氨酰基部位(aminoacyl site)13.肽酰基部位(peptidy site)14.肽基转移酶(peptidyl transferase) 15.氨酰- tRNA 合成酶(amino acy-tRNA synthetase)16.蛋白质折叠(protein folding)17.核蛋白体循环(polyribosome) 18.锌指(zine finger)19.亮氨酸拉链(leucine zipper)20.顺式作用元件(cis-acting element) 21.反式作用因子(trans-acting factor) 22.螺旋-环-螺旋(helix-loop-helix)第一章蛋白质1.两性离子:指在同一氨基酸分子上含有等量的正负两种电荷,又称兼性离子或偶极离子。
第四章__蛋白质--王镜岩《生物化学》第三版笔记(完美打印版)

侧链含酰胺基:Asn(N), Gln(Q)
侧链显碱性:Arg(R), Lys(K)
2.芳香族氨基酸 包括苯丙氨酸(Phe,F)和酪氨酸(Tyr,Y)两种。 酪氨酸是合成甲状腺素的原料。
3.杂环氨基酸 包括色氨酸(Trp,W)、组氨酸(His)和脯氨酸(Pro)三种。其中的色氨酸与芳香族氨基酸都含苯环,都有紫外吸收(280nm)。所以可通过测量蛋白质的紫外吸收来测定蛋白质的含量。组氨酸也是碱性氨基酸,但碱性较弱,在生理条件下是否带电与周围内环境有关。它在活性中心常起传递电荷的作用。组氨酸能与铁等金属离子配位。脯氨酸是唯一的仲氨基酸,是α-螺旋的破坏者。
B是指Asx,即Asp或Asn;Z是指Glx,即Glu或Gln。
基本氨基酸也可按侧链极性分类:
非极性氨基酸:Ala, Val, Leu, Ile, Met, Phe, Trp, Pro共八种
极性不带电荷:Gly, Ser, Thr, Cys, Asn, Gln, Tyr共七种
带正电荷:Arg, Lys, His
二、蛋白质的分类
(一)按分子形状分类
1.球状蛋白 外形近似球体,多溶于水,大都具有活性,如酶、转运蛋白、蛋白激素、抗体等。球状蛋白的长度与直径之比一般小于10。
2.纤维状蛋白 外形细长,分子量大,大都是结构蛋白,如胶原蛋白,弹性蛋白,角蛋白等。纤维蛋白按溶解性可分为可溶性纤维蛋白与不溶性纤维蛋白。前者如血液中的纤维蛋白原、肌肉中的肌球蛋白等,后者如胶原蛋白,弹性蛋白,角蛋白等结构蛋白。
三.蛋白质的结构
一级结构 结构特点、测定步骤、常用方法、酶
二级结构 四种 结构特点、数据、超二级结构
生物化学笔记(王镜岩)
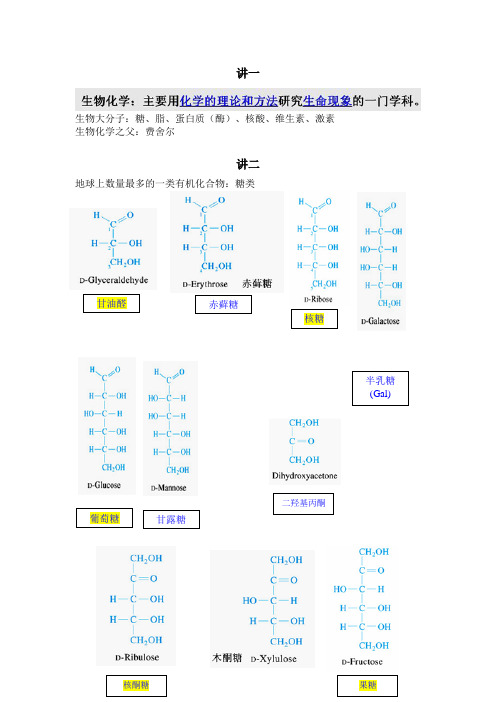
赤藓糖葡萄糖甘油醛核糖甘露糖半乳糖(Gal)((Gal)二羟基丙酮核酮糖果糖讲一生物大分子:糖、脂、蛋白质(酶)、核酸、维生素、激素生物化学之父:费舍尔讲二地球上数量最多的一类有机化合物:糖类α和β吡喃葡萄糖(羟基在下为α型,在上为β型)糖原高度分支的生理意义:第三章、蛋白质20种氨基酸英文名等电点掌握氨基酸的用途、现象DNFB法PITCCys半胱氨酸Ellman反应,DTNB,二硫硝基苯甲酸Ellman反应(二硫硝基苯甲酸,DTNB)Cys与二硫硝基苯甲酸(DTNB) 或称Ellman 试剂发生硫醇-二硫化物交换反应。
反应中1 分子的Cys引起1分子的硫硝基苯甲酸的释放。
它在pH 8.0 时, 在412nm 波长处有强烈的光吸收, 因此可利用分光光度法定量测定-SH。
肽平面(酰胺平面)——由肽键周围的6个原子组成的刚性平面3.6蛋白质的纯化注:用尽可能少的步骤、尽可能短的时间。
1.前处理阶段物理法——冻融法,超声波法,均浆法,研磨法等。
酶裂解法——就是利用水解酶将细胞壁和细胞膜消化的方法,常用的水解酶有溶菌酶、葡聚糖酶、蛋白酶、糖苷酶、壳多糖酶、细胞壁溶解酶等。
其中溶菌酶主要对细菌类有作用,其他酶对酵母作用显著。
2.粗分级/粗分离根据蛋白质的①溶解性质、②大小不同、③带电状态不同/电荷多少④净化方法根据与其他化合物相互作用的蛋白质(部分蛋白质对..有特定的..)②:凝胶过滤层析常用凝胶过滤介质Sephadex:交联葡聚糖,是采用环氧氯丙烷作交联剂将右旋葡聚糖交联而成。
干粉容易膨胀,在水、盐溶液、有机溶液、碱和弱酸中化学性质稳定,可高压灭菌。
高交联度的Sephadex,其颗粒坚硬,适于高流速下操作。
Sephacryl : 烯丙基葡聚糖同N、Nˊ—甲叉双丙烯酰胺共价交联而成。
颗粒坚硬,性质比Sephadex更为稳定,可高压灭菌,在pH3~11条件下稳定,可用有机溶剂洗脱,也可用SDS、尿素及盐酸胍洗脱。
第二章__糖___类--王镜岩《生物化学》第三版笔记(完美打印版)

第二章糖类提要一、定义糖、单糖、寡糖、多糖、结合糖、呋喃糖、吡喃糖、糖苷、手性二、结构1.链式:Glc、Man、Gal、Fru、Rib、dRib2.环式:顺时针编号,D型末端羟甲基向下,α型半缩醛羟基与末端羟甲基在两侧。
3.构象:椅式稳定,β稳定,因其较大基团均为平键。
三、反应1.与酸:莫里斯试剂、西里万诺夫试剂。
2.与碱:弱碱互变,强碱分解。
3.氧化:三种产物。
4.还原:葡萄糖生成山梨醇。
5.酯化6.成苷:有α和β两种糖苷键。
7.成沙:可根据其形状与熔点鉴定糖。
四、衍生物氨基糖、糖醛酸、糖苷五、寡糖蔗糖、乳糖、麦芽糖和纤维二糖的结构六、多糖淀粉、糖原、纤维素的结构粘多糖、糖蛋白、蛋白多糖一般了解七、计算比旋计算,注意单位。
第一节概述一、糖的命名糖类是含多羟基的醛或酮类化合物,由碳氢氧三种元素组成的,其分子式通常以Cn(H2O)n 表示。
实际上这一名称并不确切,如脱氧核糖、鼠李糖等糖类不符合通式,而甲醛、乙酸等虽符合这个通式但并不是糖。
只是"碳水化合物"沿用已久,一些较老的书仍采用。
我国将此类化合物统称为糖,而在英语中只将具有甜味的单糖和简单的寡糖称为糖(sugar)。
二、糖的分类根据分子的聚合度分,糖可分为单糖、寡糖、多糖。
也可分为:结合糖和衍生糖。
单糖是不能水解为更小分子的糖。
葡萄糖,果糖都是常见单糖。
根据羰基在分子中的位置,单糖可分为醛糖和酮糖。
根据碳原子数目,可分为丙糖,丁糖,戊糖,己糖和庚糖。
寡糖由2-20个单糖分子构成,其中以双糖最普遍。
寡糖和单糖都可溶于水,多数有甜味。
多糖由多个单糖(水解是产生20个以上单糖分子)聚合而成,又可分为同聚多糖和杂聚多糖。
同聚多糖由同一种单糖构成,杂聚多糖由两种以上单糖构成。
糖链与蛋白质或脂类物质构成的复合分子称为结合糖。
其中的糖链一般是杂聚寡糖或杂聚多糖。
如糖蛋白,糖脂,蛋白聚糖等。
由单糖衍生而来,如糖胺、糖醛酸等。
三、糖的分布与功能在人体中,糖主要的存在形式:(1)以糖原形式贮藏在肝和肌肉中。
王镜岩生化真题名词解释整理汇总

王镜岩——生物化学名词解释(2013年~2002年)【2013年】1.寡聚蛋白质(oligomeric protein):两条或两条以上具有三级结构的多肽链组成的蛋白质。
(也称多聚蛋白质)。
如:血红蛋白(两条α链,两条β链)、己糖激酶(4条α链)。
附:仅由一条多肽链构成的蛋白质称为单体蛋白质。
如:溶菌酶和肌红蛋白【第三章蛋白质】(上159)2.酶的转换数(turnover number,TN):即K3,又称催化常数(catalytic constant,K cat)是指在一定条件下每秒钟每个酶分子转换底物的分子数。
(通常来表示酶的催化效率)附:[ 或每秒钟每微摩尔酶分子转换底物的微摩尔数] ,大多数酶对它们的天然底物的转换数的变化范围是每秒1到104(上321)【第四章酶】3.糖的变旋现象(mutarotation):是当一种旋光异构体,如糖溶于水中转变为几种不同的旋光异构体的平衡混合物时,发生的旋光变化的现象。
【第一章糖类】(上8;2013、2008)4.油脂的酸值(acid number):是指中和1g油脂中的游离脂肪酸所消耗KOH 的毫克数。
【第二章脂类和生物膜】(上95)5.激素受体:位于细胞表面或细胞内,结合特异激素并引发细胞响应的蛋白质。
【第六章维生素、激素和抗生素】6.乙醛酸循环(glyoxylic acid cycle ,GAC):是一种被修改的三羧酸循环,在两种循环中具有某些相同的酶和产物,但代谢途径不同,在乙醛酸循环中乙酰CoA首先和草酰乙酸缩合成柠檬酸,然后转变为异柠檬酸,再裂解为琥珀酸和乙醛酸,在这一循环中产生乙醛酸,故称乙醛酸循环。
【第八章糖代谢】(这个循环除两步由异柠檬酸裂合酶和苹果酸合酶催化的反应外,其他的反应都和“柠檬酸循环”相同。
)(2013、2012)资料2:又称三羧酸循环支路,该途径在动物体内不存在,只存在于植物和微生物中,主要在乙醛酸循环体中和线粒体中进行。
生化笔记王镜岩完美打印版

第一章概述第一节概述一、生物分子是生物特有的有机化合物生物分子泛指生物体特有的各类分子,它们都是有机物。
典型的细胞含有一万到十万种生物分子,其中近半数是小分子,分子量一般在500以下。
其余都是生物小分子的聚合物,分子量很大,一般在一万以上,有的高达1012,因而称为生物大分子。
构成生物大分子的小分子单元,称为构件。
氨基酸、核苷酸和单糖分别是组成蛋白质、核酸和多糖的构件。
二、生物分子具有复杂有序的结构生物分子都有自己特有的结构。
生物大分子的分子量大,构件种类多,数量大,排列顺序千变万化,因而其结构十分复杂。
估计仅蛋白质就有1010-1012种。
生物分子又是有序的,每种生物分子都有自己的结构特点,所有的生物分子都以一定的有序性(组织性)存在于生命体系中。
三、生物结构具有特殊的层次生物用少数几种生物元素(C、H、O、N、S、P)构成小分子构件,如氨基酸、核苷酸、单糖等;再用简单的构件构成复杂的生物大分子;由生物大分子构成超分子集合体;进而形成细胞器,细胞,组织,器官,系统和生物体。
生物的不同结构层次有着质的区别:低层次结构简单,没有种属专一性,结合力强;高层次结构复杂,有种属专一性,结合力弱。
生物大分子是生命的物质基础,生命是生物大分子的存在形式。
生物大分子的特殊运动体现着生命现象。
四、生物分子都行使专一的功能每种生物分子都具有专一的生物功能。
核酸能储存和携带遗传信息,酶能催化化学反应,糖能提供能量。
任何生物分子的存在,都有其特殊的生物学意义。
人们研究某种生物分子,就是为了了解和利用它的功能。
五、代谢是生物分子存在的条件代谢不仅产生了生物分子,而且使生物分子以一定的有序性处于稳定的状态中,并不断得到自我更新。
一旦代谢停止,稳定的生物分子体系就要向无序发展,在变化中解体,进入非生命世界。
六、生物分子体系有自我复制的能力遗传物质DNA能自我复制,其他生物分子在DNA 的直接或间接指导下合成。
生物分子的复制合成,是生物体繁殖的基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
xx生物化学名词解释1.氨基酸(aminoacid):是含有一个碱性氨基(-NH2)和一个酸性羧基(-COOH)的有机化合物,氨基一般连在α-碳上。
氨基酸是蛋白质的构件分子。
2.必需氨基酸(essential amino acid):指人(或其它脊椎动物)(赖氨酸,苏氨酸等)自己不能合成,需要从食物中获得的氨基酸。
3.非必需氨基酸(nonessential amino acid):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。
4.等电点(pI,isoelectric point):使氨基酸处于兼性离子状态,在电场中不迁移(分子的静电荷为零)的pH 值。
5.茚三酮反应(ninhydrinreaction):在加热条件下,氨基酸或肽与茚三酮反应生成紫色(与脯氨酸及羟脯氨酸反应生成黄色)化合物的反应。
6.层析(chromatography):按照在移动相和固定相(可以是气体或液体)之间的分配比例将混合成分分开的技术。
7.离子交换层析(ion-exchange column):一种用离子交换树脂作支持剂的层析技术。
8.透析(dialysis):利用蛋白质分子不能通过半透膜的性质,使蛋白质和其他小分子物质如无机盐、单糖等分开的一种分离纯化技术。
9.凝胶过滤层析(gelfiltrationchromatography,GPC):也叫做分子排阻层析/凝胶渗透层析。
一种利用带孔凝胶珠作基质,按照分子大小分离蛋白质或其它分子混合物的层析技术。
10."亲合层析(affinity chromatograph):利用共价连接有特异配体的层析介质,分离蛋白质混合物中能特异结合配体的目的蛋白质或其它分子的层析技术。
11."高压液相层析(HPLC):使用颗粒极细的介质,在高压下分离蛋白质或其他分子混合物的层析技术。
12."凝胶电泳(gel electrophoresis):以凝胶为介质,在电场作用下分离蛋白质或核酸的分离纯化技术。
13."SDS-聚丙烯酰氨凝胶电泳(SDS-PAGE):在去污剂十二烷基硫酸钠存在下的聚丙烯酰氨凝胶电泳。
SDS-PAGE只是按照分子的大小,而不是根据分子所带的电荷大小分离的。
14."等电聚焦电泳(IEF):利用一种特殊的缓冲液(两性电解质)在聚丙烯酰氨凝胶制造一个pH梯度,电泳时,每种蛋白质迁移到它的等电点(pI)处,即梯度为某一pH时,就不再带有净的正或负电荷了。
15."双向电泳(two-dimensional electrophorese):等电聚焦电泳和SDS-PAGE的组合,即先进行等电聚焦电泳(按照pI)分离,然后再进行SDS-PAGE(按照分子大小分离)。
经染色得到的电泳图是二维分布的蛋白质图。
16."Edman降解(Edmandegradation):从多肽链游离的N末端测定氨基酸残基的序列的过程。
N末端氨基酸残基被苯异硫氰酸酯(PITC)修饰,然后从多肽链上切下修饰的残基,再经层析鉴定,余下的多肽链(少了一个残基)被回收再进行下一轮降解循环。
17."同源蛋白质(homologous protein):在不同生物体内行使相同或相似功能的蛋白质,例如血红蛋白。
18."构型(configuration):有机分子中各个原子特有的固定的空间排列。
这种排列不经过共价键的断裂和重新形成是不会改变的。
构型的改变往往使分子的光学活性发生变化。
19."构象(conformation):由于单键旋转引起的组成原子的不同排列。
一种构象改变为另一种构象时,不要求共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
120."蛋白质一级结构(primary structure):指多肽链的氨基酸序列。
21."蛋白质二级结构:蛋白质主链的折叠产生由氢键维系的有规则的构象。
常见的二级结构有α-螺旋、β-折叠片、β-转角和无规卷曲。
22."蛋白质三级结构(protein tertiary structure):多肽链借助各种非共价键弯曲、折叠成具特定走向的紧密球状构象。
它包括一级结构中相距较远的肽段之间的几何相互关系和侧链在三维空间中彼此间的相互关系。
三级结构主要是靠氨基酸侧链之间的疏水相互作用、氢键、范德华力和盐键(离子键)维持的。
23."蛋白质四级结构(protein quaternary structure):寡聚蛋白质所有,eg:血红蛋白,寡聚蛋白质中各亚基之间在空间上的相互关系和结合方式。
24."α-螺旋(α-heliv):P207要点12325."超二级结构(super-secondary structure):在蛋白质中,特别是球蛋白中,经常可以看到由若干相邻的二级结构单元组合在一起,彼此相互作用,形成有规则的,种类不多的二级结构组合或二级结构串,在各种蛋白质中充当三级结构的构件。
分为αα,βαβ,ββ三种26."结构域(domain):多肽链在二级结构或超二级结构的基础上形成三级结构的局部折叠区,它是相对独立的紧密球状实体。
27."疏水相互作用(hydrophobicinteraction):水介质中球状蛋白质的折叠总是倾向于把疏水残基埋藏在分子的内部的现象。
28."蛋白质变性(denaturation):天然蛋白质受到某些物理因素如加热、紫外线照射、高温和表面张力等或化学因素如有机溶剂、脲、胍、酸、碱等的影响时,生物活性丧失,溶解度降低,不对称程度增高以及其他的物理化学常数发生改变,这种过程称蛋白质变性。
其实质是次级键被破坏,但一级结构仍完好。
29."蛋白质的三维结构:蛋白质分子所有原子和基团在三维空间结构的构象及走向。
30."肌红蛋白(myoglobin):是由一条肽链和一个血红素辅基组成的结合蛋白,是肌肉内储存氧的蛋白质,它的氧饱和曲线为双曲线型。
31,复性(renaturation):当变性因素除去后,变性的生物大分子恢复成具有生物活性的天然构象的现象。
32."波尔效应(Bohr effect):增加CO2浓度和降低pH都能提高血红蛋白亚基的协同效应,引起红细胞内血红蛋白氧亲和力下降,促进血红蛋白释放氧,反之,增加氧气的浓度,使血红蛋白释放H+及CO2,这种现象称波尔效应。
33."血红蛋白(hemoglobin):是由含有血红素辅基的4个亚基组成的结合蛋白。
血红蛋白负责将氧由肺运输到外周组织,它的氧饱和曲线为S型。
34."别构效应(allosteric effect):又称为变构效应,寡聚蛋白质一般具多个结合部位,结合在蛋白质分子的特定部位上的配体对该分子的其他部位所产生的影响。
35."酶(enzyme):由活细胞产生的在细胞内、外一定条件下,都能起催化作用,具有极高的催化效率的高度专一性的生物大分子。
它使错综复杂的生化反应变得顺利和迅速。
36."全酶(holoenzyme):xx与辅因子结合后形成的复合物。
37."活性部位(中心)(active energy):酶中含有底物结合部位和参与催化底物转化为产物的氨基酸残基部分。
活性部位通常位于蛋白质的结构域或亚基之间的裂隙或是蛋白质表面的凹陷部位,通常都是由在三维空间上靠得很近的一些氨基酸残基组成。
38."酸-碱催化(acid-base catalysis):质子转移加速反应的催化作用。
39."共价催化(covalentcatalysis):一个底物或底物的一部分与催化剂形成共价键,2然后被转移给第二个底物。
许多酶催化的基团转移反应都是通过共价方式进行的。
40."靠近效应(proximity effect):非酶促催化反应或酶促反应速度的增加是由于底物靠近活性部位,使得活性部位处反应剂有效浓度增大的结果,这将导致更频繁地形成过度态。
41."寡聚蛋白质:两条或两条以上的具三级结构的多肽链组成的蛋白质。
42."米氏方程(Michaelis-Mentequation):表示一个酶促反应的起始速度(υ)与底物浓度([s])关系的速度方程:υ=υ达到最大反应速度(υmax[s]/(Km+[s])43."米氏常数(Michaelis constant):对于一个给定的反应,酶促反应的起始速度(υ0)max)一半时的底物浓度。
44."有氧氧化:葡萄糖在有氧条件下彻底氧化成H2O和CO2并放出大量能量的过程。
45."双倒数作图(double-reciprocal plot):又称为Lineweaver_Burk作图。
一个酶促反应的速度的倒数(1/V)对底物浓度的倒数(1/LSF)的作图。
x和y轴上的截距分别代表米氏常数和最大反应速度的倒数。
4通过增加底物浓度可以逆转的一种酶促反应抑制类型。
竞争性抑制剂通常与正常的底物或配体竞争同一个蛋白质的结合部位。
这种抑制使Km增大而υmax不变。
4抑制剂不仅与游离酶结合,也可以与酶-底物复合物结合的一种酶促反应抑制作用。
这种抑制使Km不变而υmax变小。
4抑制剂只与酶-底物复合物结合而不与游离的酶结合的一种酶促反应抑制作用。
这种抑制使Km和υmax都变小但υmax/Km不变。
49."酶原(zymogen):通过有限蛋白水解,能够由无活性变成具有催化活性的酶前体。
50."调节酶(regulatoryenzyme):位于一个或多个代谢途径内的一个关键部位的酶,它的活性根据代谢的需要而增加或降低。
51."别构酶(allosteric enzyme):活性受结合在活性部位以外的部位的其它分子调节的酶。
52."抗体酶(abzyme):又称催化性抗体,为在易变区被赋予了酶属性的免疫球蛋白。
53."同工酶(isoenzyme isozyme):催化相同的化学反应但其在蛋白质分子结构、理化性质和免疫性能等方面都存在着明显差异的一组酶。
54."别构调节酶/剂(allosteric modulator):称为别构效应物。
结合在别构酶的调节部位,调节酶催化活性的生物分子。
别构调节物可以是是激活剂,也可以是抑制剂。
55."xx(vitamin):维持细胞正常功能所必需的需要量很小、机体不能合成或合成量很小,需由食物中供给的一类小分子有机化合物。
56,水溶性维生素(water-soluble vitamin):一类能溶于水的有机营养分子。
其中包括在酶的催化中起着重要作用的B 族维生素以及抗坏血酸(维生素C)及硫辛酸。
