大学有机化学19 氨基酸、蛋白质和核酸
有机化学基础知识点氨基酸与蛋白质的结构与性质

有机化学基础知识点氨基酸与蛋白质的结构与性质有机化学基础知识点:氨基酸与蛋白质的结构与性质在有机化学中,氨基酸是构成蛋白质的基本组成单位。
了解氨基酸的结构和性质对于深入理解蛋白质的功能和作用至关重要。
本文将介绍氨基酸的基本结构、分类以及蛋白质的结构和性质。
一、氨基酸的基本结构氨基酸是由一个氨基基团(-NH2)、一个羧酸基团(-COOH)和一个侧链基团(R)组成的。
氨基酸的碳原子上还有一个氢原子和一个与侧链基团连接的碳原子,即α碳原子。
氨基酸的侧链基团可以是不同的有机基团,决定了氨基酸的性质和功能。
根据侧链基团的性质,氨基酸可分为以下几类:1. 构成氨基酸主链的非极性氨基酸,如甘氨酸、丙氨酸等。
它们的侧链基团都是非极性的烷基或芳香烃基,不带电荷。
2. 构成氨基酸主链的极性氨基酸,如天冬酰胺酸、谷氨酸等。
它们的侧链基团含有极性官能团,具有某种电荷。
3. 构成氨基酸主链的带电氨基酸,如赖氨酸、精氨酸等。
它们的侧链基团带正电荷,在生物体内具有重要的生理功能。
此外,还有一些特殊的氨基酸,如脯氨酸、半胱氨酸等,它们在氨基酸的结构中具有特殊的官能团或化学键,参与了许多重要的生物反应。
二、蛋白质的结构蛋白质是由一条或多条多肽链组成,每个多肽链由多个氨基酸残基以肽键相连而成。
多肽链的折叠和空间排布决定了蛋白质的功能和性质。
1. 一级结构:指多肽链上氨基酸残基的线性排列顺序。
氨基酸之间通过肽键连接,多肽链的N端和C端分别指代氨基末端和羧基末端。
2. 二级结构:指蛋白质中多肽链的局部结构。
常见的二级结构有α-螺旋和β-折叠,它们是由氢键相互作用所稳定的。
3. 三级结构:指整个多肽链的三维空间结构。
蛋白质的三级结构由多个二级结构单元通过各种非共价键相互作用而形成。
4. 四级结构:指多肽链与多肽链之间的空间排布和相互作用。
多个多肽链通过非共价键和共价键相互连接而形成更复杂的蛋白质结构。
蛋白质的结构多种多样,不同的结构决定了不同的功能。
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
5-2 氨基酸_蛋白质_核酸

为什么NH3+ NH2能结合 H+ R–CH–COOH H+ R–CH–COOH H+ - OH- OH +
NH2 负离子
(强碱中)
NH2
NH3 正离子
(强酸中) R–CH–COO - NH3 + 两性离子(内盐中)
4、n个氨基酸分子之间通过缩聚(一个氨基酸分子中氨
基上的氢原子与相邻氨基酸分子羧基中的羟基结合成水 分子)后可得n肽,过程中形成了(n-1)个肽键。今有一 种“多肽”,其分子式为C55H70O19N10 ,已知将它彻底 水解后只得到下列四种氨基酸:甘氨酸、丙氨酸、苯丙
氨酸、谷氨酸。问:
(1)这个多肽是
教材 P103
第二题: 4种
O
O CH 2 C OH
H2 N CH2 C NH
O
O C OH
H2 N CH C NH CH CH3 CH3
O
H2 N CH2 C NH O
O CH C OH
CH3 O H2 N CH C NH CH2 C OH CH3
讨论: 教材 P111 第3题
27种
若题目改成:“在一定条件下生成的同时 含有三种氨基酸的链状三肽共有多少种?” 答案为多少? 6种
当溶液中的氨基酸主要以两性 R–CH–COO - 离子的形式存在时,氨基酸在水中 NH3 + 的溶解度最小,可以形成晶体析出。
不同的氨基酸出现这种情况的pH值各不相同。
利用这一差异,可以通过控制溶液PH值的 分离氨基酸及多肽或蛋白质。 (2)成肽(缩合)反应
2NH2CH2COOH→ O
化学教案——氨基酸、蛋白质和核酸

第十五章氨基酸、蛋白质和核酸第一节氨基酸第二节蛋白质【教学目标】知识与技能:掌握氨基酸的结构特点及性质,了解肽键及多肽;了解蛋白质的组成;初步掌握蛋白质的重要性质和检验方法;了解蛋白质的用途。
过程与方法:通过实验培养学生观察能力,使学生能正确进行实验分析,并加深对概念的理解,进而抽象形成规律性认识。
辅以习题训练培养学生的创新思维能力。
情感态度与价值观:通过实验,使学生的科学态度、思想情趣得到陶冶;通过中国合成胰岛素这一伟大成就,激发学生爱国主义思想感情,民族自豪感。
由1931年我国学者吴宪提出蛋白质变性学说,激发学生积极进取,追求真理的热情和献身护理事业的责任感。
激发兴趣和科学情感;培养探索的科学精神。
【教学重点、难点】重点:氨基酸和蛋白质的化学性质;观察和抽象思维能力的培养。
难点:肽键的形成和科学抽象的方法。
【课时安排】2学时【主要教学方法】讲授、演示实验、讨论【教学用具】试管、试管夹、酒精灯、胶头滴管。
(NH)SO饱和溶液、鸡蛋白溶液、蒸馏水、乙酸铅溶液、CuSO溶液、浓硝酸。
4244【教学过程设计】第1学时CH-COOH+NaOH NH2形成内盐4CH-COONa+HOk 22NH2R —CH —CO OH R —CH —COO -NH + 3两性离子(内盐)氨基酸在不同PH 的溶液中的变化及存在形式R-CH-COOHNH2NH 2【讲解】若将某种氨基酸溶液的PH 调至一特定值,使酸式电离的程度恰好等于碱式电离程度,氨基酸则全部以两性离子存在,净电荷为零,氨基酸分子呈电中性,在电场作用下,既不向正极移动,也不向负极移动。
此时溶液的PH 称为该氨基酸的等电点。
有“PI ”表示。
【问题】请同学们思考,如果溶液的PH 小于PI ,氨基酸以什么样的形式存在?是阳离子?两性离子?还是阴离子? 【追问】溶液PH 等于PI 呢?溶液PH 大于PI 呢?【指导学生归纳】请看表15-1,请归纳酸性、中性、碱性氨基酸的等电点数值范围。
有机化学 蛋白质和核酸

Phe
2). C-末端测定
羧肽酶法: 羧肽酶只能水解C端氨基酸的肽键。
O O O H2NCH 2CNHCHCNHCHCOH CH2C6H5 CH3
H2O, 羧肽酶
O O O H2NCH2CNHCHCOH + H2NCHCOH CH3 CH2C6H5
新C端 根据各氨基酸放出的先后和含量,就可以推断出C端 氨基酸的种类和次序。 对于大分子蛋白质或较长的肽链,必须结合部分水解 法,利用各个肽片断中的重叠结构推出整个肽链的氨基酸 排列次序。
α-羟基-α氨基酸
α-酮酸
α - 氨基酸中的氨基被氧化剂氧化,或在生物体内酶的作 用下生成α - 亚氨基酸,然后经过水解、脱氨生成α - 酮酸。
3.脱水反应—成肽
O -H2O H2N CH C OH + H NH CH COOH R R
O H2N CH C NH CH COOH R
二肽
肽键
R
4. 与水合茚三酮的反应
pH=9 说明为碱性氨基酸,调pI 应加碱,故pI >9。
2.氨基酸中氨基的性质
(1)与亚硝酸反应
R CH COOH + HNO2 NH2
R CH COOH + N2 + H2O
OH α - 氨基酸中的伯氨基可与亚硝酸反应生成羟基酸, 并放出氮气,根据放出氮气的量可计算出α - 氨基酸的 含量。脯氨酸不含伯氨基除外。
(3)与生物碱试剂作用
+ NH3 Pr COOH
+ Cl 3COO
Pr
NH2 COOH
+ OOCCCl 3
5、蛋白质的变性 蛋白质因受物理或化学因素的影响,改变了分子内部 的特有结构,导致理化性质改变,生理活性丧失的现象称 为蛋白质的变性。
大学化学《有机化学-氨基酸》课件

去保护基
R O CH3 (CH3)3C+ + CO2 + +NH3CHCNHCHCOO -
*1. 催化氢化和稀碱都不能除去BOC,通常用温 和的酸性水解法除去。
*2. 若氨基酸中有多个氨基,在接肽前均需保护。 *3. 用Z保护还是用BOC保护,视实际情况而定。
22.5.2 羧基的保护
RCHCOON+ H3
(甘-丙-亮)(Gly-Ala-Leu)
2 结构
1. 肽键和肽的几何形状
H O H RH O
NCCNC CNCC
HR H O H R
2. 二硫键
CH2SH
+
CHNH 3
COO-
空气氧化 Na +液NH3
CH2S
+
CHNH 3
COO-
SCH2
+
CHNH 3 COO-
Cys-Tyr-Ile-Glu-Arg-Cys-Pro-Leu-Gly •NH2
HCl
CH3OH
上保护基
R H2NCHCOOCH3
CH3
SO3H RCHCOOCH2
CH2OH NH2
上保护基
(CH3)2C=CH2
上保护基
O RCHCOBu-t
NH2
A
接肽
OR
R'CHCHNCHCOOCH3
NH2
去保护基 Na2CO3
A
接肽
Pd / H2
OR R'CHCHNCHCOOH
去保护基
NH2
蛋白质、碳水化合物、脂肪(甘油醇的 脂肪酸酯)是人的营养中的三种要素。
1 定义和分类
羧酸分子中烃基上的一个或几个氢原子被氨基取代生成的化合物叫氨基酸。
苏教版选修有机化学基础《第二单元氨基酸蛋白质核酸》评课稿

苏教版选修有机化学基础《第二单元氨基酸蛋白质核酸》评课稿一、引言《第二单元氨基酸蛋白质核酸》是苏教版选修有机化学基础教材中的重要章节。
本文将对该单元进行评课,结合内容的组织方式、教材的编排、教学目标的达成程度等方面进行分析和评价。
二、教材内容分析1. 知识点和概念的介绍《第二单元氨基酸蛋白质核酸》首先对氨基酸、蛋白质和核酸的概念进行了详细的介绍。
通过清晰的定义和实例,帮助学生建立起对这些重要概念的初步理解。
2. 结构特点和性质解析教材接着深入分析了氨基酸、蛋白质和核酸的结构特点和性质。
详细讲解了氨基酸的结构、分类和命名规则,引导学生了解蛋白质的一级、二级和三级结构以及核酸的结构特点。
这些内容在帮助学生理解基础概念的同时,也为后续的学习打下了良好的基础。
3. 生物大分子与生命活动关系的展示该单元还重点展示了氨基酸、蛋白质和核酸在生命活动中的重要性。
通过介绍这些生物大分子在生物体内的功能和作用,引发学生对生命科学的兴趣,并加深了对生物大分子与生命活动间关系的理解。
三、教材优点分析1. 知识层次清晰教材在组织知识点时,从浅入深,层层递进。
学生可以在逐步理解基本概念的基础上,逐步掌握更深入的知识和技能。
2. 结构严谨教材结构严谨,每个概念都有明确的讲解和解读。
模块之间的关联性和逻辑性较强,帮助学生建立起完整的知识框架。
3. 突出实际应用教材通过丰富的实例和案例,将知识点与实际应用相结合。
学生不仅能够了解知识的理论方面,还能够看到知识点在实际问题中的应用,培养了他们的应用能力。
四、教材不足分析1. 缺乏互动性和趣味性教材的编排较为传统,缺乏互动性和趣味性。
在知识传授的过程中,缺少探究性学习、实际操作和讨论等活动,未能真正激发学生的学习兴趣。
2. 案例或实例不够充分教材的案例和实例较为有限,无法全面覆盖各种不同情况下氨基酸蛋白质核酸的应用。
这可能限制了学生对知识实际应用的理解和掌握。
3. 缺少拓展性内容教材在扩展内容方面较为欠缺,未能提供足够的拓展性内容供学生深度研究和学习。
有机化学课后答案
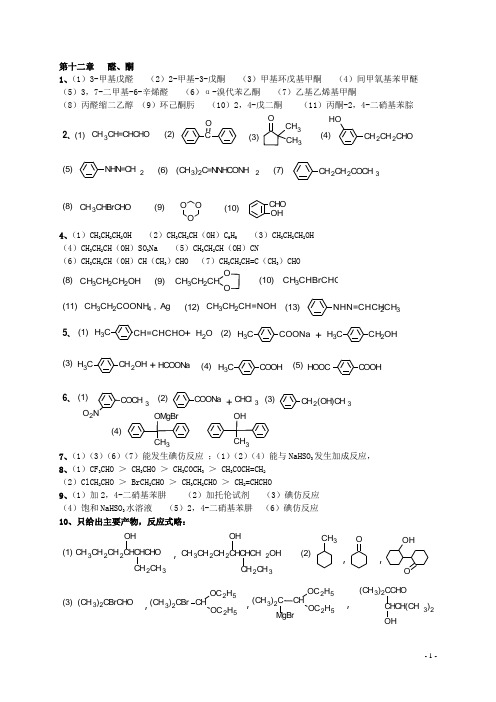
第十二章 醛、酮 1、(1)3-甲基戊醛 (2)2-甲基-3-戊酮 (3)甲基环戊基甲酮 (4)间甲氧基苯甲醚 (5)3,7-二甲基-6-辛烯醛 (6)α-溴代苯乙酮 (7)乙基乙烯基甲酮(8)丙醛缩二乙醇 (9)环己酮肟 (10)2,4-戊二酮 (11)丙酮-2,4-二硝基苯腙(2)(1)(3)(4)C O CH 3CH 3O CH 2CH 2CHO OH CH 3CH=CHCHO 2、 (6)(5)(7)NHN=CH 2CH 2CH 2COCH 3(CH 3)2C=NNHCONH 2(10)(9)(8)CHO OHCH 3CHBrCHOO OO4、(1)CH 3CH 2CH 2OH (2)CH 3CH 2CH (OH )C 6H 5 (3)CH 3CH 2CH 2OH (4)CH 3CH 2CH (OH )SO 3Na (5)CH 3CH 2CH (OH )CN(6)CH 3CH 2CH (OH )CH (CH 3)CHO (7)CH 3CH 2CH=C (CH 3)CHO(10)(9)(8)OCH 3CH 2CHO CH 3CH 2CH 2OHCH 3CHBrCHO(13)(12)(11)NHN=CHCH 2CH 3CH 3CH 2COONH 4 , Ag CH 3CH 2CH=NOH(2)(1)C H 3CH 2OHCH 3COONaCH 3CH=CHCHO H 2O ++5、(3)(5)(4)CH 3COOH CH 3CH 2OH HOOCCOOHHCOONa +(3)(2)(1)(4)CH 2(OH)CH 3COONa OMgBr3COCH 3O 2N+CHCl 3OH 36、7、(1)(3)(6)(7)能发生碘仿反应 ;(1)(2)(4)能与NaHSO 3发生加成反应, 8、(1)CF 3CHO > CH 3CHO > CH 3COCH 3 > CH 3COCH=CH 2 (2)ClCH 2CHO > BrCH 2CHO > CH 3CH 2CHO > CH 2=CHCHO 9、(1)加2,4-二硝基苯肼 (2)加托伦试剂 (3)碘仿反应 (4)饱和NaHSO 3水溶液 (5)2,4-二硝基苯肼 (6)碘仿反应 10、只给出主要产物,反应式略:(2)(1)CH 3CH 2CH 2CHCHCHO OH2CH 3CH 3CH 2CH 2CHCHCH 2OHOHCH 2CH 3CH 3OOOH,,,(3)(CH 3)2CBrCHO CH OC 2H 5OC 2H 5(CH 3)2C CHCH(CH 3)2(CH 3)2CCHO,,,(CH 3)2CBr CHOC 2H 5OC 2H 5MgBr(4)OMgBr CH 3OH CH 3①H+,△② B 2H 6 , H 2O 2/OH ,,,-(1)CH 3CH=CH 2CH 3CH 2CH 2BrNaC≡CNaCH 3CH 2CH 2C≡C CH 2CH 2CH 3CH 3CH 2CH 2COCH 2CH 2CH 2CH 3HBr2322242411、也可通过格氏试剂增碳、水解、氧化得到。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C
N-C(COOC2H5)2 C R O
R-CH-COOH NH2
第二节
结构 、命名
多肽
多肽可以看做是由多个氨基酸分子通过氨 基和羧基之间脱水缩合而形成的。如:
在多肽链中,氨基的一端称 N 端,有羧基的
一端称 C 端,写多肽结构时常把N端写在左边,C
端写在右边。命名时从N端起,称为某氨酰(基)
»»
+ »HNO3 ¨
»»
NO2
»±»»»°» »² °³
可利用颜色反应来鉴别蛋白质。如临床分析中 尿蛋白的检验。
水解反应 蛋白质容易水解,完全水解可得到多种α氨基酸的混合物,如果部分水解则得到分子量较 小的多肽。 蛋白质→多肽→二肽→α-氨基酸
三、蛋白质的结构 蛋白质的结构是非常复杂的,通常分成四级结构。
某氨酸。如:
* 多肽结构测定-自学
第三节
蛋白质
蛋白质由C、H、O、N、S等元素组成,有些还有P、 Fe、I等微量元素。
一、蛋白质的功能
● 起组织结构的作用,如角蛋白组成皮肤、毛发、 指甲、头角;骨蛋白组成腱、骨;肌球蛋白组成肌肉 等。 ● 起生物调节作用,如各种酶对生物化学反应起催
化作用;血红蛋白在血液中输送氧气;胰岛素调节葡
核酸-自学
蛋白质的变性一般为不可逆的。
显色反应
A. 水合茚三酮反应
无色变有色,与氨基酸不同
B. 缩二脲反应
O O NH2C-NH-C-NH2 + NaOH + CuSO4
缩二脲 含有多个-CO-NH-
紫色
蛋白质溶液 + NaOH + CuSO4
含有多个-CO-NH-
紫色
C. 黄色反应
»»»» ú
NH3
°³ »°»»» + »HNO3 ¨ ò º Ô Ò £
- +
-氨基酸分子内这两个基团也可以生成盐(称内盐)。
R-CH-COOH NH2
R-CH-COO + NH 3
-
内盐(亦称为偶极离子)
(2)等电点 氨基酸在纯水溶液中可形成如下的平衡: R-CH-COOH NH2
- H2 O
OH + R-CH-COOH + NH3 正离子(III)
R-CH-COO H2 O + NH3
OH OH
»³» »
这个颜色反应常用于α-氨基酸的比色测定 和色层分析的显色。
注:N-取代的α-氨基酸、β-氨基酸、 γ-氨基酸等均 不与茚三酮发生显色反应。
3. 氨基酸受热后的反应
O
α -氨基酸
COOH CH3CH NH2 +
H2N CH CH3 2H2O
HN H3C O
CH3 NH
HOOC
β -氨基酸
Hale Waihona Puke 萄糖代谢等。二、蛋白质的性质
两性和等电点
蛋白质和氨基酸一样,也是两性物质。不同的 蛋白质有不同的等电点。
变性
蛋白质受热、紫外线及某些化学试剂(如HNO3、 Cl3CCOOH、苦味酸、单宁酸、重金属盐Cr3+、 Hg2+、As3+等)作用时,蛋白质的结构、性质发生 变化,失去生理活性。如煮鸡蛋、生皮鞣制等。
CH3CHCOOH HONH2 丙氨酸 -氨基丙酸 -CH2CHCOOH NH2 酪氨酸 -氨基-3-对羟基苯基丙酸
系统命名: 氨基乙酸
碱性氨基酸——在分子中-NH2的数目多于-COOH的数目。
俗 名:
H2N-CH2CH2CH2CH2CH-COOH NH2
赖氨酸
系统命名: 2,6-二氨基己酸
酸性氨基酸——在分子中-COOH数目多于-NH2数目。
CH3CH CHCOOH NH2 H
CH3CH
CHCOOH
O
γ、δ醇酸
CH3CHCH2CH2COOH NH2
NH
O CH3CHCH2CH2CH2COOH NH2 NH
三、氨基酸的制备
(1)由醛酮作原料:
NH3 H2 O
R-CHO + HCN
R-CH-CN OH
R-CH-CN NH2
R-CH-COOH NH2
NK + Cl-CH-COOC2H5
O
C O
R
-C-OH + -C-OH + H3N-CH-COOH 89% O
+ C2H5OH
(4)由丙二酸酯合成:
O C C NK
CH2(COOC2H5)2
O
Br2
BrCH(COOC2H5)2
O
O
C
① C2H5ONa N -CH(COOC2H5)2 ② RX C
R-CH-COO- + H3O+ NH2 负离子(II)
两性离子(I) 等电点(PI)
在一定pH值溶液中,正离子和负离子的数量相等,且浓 度都很低,而偶极离子浓度最高,此时电解,以偶极离 子形式存在的氨基酸不移动,这溶液的pH值就叫做氨基 酸的等电点。
2. 水合茚三酮反应
O - °»» » ±ù á O
§19—1 氨基酸
氨基酸——分子中含有氨基和羧基的化合物。
如:R-CH-CH2-COOH NH2 β -氨基酸
β α
R-CH-COOH NH2 -氨基酸
α
一、氨基酸的结构、命名和分类
中性氨基酸
-氨基酸可分为
碱性氨基酸 酸性氮基酸
中性氨基酸
如:CH2-COOH NH2 俗名: 甘氨酸
在分子中-NH2与-COOH 数目相同。
(2)由α-卤代酸氨解:
Br2 P NH3
R-CH2-COOH
R-CH-COOH Br
R-CH-COOH + HBr NH2 ~ 60%
(3)盖布瑞尔法:
α-卤代酸酯和邻苯二甲酰亚胺钾反应,再经水解, 可制得产率、纯度较高的氨基酸。
O C C O
H2 O H+
R
O C
R N-CH-COOC2H5
97%
俗 名: HOOC-CH2CH2CH-COOH NH2 谷氨酸 系统命名: 2-氨基戊二酸
在-氨基酸的命名中,习惯上多数以俗名来命名。
二、化学性质
1. 两性与等电点
(1)两性 -氨基酸含有一个酸性的羧基(-COOH),也含有一 个碱性的氨基(-NH2),故它遇到酸或碱都能生成盐。 R-CH-COOH + HCl NH2 R-CH-COOH + NaOH NH2 R-CH-COOH + NH Cl 3 R-CH-COO Na + H2O NH2
