5_氮杂胞苷对小麦生长发育及DNA甲基化的影响
DNA甲基化在肿瘤发生中的作用

DNA甲基化在肿瘤发生中的作用肿瘤是人类健康的头等大事,它是由基因突变和表观遗传学变化引起的遗传疾病。
DNA甲基化是一种常见的表观遗传学变化,它是指DNA分子在胞内繁殖时,通过在在五碳脱氧核糖核苷酸的C5位加上一个甲基基团而产生的一种修饰,它在正常组织中具有调控基因表达,维护基因稳定性,参与细胞分化和应答外源性刺激等多种功能。
但是,在肿瘤发生中,DNA甲基化的模式发生改变,造成癌基因的高度表达或肿瘤抑制基因的沉默,这种表观遗传学的改变往往会引起肿瘤的发生和发展。
因此,深入了解DNA甲基化在肿瘤发生中的作用,对于治疗肿瘤有着重要的意义。
DNA甲基化的机制DNA甲基化是一种简单的化学修饰,它是由甲基转移酶催化丙烷基单元(C1)从S-腺苷甲硫氨酸(AdoMet)转移到细胞内DNA链合成过程中的胞嘧啶(Cyt)的C5核苷酸上。
DNA甲基转移酶(DNMT)是DNA甲基化的关键酶,它包括DNMT1, DNMT3a和DNMT3b三个亚型。
DNMT1是在细胞分裂期间能够保证分子和细胞的遗传稳定性,通过识别和甲基化前一代细胞从父本获得的甲基化DNA,维持其在细胞分裂后的遗传稳定性。
DNMT3a/b通过识别新的DNA序列元素来甲基化胞苷。
然而,过度的DNA甲基化也可能触发继承性的表观遗传学改变,从而引起肿瘤的发生。
DNA甲基化对于肿瘤的发生和发展,具有重要的作用。
它可以通过多种方式参与调节肿瘤细胞的基因表达和功能。
首先,DNA甲基化可以引起癌的基因高度表达,包括促细胞分裂和生长的基因和转录激活因子。
例如,在结肠直肠癌和胃癌中,印迹基因CDKN2A的启动子区域的甲基化状态的改变被认为是这些肿瘤的重要驱动因素。
此外,在癌症中经常出现的促细胞分裂和生长信号通路基因的DNA甲基化也是引起癌症的重要机制之一。
其次,DNA甲基化还可压制肿瘤抑制基因的表达。
肿瘤抑制基因损失或其功能异常的情况下,细胞将失去对癌症的抵抗能力。
例如,在人类胃癌和乳腺癌中,肿瘤抑制基因BRCA1的基因沉默与BRCA1启动子区域的甲基化增加有关联。
DNA甲基化与表观遗传学

DNA甲基化与表观遗传学DNA甲基化是一种常见的表观遗传学调控方式, 通过甲基转移酶将甲基基团附加在DNA分子上, 影响DNA的解旋、螺旋结构和染色质构象, 进而调控基因表达。
DNA甲基化的作用和机制已经成为生命科学领域的研究热点, 在疾病和进化等方面的研究中发挥了至关重要的作用。
DNA甲基化的机制DNA甲基化是指在DNA分子上通过甲基转移酶添加甲基基团(-CH3), 形成甲基化序列。
DNMTs(甲基转移酶)是DNA甲基化的主要调节酶, 成功完成DNA甲基化需要DNMT1、DNMT3a和DNMT3b共同作用。
DNMT1是维持DNA甲基化的酶, 负责在DNA复制时维持DNA甲基化模式的稳定性。
DNMT3a和DNMT3b则是帮助甲基化酶作用于新DNA链和异常DNA区域的酶。
DNA甲基化的机制可以分为两种: 一种是“原位甲基化”, 即将甲基基团直接添加到已经存在的甲基化位点上; 另一种是“de novo甲基化”, 即在没有甲基化序列的基础上发生的甲基化反应。
实际上, 含有CG(甲基化位点常常位于CpG二核苷酸)的DNA序列往往是很高的DNA甲基化程度, 其他一些转录活性高的DNA序列也容易捕获甲基化反应, 一旦该序列甲基化, 就容易进行“原位甲基化”反应。
DNA甲基化的作用DNA甲基化虽然可以调节基因表达, 但是它并不是唯一的表观遗传学调控方式。
DNA甲基化对基因表达的影响是通过改变DNA的结构和染色质构象, 影响DNA高阶结构的形成来进行的。
1.阻止转录因子结合DNA甲基化可以阻止某些转录因子的定位, 阻止它们与DNA结合, 进而影响基因表达。
转录因子是一类重要的调控分子, 通过与DNA结构特异互补而与之靶向性地结合。
但是, 含有甲基化序列的DNA往往会阻止转录因子结合, 减少转录复合物(Transcriptional Machinery)的进入, 从而减少或停止基因的表达。
这样做可以帮助基因调控过程不太复杂, 只需控制在基因表达过程中产生的甲基化位点的数量即可。
植物DNA甲基化研究进展
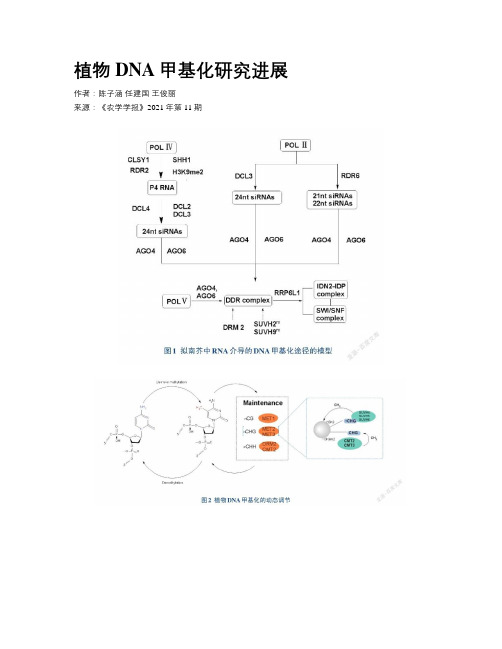
植物DNA甲基化研究进展作者:陈子涵任建国王俊丽来源:《农学学报》2021年第11期摘要:DNA甲基化是一種重要的表观遗传修饰,能够有效调控基因组稳定性。
为了了解DNA甲基化对植物生长发育的影响,本文归纳了近年来植物DNA甲基化的模式,总结了植物DNA甲基化的生物学功能,概括了DNA甲基化的研究方法,最后总结了植物DNA甲基化研究中存在的问题,并指明了研究方向,为后续植物基因组研究提供理论依据。
关键词:植物;DNA甲基化;表观遗传;修饰;生长发育;逆境胁迫;基因组;稳定性中图分类号:S184文献标志码:A论文编号:cjas2020-0152Research Advances on Plant DNA MethylationChen Zihan, Ren Jianguo, Wang Junli(School of Public Health, the key Laboratory of Enviromental Pollution Monitoring and Disease Control,Ministry of Education, Guizhou Medical University, Guiyang 550025, Guizhou, China)Abstract: DNA methylation is an important epigenetic modification that can effectively regulate genome stability. In order to understand the impact of DNA methylation on plant growth and development, this article summarizes plant DNA methylation patterns, concludes the physiological functions of plant DNA methylation, and reviews the research methods of DNA methylation. At last, this article sums up the problems in the study of plant DNA methylation and points out the research directions in the future, providing a theoretical basis for subsequent plant genome research.Keywords: Plants; DNA methylation; Epigenetic; Modification; Growth and Development; Adversity Stress; genome; stability0引言DNA甲基化(DNA methylation)是目前表观遗传学研究较为清晰的机制之一,广泛存在于生物界中,是真核细胞中最为常见的一种基因组修饰方式,它在调节基因组功能的同时不改变DNA的碱基序列。
表观遗传的调控机制

表观遗传的调控机制摘要: 表观遗传是非DNA 序列遗传信息的传递, 它不涉及基因序列的改变, 不符合孟德尔式的遗传方式。
表观遗传学研究的是生物可遗传的染色质修饰。
目前,其主要研究内容包括DNA 甲基化、翻译后组蛋白修饰、组蛋白组成变化。
其中DNA 甲基化是一种重要的表观遗传修饰方式, 是调节基因组功能的重要手段。
组蛋白修饰作为表观传中重要的调控机制之一, 在包括基因表达调控等多种生物学过程中起着重要作用。
组蛋白甲基转移酶和组蛋白去甲基化酶共同参与形成和维持不同的组蛋白甲基化状态, 继而通过多种分子参与对组蛋白甲基化修饰的识别而引起下游过程的发生。
组蛋白乙酰化和去乙酰化修饰也是调控表观遗传机制之一。
最近人们还发现非编码的RNA也参与了表观遗传调控。
关键词:表观遗传,DNA甲基化,组蛋白修饰,RNA调控。
一 DNA甲基化调控表观遗传经典遗传学认为,生命的遗传信息储存在 DNA的碱基序列上,几乎所有的生命活动都受基因调控。
但是,作为开放的复杂系统,生命活动从来就不是由一种因素就能完全决定的。
随着科学的发展,人们发现一些 DNA 或染色体水平的修饰也会造成基因表达模式的改变。
这种通过有丝分裂或减数分裂来传递非DNA 序列遗传信息的现象称为表观遗传(epigenetic inheritance)。
由于它不涉及基因序列的改变,不符合孟德尔式的遗传方式,因此它是一种全新的遗传机制。
表观遗传修饰有许多,其中 DNA 甲基化是基因组DNA 的一种最重要的表观遗传修饰方式,是调节基因组功能的重要手段。
在植物中,DNA 甲基化参与细胞的许多生物学过程,在植物生长发育及进化过程中起着重要的调节作用。
1 植物DNA胞嘧啶甲基转移酶植物DNA的甲基化是在 DNA 甲基转移酶(DNAMethyltransferase,DMT)的作用下,将 S- 腺苷甲硫氨酸上的甲基基团转移到 DNA 分子的胞嘧啶碱基上。
在植物细胞中广泛存在的有三类结构和功能上不同的胞嘧啶甲基转移酶[1,2]。
2022-2023学年佛山市普通高中教学质量检测高三生物试卷(二)(佛山二模)

2022-2023学年佛山市普通高中教学质量检测高三生物试卷(二)(佛山二模)一、选择题:本题包括16小题,共40分。
第1~12小题,每小题2分;第13~16小题,每小题4分。
在每小题给出的四个选项中,只有一项是最符合题目要求的。
1.原核生物的受体蛋白、粘附蛋白是经过糖基化修饰的蛋白质。
目前对原核生物蛋白糖基化的研究不断深入,其研究的目的不包括A.阐明原核病原菌的粘附及侵染机制B.利用原核生物糖蛋白研制相关疫苗C.在原核生物内质网中寻找多糖合成酶D.与真核生物糖基化途径对比获得进化的证据2.小明同学对“探究酵母菌细胞呼吸的方式”实验进行了改进,装置如下图所示。
下列叙述不恰当的是A,装置1中土豆片含过氧化氢酶,可以持续不断地提供氧气B.装置2应静置一段时间后再将软管插入溴麝香草酚蓝溶液中C.装置1和装置2中溴麝香草酚蓝溶液都会由蓝变绿再变黄D.在实验过程中还要注意对温度等其他条件的控制3.马达蛋白是一类利用ATP驱动自身沿细胞骨架定向运动的蛋白。
目前普遍认为细胞质流动是由马达蛋白介导的“货物”定向运输引起的。
下图为马达蛋白运输叶绿体的示意图。
fe下列叙述错误的是A.细胞骨架参与细胞内物质或结构的运输B.观察细胞质的流动可用叶绿体的运动作为参照C.该细胞中马达蛋白介导叶绿体朝不同的方向运输D.马达蛋白含有细胞骨架结合区域和“货物”结合区域4.研究发现剧烈运动造成的肌肉损伤会导致神经生长因子(NGF)大量分泌,使神经元动作电位阈值(又叫临界值,指一个效应能够产生的最低值)降低,痛觉敏感性增强。
该过程中NGF的作用可能是A.作为酶作用于细胞膜上相关受体,从而激活胞内信号通路B.加快胞内离子通道蛋白合成,增加膜上离子通道蛋白数量C.使膜上相关离子通道开放阈值升高,提高神经元的兴奋性D.抑制引起疼痛的神经递质的合成、释放以及与受体的结合5.城市高架桥桥底空间光照和降水相对较少,汽车尾气污染较重,管理维护频率低,常为城市管理的“灰色地带”。
4.2基因表达与性状的关系-表观遗传教学设计2021-2022学年高一下学期生物人教版必修2

4.2《基因表达与性状的关系-表观遗传》教学设计-人教版高中生物(2019)必修二教材分析《表观遗传》选自高中生物人教版教材必修二《遗传与进化》第 4章第 2节。
本节课内容为现代遗传学研究的前沿内容,与人类生活较密切的部分相关实例已得到了清晰阐释,如柳穿鱼花的花色遗传,小鼠的毛色遗传等,通过对其遗传物质的研究最终得到“存在基因中碱基序列不变但表型改变的表观遗传现象”的概念。
在此基础上延申甲基化和组蛋白修饰等表观遗传修饰在细胞分化过程中的作用,细胞癌变和诱导多动能干细胞过程中的表观遗传修饰改变现象。
从教材本节课的安排来看,前期课程先介绍了基因表达的过程,再描述了基因表达与性状的关系,最后讲表达过程中进行影响的表观遗传现象,体现了教材编写的逻辑性,从微观到宏观,从机制到表现,符合学生的认知规律。
本节课的重点在于影响基因表达的因素,表观遗传的特点、表观遗传的实例、基因与表达产物、基因与环境之间的相互作用对生物体性状产生何种影响。
能力要求更加偏重于对现象的解释和机制的探究。
学情分析本节内容安排在经典遗传学之后,目的是通过“细胞分化的本质是基因选择性表达的结果”和“表观遗传机制控制基因表达”两部分内容的学习,加深对遗传信息传递和表达过程的理解,构建完整的生物学大概念,为形成遗传与进化的生命观念做好分子层面的铺垫。
学生之前已经掌握了经典遗传学,以及基因对性状对常规控制,已经有了一定的学习基础。
作为课标和教材新加入的教学内容,“表观遗传”的引入是最新研究成果进入高中课堂的生动体现,也是本节课内容的重点和难点。
为突破重点和难点,本节课以问题为导向,充分考虑学生的接受能力,以科学研究证据为资料,从讨论父母给的遗传信息都一样么,以及“细胞分化”与“基因表达”的关系入手,分析科学研究数据,概述细胞的分化是基因选择性表达的结果;然后提出新问题:“基因选择性表达是如何调控的?”以科学研究进展为材料,构建表观遗传的概念并总结出表观遗传的调控方式;再以现实问题创设情境,引导学生在层层递进真实情境中解决问题,符合学生的认知规律,促进生物学学科核心素养的落实。
5_氮杂胞苷促进白菜开花的效应分析

表 1 5-azaC 对白菜花芽分化的影响 Tabl e 1 Eff ect of 5-az aC on fl or al bud dif f erent iat ion of
non-headin g chinese cabbage
处理/ Lmol / L
0 50
花芽分化 2~5 级 现蕾百分
百分率/ %
关 键 词: 5-azaC; 白菜; 开花; DN A 甲基化; 低温 中图分类号: T P 18 文献标识码: A
L I M ei-lan1, ZEN G Guang -w en2 , ZHU Zhu-jun1 ( 1. H orticultur al D ep ar tment, Zhej iang U niv er sity , H angz hou 310029, China; 2. D ep t. of Biosciance, Zhej iang H niv , H angz hou 310029, China) Analysis of ef f ects of 5-azacytidine on promoting f lowering in non-heading chinese cabbage. Jour nal o f Z hejiang U niver sity ( A g ric. & L ife Sci. ) , 2003, 29( 3) : 287-290 Abstract: T he t reatment of the seeds w ith 5-azacyt idine pro mot ed flo wer ing at low concentra tio n but inhibited flow er ing at hig h concentra tio n in non-heading chinese cabba ge. T he o ptimum co ncentr atio n w as 250 Lm ol/ L . In addition the effects of 5-azacy tidine w er e additiv e w it h low temper atur e. 5-azacy tidine decreased DN A m ethylatio n level and g ibber ellin content. T hese r esults indicat ed that 5-azacy tidine could substitute for the effects of low tempera tur e in flow er pr omo tio n.
DNA甲基化和CpG岛

D N A甲基化和C p G岛试题解析试题:表现遗传是指DNA序列不改变,而基因表达发生可遗传的改变。
DNA甲基化是表现遗传中最常见的现象之一,某些基因在启动子上存在富含双核苷酸“CG”的区域,称为“CG岛”,其中的胞嘧啶在发生甲基化后转变成5-甲基胞嘧啶,但仍能与鸟嘌呤互补配对。
细胞中存在两种DNA甲基化酶(如图1),“从头甲基化酶”只作用于非甲基化的DNA,使其半甲基化;“持续甲基化酶”只作用于DNA的半甲基化位点,使其全甲基化。
请回答:(1)图2中过程①是DNA以方式进行复制,其产物都是甲基化的,因此,过程②必须经过的催化才能获得与亲代分子相同的甲基化状态。
(2)研究发现,启动子中“CG岛”的甲基化会影响相关蛋白质与启动子的结合,从而抑制。
(3)小鼠的A基因编码胰岛素生长因子-2(IGF-2),a 基因无此功能(A、a位于常染色体上)。
IGF-2是小鼠正常发育必须的一种蛋白质,缺乏时小鼠个体矮小。
在小鼠胚胎中,来自父本的A及其等位基因能够表达,来自母本的则不能表达。
检测发现,这对基因的启动子在精子中是非甲基化的,在卵细胞中则是甲基化的。
若纯合矮小雌鼠与纯合正常雄鼠杂交,则F1的表现型应为。
F1雌雄个体间随机交配,则F2的表现型及其比例应为。
(4)5-氮杂胞苷(AZA)常用于临床上治疗DNA甲基化引起的疾病。
推测AZA可能的作用机制之一是:AZA与“CG 岛”中的竞争甲基化酶,从而降低DNA 的甲基化程度。
答案:(1)半保留半持续甲基化(2)转录(或基因的表达)(3)(全部)正常正常:矮小=1:1(4)胞嘧啶解析:(1)DNA复制方式为半保留复制;图2中①过程的产物都是半甲基化的;由于从头甲基化酶只作用于非甲基化的DNA,使其半甲基化,而持续甲基化酶只作用于DNA的半甲基化位点,使其全甲基化,因此过程②必须经过持续甲基化的催化才能获得与亲代分子相同的全甲基化状态。
(2)启动子(又称启动部位)是RNA聚合酶识别和结合的位点,能启动转录过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第41卷第1期河南大学学报(自然科学版)Vol.41 No.1 2011年1月Journal of Henan University(Natural Science)Jan.201152氮杂胞苷对小麦生长发育及DNA甲基化的影响陈芳,王子成3(河南大学生命科学学院农业生物技术研究所,河南开封475004)摘 要:以小麦(T riticum aestivum L.)品种周98165为材料,对52azaC处理前后的幼苗形态及生长指标进行了研究,并采用A FL P和MSA P技术对其遗传稳定性和DNA甲基化变化作了初步探讨.结果表明,一定浓度(5~50μmol/L)的52azaC不仅能使小麦的分蘖能力有所提高,而且还影响抽穗和花期、千粒重等指标,100μmol/L以上的52azaC对小麦根和苗的生长有显著的抑制效应.A FL P分析表明,不同浓度52azaC处理之间未见明显差异片段, 52azaC处理过程中材料基因组碱基序列保持一致,未发生变异.运用MSA P技术分析了52azaC处理前后样品的甲基化水平,与对照相比,52azaC处理后的材料均产生了不同程度的甲基化变化,其中去甲基化条带占总变异带的60%以上.DNA去甲基化的程度随52azaC剂量的增大而提高,且不同浓度处理引起的甲基化变化的模式基本一致.关键词:小麦;52氮杂胞苷;A FL P;MSA P;甲基化变化;生长发育;产量中图分类号:Q945;Q946 文献标志码:A文章编号:1003-4978(2011)01-0061-06E ffects of52azaC on Development and D NA Methylation in WheatC H EN Fang,WAN G Zi2cheng3(I nstitute of A g ricultural B iotechnology,College of L i f e Science,Henan Universit y,Henan Kai f eng475004,China)Abstract:Seedling morphogenesis and growth indexes after52azaC treatment of wheat cultivars were studied, meanwhile genetic stability and DNA methylation variation of the samples were initially researched by A FL P and MSA P.The results showed that not only the tiller ability of wheat was promoted,but also other growth indexes such as heading and anthesis time,10002grain weight were affected by5~50μmol/L52azaC.Nevertheless the growth of wheat’s roots and seedlings were all significantly inhibited by52azaC over100μmol/L.No polymorphic bands were found among different samples with52azaC by A FL P analysis.The results revealed that no nucleotide sequence had altered during52azaC treatment.The DNA methylation status of samples was analysed by MSA paired to the control,some methylation alterations were found in the samples after52azaC treatment.The DNA demethylation bands were over60%of the total variation fragment.It is clear that the main role of52azaC is to make DNA methylation decrease.The level of DNA demethylation was increasing when52azaC concentration was added.Demethylation levels increased with52azaC concentration,meanwhile,the patterns of methylation variation were consistent in different treatments.K ey w ords:wheat;52azaC;A FL P;MSA P;methylation variation;development;production DNA甲基化(DNA met hylation)是生物基因组遗传信息的重要组成部分,是重要的表观遗传信号.在植物发育和分化过程中DNA甲基化是控制基因表达的一种调控机制,甲基化水平的变化会影响植物的表型变化[1].一些表观变异,可传递给后代[224],花期和株高[5]、抗病性[6]和产量[7]等一些重要的农艺性状也可受DNA甲基化变化的影响,并且甲基化多态性所产生的某些表型变异可为育种选择提供原料.DNA甲基 收稿日期:2010209208 基金项目:河南大学校内基金重点资助项目(06ZDZR011) 作者简介:陈芳(1975-),女,河南开封人,硕士研究生.研究方向:植物表观遗传学. 3通讯作者,E2mail:wzc@ 河南大学学报(自然科学版),2011年,第41卷第1期62化抑制剂52氮杂胞苷(52azaC)和52氮脱氧胞嘧啶核苷(azadC)是一类能使基因组甲基化水平降低的碱基类似物,已广泛用于调节植物DNA甲基化水平,进行植物生长发育调控等方面的研究.在一些植物中,如亚麻[5]、水稻[6]等,利用DNA甲基化抑制剂已诱导出了表型或发育异常的植株,且这些变化同已变化的甲基化状态可传递给后代.甲基化抑制剂处理植株后,整体甲基化水平降低,诱导一些有益的新性状如亚麻的矮化和早熟[5],水稻白叶枯病抗性[6]等可用于育种,并产生一定的生产和社会效益.目前涉及甲基化研究的植物有水稻[6,8]、亚麻[5,9]、拟南芥[10]、小麦[11]等.小麦(T riticum aesti v um L.)是我国重要的粮食作物,有研究表明去甲基化试剂处理可以部分地代替低温春化处理促进小麦开花[11],但对小麦其他性状,尤其是产量性状有什么影响还缺乏研究.目前,DNA甲基化修饰在小麦育种的研究还未见报道.本研究以小麦为材料,对甲基化抑制剂52azaC对小麦生长发育和DNA甲基化的影响进行了一些探索,以期为利用表观遗传学的手段研究小麦育种及生产提供一定的依据.1 材料和方法1.1 材料研究材料为小麦(T riticum aesti v um L.)品种周98165.1.2 方法1.2.1 小麦的培养小麦种子用75%的酒精消毒后用无菌水浸泡数小时,当小麦露嘴时,移入铺有两层滤纸的培养皿中,置光照培养箱中培养.培养条件:温度(22±1)℃,湿度70%,光照时间12h/d,光照强度40μmol・m-2・s-1.1.2.2 甲基化抑制剂处理分别用0.5、1、5、10、50、100、500、1000μmol/L的52azaC处理小麦幼苗,同时设1个空白(蒸馏水处理)对照组,共9个处理,每个处理设3个重复.每次每个培养皿加入5mL52azaC溶液,每2d换一次溶液,10d 后每个处理随机取10株幼苗嫩叶混合提取DNA,其余麦苗移载大田并观察田间生长情况.1.2.3 分子标记检测遗传变异情况采用C TAB法提取小麦嫩叶DNA,参照Micheli等[12]方法.A FL P分析参照Hao Y J等[13]的方法,略有不同.EcoR I/Mse I酶切分步进行:20μL体系含200ng DNA和3U EcoR I,37℃酶切8h,沉淀DNA,抽干,加10μL无菌双蒸水溶解,随后加入3U Mse I,2μL10×buffer(100mmol/L Tris2HCl,p H7.5;100 mmol/L MgCl2和10mmol/L dit hiot hreitol),无菌双蒸水补足20μL,65℃酶切8h.连接:EcoR I接头, Mse I接头,T4连接酶,25℃连接2.5h.预扩:引物为E2A、M2C,Taq酶,扩增2h;7对引物组合用于A FL P 选扩.选扩产物94℃变性5min后上样于6%PA GE,恒功率55W电泳2.5h,固定、银染漂洗与显色后拍照并分析结果.MSA P分析参照Cervera等[14]方法.与前面A FL P方法类似,其中内切酶组合为EcoR I/H a p II和EcoR I/Ms p I.接头为EcoR I接头和H2M接头,预扩引物为E2A和H a p II2Ms p I,选扩引物组合10对.2种分子标记检测所用的接头及引物来自上海生工公司,详见文献[15]中的表1.1.3 数据分析采用软件SPSS10.0多重比较,Origin7.5作图.2 结果与分析2.1 52azaC对小麦幼苗生长的影响不同浓度的52azaC对萌发的小麦幼苗处理10d后发现,3个较高浓度(100、500、1000μmol/L)处理不仅对小麦幼苗根系生长有显著抑制效应,也影响地上部的生长(图1).低浓度(50μmol/L以下)52azaC处理的根和苗的生长情况与对照类似,初生根数基本与对照(6个)一致.经500、1000μmol/L处理的幼苗根系不发达,根长不到对照的1/3,且初生根明显减少,分别为4-5、3-4个.总之,较高浓度的52azaC具有抑制根和苗生长的作用,当浓度大于50μmol/L时,根和苗的长度随处理浓度的增加而降低,与对照相比差异显著(图1).当52azaC浓度达到1000μmol/L时,虽未见有枯萎及致死现象,但根长仅为2.4cm,相当于对照萌发4d时根的长度,株高为5.60cm,明显低于对照(7.82cm)及其他处理,且95%以上的苗初生根只有3陈芳,等:52氮杂胞苷对小麦生长发育及DNA甲基化的影响63-4个.2.2 52azaC对小麦主要生长和产量性状的影响2.2.1 52azaC对小麦抽穗和花期的影响经不同浓度52azaC处理过的小麦植株,移栽至大田后至生育后期发现处理组和对照组的抽穗和开花时间有差异,其差异程度主要受52azaC浓度的影响(图2).当52azaC处理浓度低于1μmol/L时,处理组的抽穗和开花时间与对照组相比没有明显区别;当浓度为5~100μmol/L时,则处理组抽穗和开花时间比对照组早1d以上.其中,浓度在50μmol/L时抽穗和开花时间均比对照组提前3d,其成熟期也相应提前.而浓度增大到500μmol/L以上时,则二者差异并不显著.图 1 不同浓度52azaC处理10d对小麦幼苗生长的影响Fig.1 Effects of differernt concentrations of52azaC treated for10days on wheat seedlingsgrowth图2 不同浓度52azaC对小麦抽穗和花期的影响Fig.2 Effects of different concentrations of52azaC on wheat heading and anthesis time2.2.2 52azaC对小麦有关产量指标的影响田间观察表明,在整个生育期间,处理组与对照组都能正常生长发育,其叶形、叶色、穗形、籽粒颜色等农艺性状基本一致.不同浓度52azaC处理过的植株的分蘖数均明显高于对照(0.5μmol/L除外),且52azaC浓度为50μmol/L和100μmol/L时小麦的分蘖数和分蘖率最大(表1).与对照相比,5、10、50μmol/L处理植株的株高和千粒重都有所增加,且差异显著,以50μmol/L处理植株的株高最高(表1).浓度为100μmol/L 时,株高与对照无显著差别,但千粒重最大,明显高于对照.穗长和穗粒数各处理间变化不大.表1 不同浓度52azaC处理对小麦生长和产量性状的影响Tab.1 Effects of different concentrations of52azaC on wheat growth and production characters 处理浓度/(μmol・L-1)分蘖数分蘖率/%株高/cm穗长/cm穗粒数千粒重/g0 2.6±0.2476.051.0±1.058.4±0.2057.7±1.6649.9±0.560.5 2.6±0.2178.453.2±0.848.2±0.1357.3±0.9349.0±0.17132.9±0.1685.153.5±0.908.6±0.1554.3±2.6851.0±0.48533.1±0.2088.4355.7±1.008.8±0.2054.7±1.61352.7±0.29 1033.1±0.2288.2355.6±0.708.7±0.1957.7±1.75352.5±0.15 5033.2±0.1595.6360.0±0.908.7±0.1558.1±1.19353.3±0.36 10033.2±0.1791.254.8±0.758.6±0.1058.3±2.38353.8±0.47 50033.1±0.1889.953.8±0.958.5±0.1457.4±2.3751.5±0.23 100033.0±0.2576.152.0±0.878.5±0.2152.7±1.4050.2±0.51表示与对照相比有显著性差异α=5%;分蘖率=分蘖的植株数/全部植株数×100%2.3 基因组序列的A FL P检测结果选用7对引物组合对52azaC不同浓度处理的9个样品进行扩增,均能扩增出清晰的条带,共扩增出2930条可统计条带,平均每对引物扩增40多条清晰带.每对引物对各处理样品扩增的多态性位置基本相同(如图3a),说明52azaC处理前后小麦幼苗基因组DNA序列保持一致,未发生变异.64 河南大学学报(自然科学版),2011年,第41卷第1期2.4 MSA P 检测甲基化水平变化利用H a p II 和Ms p I 对DNA 甲基化敏感程度不同可检测出CCGG 序列的甲基化状态.为了便于分析,本文将MSA P 方法测出的带型分为A 、B 、C 、D 4种.A 表示H 、M 都有带(图3A ),为未甲基化或内侧胞嘧啶半甲基化(单链)类型;B 表示H 有带、M 无带(图3B ),为外侧胞嘧啶半甲基化或内、外侧胞嘧啶半甲基化类型;C 表示H 无带、M 有带(图3C ),为内胞嘧啶全甲基化(双链)类型.一般认为,MSA P 不能检测到DNA 外侧或内、外侧胞嘧啶完全甲基化位点(m CCGG/GGC m C 或m C m C GG/GG m C m C )[16217],即H 、M 在此酶切位点无带,如果对照有而52azaC 处理材料无带或对照无而处理材料有带,则说明52azaC 处理的材料在此位点发生了甲基化变化,并将这种情况下的带型用D 表示.C :对照;128分别表示52azaC 浓度为0.5、1、5、10、50、100、500、1000μmol/L ;H 、M 表示同裂酶H a p II 和Ms p I 的消化图谱;“π”表示部分变异类型.图3 基因组DNA 的A FL P (a )和MSAP 分析电泳图谱(b )Fig.3 DNA 2A FL P finger 2printing (a )and DNA methylation MSA P finger 2printing map (b )DNA 甲基化增加的带型变化可总结为:A →C ,A →D ,B →C ,B →D.相反,去甲基化变化的带型为:D →B ,D →A ,C →B ,C →A.不能确定DNA 甲基化增加或减少的带型变化为A →B ,C→D ,D →C ,B →A.MSA P 分析统计结果表明,10对引物组合共扩出460条左右清晰条带,其中,A 型带最多,有200多条,C 型带90条左右,比B 型带少40%左右(表2),表明所检测的基因组CCGG 序列多处于未甲基化或半甲基化状态.与对照相比,不同浓度52azaC 处理后的材料均存在甲基化变异带,且变异带的数量随处理浓度的增大而增加.不同浓度52azaC 处理的小麦幼苗的DNA 甲基化均有不同程度的降低,且降低程度明显依赖于52azaC 胁迫的剂量.此外,不同浓度52azaC 处理材料还有少数甲基化增加条带,且甲基化增加的幅度与52azaC 剂量的关系不大.统计的带型中,4种较高浓度处理材料的总带数均高于4种较低浓度和对照,说明高浓度条件下的甲基敏感多态性相对较高,其中较明显的是A 型带,随52azaC 浓度的增加而增加,C 型带随52azaC 浓度的增加而相对减少,表明较高浓度的52azaC 处理时,基因组中在低浓度52azaC 条件下没有发生去甲基化的部分C m C GG/GG m CC 位点可能进一步去甲基化,从而使甲基化敏感内切酶在这些位点产生新的酶切反应.表2 不同处理材料的MSA P 带型统计及甲基化变化情况Tab.2 MSA P 2banding patterns and DNA methylation variational status of samples处理浓度/(μmol ・L -1)A/B/C/总带数总变异带数(变异率/%)甲基化增加带数甲基化减少带数及比率(%)0204/161/90/4550.5209/163/91/46311(2.3)16(1.3)1207/165/91/46313(2.8)17(1.5)5210/162/89/46116(3.5)29(2.0)10214/159/88/46120(4.3)210(2.2)50215/164/87/46625(5.4)116(3.4)100216/165/87/46832(6.8)220(4.3)500221/161/85/46739(8.4)225(5.4)1000249/142/77/46851(10.9)334(7.3) 注:A 、B 、C 分别表示扩增的带型对不同的带型变化做了进一步统计分析(表3),发现甲基化增加的带型在不同浓度的52azaC 处理材料中基本上表现为B →D 型,可以确定是由半甲基化向全甲基化状态的转变.3种较高浓度在C →D 型带的还陈芳,等:52氮杂胞苷对小麦生长发育及DNA甲基化的影响65分别有1条,可能是全甲基化位点间的相互转化(C m C GG/GG m CC→m CC GG/GGC m C),也可能是外侧胞嘧啶重新甲基化(C m C GG/GG m CC→m C m CGG/GG m C m C).甲基化减少的各种带型中D→B型最多,C→A型次之,这一与抑制剂剂量密切相关的效应机理还有待深入研究.1000μmol/L52azaC处理的材料各种甲基化减少的带型都有,说明随52azaC浓度的增加去甲基化变化的数目和类型也在增多.另外,B→A型带随52 azaC剂量的增加变化较明显,D→C型在各处理间的变化不大.由于MSA P技术的局限性,不能确定这两种带型变化是外胞嘧啶甲基化向内胞嘧啶位点间的甲基变化还是去甲基化变化.公共带表示不同浓度处理材料中DNA甲基化变化类型相同的情况.表3 不同处理材料的带型变异情况Tab.3 Banding patterns variational status of samples处理浓度/(μmol・L-1)甲基化增加带型3A→B A→C A→D B→C B→D 3C→D甲基化减少带型3D→C D→B D→A C→B C→A3B→A0.50000102410121000010260013500002026003310000020260046500000102101056100000021313205650000002131530781000000031317511110公共带/条000010240012 “3”表示带型变化方向不完全确定,即有可能是甲基在CCGG位点间相互转换.3 讨论DNA甲基化抑制剂应用于植物中的研究表明,它可部分代替低温促进植物开花[11],这在植物育种工作中可能会有一定的应用价值.研究发现,植物的体细胞经胁迫后,可通过表观遗传机制在后代中传递[18219],表明了CG序列甲基化在许多表观遗传机制中起着主要作用,暗示了DNA甲基化变化存在的潜在育种价值[20].本研究对小麦幼苗进行了不同浓度的52azaC处理,结果表明,100μmol/L以上的52azaC对小麦幼苗根和苗的生长有明显的抑制作用.经不同浓度52azaC处理的小麦植株,移栽至大田后生长发育也有较明显的变化,如小麦在分蘖数、株高、抽穗及开花时间方面明显异于对照,这与甘蓝的研究结果相似[21].研究表明同一群体内,抽穗时间与穗粒数和粒重有密切关系[22].本研究发现抽穗时间早的处理组的千粒重也较重.在不考虑株高的情况下,50μmol/L和100μmol/L处理的植株分蘖数、分蘖率和千粒重均比其他浓度处理和对照高,表明合适浓度的52azaC处理有可能在一定程度上增加小麦的产量.而甲基化抑制剂处理使小麦花期提前的效应,也有可能在解决杂交育种中亲本花期不育方面发挥一定作用.因甲基化变异存在一定的随机性[23],故利用52azaC进行甲基化诱变育种可能会存在一定的盲目性,从而影响育种的实际效果[20],植株子一代中出现的表观变异和甲基化不足现象在F2代出现共分离[5],直接的、大量的证据支持仍缺乏等问题,预示着植物DNA甲基化修饰从研究到应用还需时日.有证据表明甲基化抑制剂引起的一些表观遗传变异是可遗传的,但基因水平上的证据还有限,仅在水稻的研究方面证实aza2 dC诱导的去甲基化与抗病基因相关[6].有研究表明低温可引起材料的DNA发生甲基化变化[24],超低温保存对植物材料也具有脱甲基化作用[13,15,25226].这些发生了DNA甲基化变化的位点涉及到哪些基因,有何生物功能,52azaC引起的去甲基化与低温处理引起的去甲基化是否存在相关性,还需要进行深入的研究.参考文献:[1]Chan S W L,Henderson I R,J acobsen S E.G ardening the genome:DNA methylation in A rabi dopsis thaliana[J].NatRev Genet,2005,6:351-360.[2]L ukens L N,Zhan S.The plant genome’s methylation status and response to stress:Implications for plant improvement[J].Curr Opin Plant Biol,2007,10(3):317-322. 河南大学学报(自然科学版),2011年,第41卷第1期66[3]Molinier J,Ries J,Zipfel C,et al.Transgeneration memory of stress in plants[J].Nature,2006,442:1046-1049.[4]Gressel J,Levy A A.Agriculture:The selector of improbable mutations[J].PNAS,2006,33(103):12215-12216.[5]Fieldes M A,Schaeffer S M,Krech M J,et al.DNA hypomethylation in52azacytidine2induced early2flowering lines of flax[J].Theor Appl G enet,2005,111(1):136-149.[6]Akimoto K,Katakami H,K im H J,et al.Epigenetic inheritance in rice plant[J].Ann Bot,2007,100:205-217.[7]Tani E,Polidoros A N,Nianiou2Obeidat I,et al.DNA methylation patterns are differentially affected by planting densityin maize inbreds and their hybrids[J].Maydica,2005,50:19-23.[8]Kumpatla S P,Teng W,Buchholz W G,et al.Epigenetic transcriptional silencing and52azacytidine2mediated reactivationof a complex transgene in rice[J].Plant Physiol,1997,115:361-373.[9]Brown J C L,De Decker M M,Fieldes M A.A comparative analysis of developmental profiles for DNA methylation in52azacytidine2induced early2flowering flax line and their control[J].Plant Sci,2008,175:217-225.[10]Wang Z C,Ma H X,He Y X.Effects of cadmium on A rabi dopsis thaliana DNA methylation[J].Plant PhysiologyCommunications,2009,45(2):115-118.[11]Horváth E,Szalai G,J anda T,et al.Effect of vernalisation and52azacytidine on the methylation level of DNA in wheat(T riticum aestivum L.,cv.Martonvásár15)[J].Plant Sci,2003,165:689-692.[12]Micheli MR,Rova R,Pascale E,et al.Reproducible DNA fingerprinting with the random amplified polymophic DNA(RAPD)method[J].Nucleic Acids Res,1994,22:1921-1922.[13]Hao Y J,Y ou CX,Deng XX.Analysis of ploidy and the patterns of amplified f ragment length polymorphism and methyla2tion sensitive amplified polymorphism in strawberry plants recovered f rom cryopreservation[J].Cryo2letter,2002,23(1): 37-46.[14]Cervera M T,Ruiz2G arcia L,Martinez2Zapater J.Analysis of methylation in A rabi dopsis thaliana based on methylation2senstive A FL P marker[J].Molecular G enetics and Genomics,2002,268(4):543-552.[15]Chen F,Wang Z C,He Y X,et al.Analysis of genetic variation of wheat seeds and seedlings caused by ultra2low2tem2perature preservation[J].Acta Agriculture Nucleatae Sinica,2009,23(4):548-554.[16]Xiong L Z,Xu C G,Maroof S,et al.Patterns of cytosine methylation in an elite rice hybrid and its parental lines,detec2ted by a methylation2sensitive amplification polymorphism technique[J].Molecular and G eneral Genetics M GG,1999,261(3):439-446.[17]Wang Z C,Li Z A,Li S P.The technology of MSA P and its applications in plant[J].Biotechnology Bulletin,2006,sup2plement:195-196.[18]Bruce T J A,Matthes M C,Napier J A,et al.Stressf ul“memories”of plants:Evidence and possible mechanisms[J].Plant Sci,2007,173(6):603-608.[19]Mathieu O,Reinders J,Caikovski M,et al.Transgenerational stability of the A rabi dopsis epigenome is coordinated byCG methylation[J].Cell,2007,130(5):851-862.[20]彭海,张静.胁迫与植物DNA甲基化:育种中的潜在应用与挑战[J].自然科学进展,2009,19(3):248-256.[21]King G J.Morphological development in brassica oleraceais modulated by in vivo treatment with52azacytidine[J].JourmHorticul Sci,1995,70(2):333-342.[22]Zhang W C,Li C X,Zhang S D,et al.A study on the relationship between the grain weight per ear in the heading period[J].Journal of Henan Vocation2Technical Teachers College,1992,20(2):1-6.[23]Zhao X,Chai Y,Liu B.Epigenetic inheritance and variation of DNA methylation level and pattern in maize intra2specifichybrids[J].Plant Sci,2007,172:930-938.[24]Sherman J D,Talbert L E.Vernalization2induced changes of the DNA methylation pattern in winter wheat[J].G enome,2002,45:253-260.[25]He Y X,Wang Z C.Variation of DNA methylation in A rabi dopsis thaliana seedlings after the cryopreservation[J].Bul2letin of Botany,2009,44(3):276-281.[26]Kaity A,Ashmore S E,Drew R A,et al.Assessment of genetic and epigenetic changes following cryopreservation in pa2paya[J].Plant Cell Rep,2008,27:1529-1539.责任编辑:康燕丽。
