氢氘原子光谱共20页
1-2氢-氘原子光谱

1-2 氢-氘原子光谱引言原子光谱的研究,为量子理论的建立提供了坚实的实验基础。
氢原子是结构最简单的原子,其光谱也是最简单的。
1885年,巴尔末(J.J.Balmer )根据人们的观测数据,总结出了氢原子光谱线的经验公式。
1913年,玻尔(N.Bohr )在巴尔末研究成果基础上,提出了氢原子的玻尔模型;1925年,海森伯(W.Heisenberg )提出的量子力学理论,也是建立在原子光谱的测量基础之上的。
现在,原子光谱的观测研究,仍然是研究原子结构的重要方法之一。
20世纪初,人们根据实验预测氢有同位素。
1919年发明质谱仪后,物理学家用质谱仪测得氢的原子量为1.00778,而化学家由各种化合物测得的结果为1.00779。
基于上述微小的差异,伯奇(Birge)认为氢有同位素2H (元素左上角标代表原子量),它的质量约为1H 的2倍,据此他算得1H 和2H 在自然界中的含量比大约为4000:1。
由于里德伯(J.R.Rydberg)常量和原子核的质量有关,因此,2H 的光谱相对于1H 的应该会有位移。
1932年,尤雷(H.C.Urey)将3L 液氢在低压下细心蒸发至1mL 以提高2H 的含量,然后将这1mL 液氢注入放电管中,用它拍得的光谱,果然出现了相对于1H 移位了的2H 的光谱,从而发现了重氢,取名为氘,化学符号用D 表示。
由此可见,对样品的考究,实验的细心,测量的精确,于科学进步非常重要。
预习思考1. 巴尔末总结出来的氢原子光谱线的经验公式是什么?2. 如何利用测量的氢、氘光谱线计算相应的里德伯常数?3. 棱镜摄谱仪、光栅光谱仪是如何实现波长选择的?实验目的1. 加深对氢光谱规律和同位素位移的认识。
2. 通过计算氢、氘原子的里德伯常数,了解精密测量的意义。
3. 掌握利用摄谱仪、光栅光谱仪测量氢、氘原子光谱的方法。
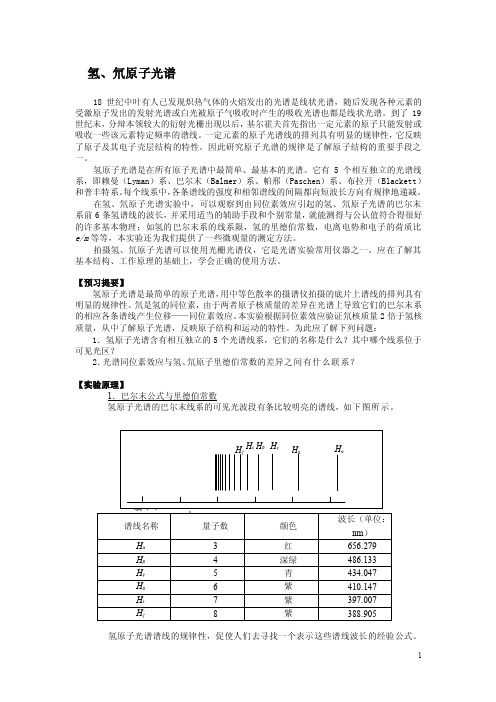
实验原理1885年,巴尔末发现了氢原子光谱的规律,特别是位于可见光区的四条H α,H β,H γ和H δ谱线,其波长可以很准确的用经验公式(巴尔末公式)来表示。
氢氘光谱实验PPT

物理实验教学中心 2017.01.18
实验目的 理解如何用原子光谱方法分析同位素。 了解光栅光谱仪的基本构造,掌握光栅光谱仪测 量光谱的方法。 测算氢氘巴尔末线系前四条谱线的波长、里德伯 常数,并计算氢氘的质量比。
氢原子光谱
n2=5
莱曼系 n2=1 n1=2,3,4,5…
原子核 电子
2M R D R 2 M m
R 为将核的质量视为无穷大(即假定核固定不动)时的里德伯常数。
1 1 H D R R H D
1 1 2 n2 2
M m 2M m 2M m M 1 2M
(10 9 s ) 可以用来测量
快速的光脉冲过程。光电倍增管是光谱工作中最常用的光电器件之一。
实验仪器
电源
氢氘灯
光电倍增管
光谱仪
汞灯
实验仪器
数据采集器 电源
光电倍增管
汞灯
氢氘灯
光谱仪
实验过程和实验报告要求
1.仔细阅读实验操作板,理解实验原理和仪器使用方法。 2.使用光谱仪测量汞灯光谱,记录汞灯谱线位置。 3.使用光谱仪测量氢氘光谱各个谱峰位置,放大后记录氢氘谱峰数据。 4.实验报告要求使用汞灯谱线测量数据与标准数据参考拟合,获得转换 关系方程。 5.将实验测量得到的氢氘光谱数据代入该方程式中,获得近似标准氢氘 谱线数据。 6.计算氢氘谱线的里德伯常数、氢氘核质量比和质子电子质量比。 7.思考题和实验总结。
同位素位移
由于同一元素的不同同位素,它们原子核所拥有的中子数不同,引起原 子核质量差异和电荷分布的微小差异,而引起原子光谱波长的微小差别称为 “同位素位移”。 氢原子核是一个质子,其质量为M,氘核比氢核多一个中子,其质量近 似为2M。氢原子与氘原子的里德伯常数分别为:
氢与氘原子光谱共49页文档

谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
氢与氘原子光谱
6、纪律是自由的第一条件。——黑格 尔 7、纪律是集体的面貌,集体的声音, 集体的 动作, 集体的 表情, 集体的 信念。 ——马 卡连柯
8、我们现在必须完全保持党的纪律, 否则一 切都会 陷入污 泥中。 ——马 克思 9、学校没有纪律便如磨坊没有水。— —夸美 纽斯
10、一个人应该:活泼而守纪律,天 真而不 幼稚, 勇敢而 鲁莽, 倔强而 有原则 ,热情 而不冲 动,乐 观而不 盲目。 ——马 克思
氘原子光谱△
氢、氘原子光谱18世纪中叶有人已发现炽热气体的火焰发出的光谱是线状光谱,随后发现各种元素的受激原子发出的发射光谱或白光被原子气吸收时产生的吸收光谱也都是线状光谱。
到了19世纪末,分辩本领较大的衍射光栅出现以后,基尔霍夫首先指出一定元素的原子只能发射或吸收一些该元素特定频率的谱线。
一定元素的原子光谱线的排列具有明显的规律性,它反映了原子及其电子壳层结构的特性。
因此研究原子光谱的规律是了解原子结构的重要手段之一。
氢原子光谱是在所有原子光谱中最简单、最基本的光谱。
它有5个相互独立的光谱线系,即赖曼(Lyman)系、巴尔末(Balmer)系、帕邢(Paschen)系、布拉开(Blackett)和普丰特系。
每个线系中,各条谱线的强度和相邻谱线的间隔都向短波长方向有规律地递减。
在氢、氘原子光谱实验中,可以观察到由同位素效应引起的氢、氘原子光谱的巴尔末系前6条氢谱线的波长,并采用适当的辅助手段和个别常量,就能测得与公认值符合得很好的许多基本物理;如氢的巴尔末系的线系限,氢的里德伯常数,电离电势和电子的荷质比e/m等等,本实验还为我们提供了一些微观量的测定方法。
拍摄氢、氘原子光谱可以使用光栅光谱仪,它是光谱实验常用仪器之一。
应在了解其基本结构、工作原理的基础上,学会正确的使用方法。
【预习提要】氢原子光谱是最简单的原子光谱,用中等色散率的摄谱仪拍摄的底片上谱线的排列具有明显的规律性。
氘是氢的同位素,由于两者原子核质量的差异在光谱上导致它们的巴尔末系的相应各条谱线产生位移——同位素效应。
本实验根据同位素效应验证氘核质量2倍于氢核质量,从中了解原子光谱,反映原子结构和运动的特性。
为此应了解下列问题:1.氢原子光谱含有相互独立的5个光谱线系,它们的名称是什么?其中哪个线系位于可见光区?2.光谱同位素效应与氢、氘原子里德伯常数的差异之间有什么联系?【实验原理】1.巴尔末公式与里德伯常数氢原子光谱的巴尔末线系的可见光波段有条比较明亮的谱线,如下图所示。
氢与氘原子光谱

调 节
5
2.旋转6使右边圆盘读 数中的0对准指针位置.
9 8 7 6 5 4 3 2 1 0
10 6
4 5 6 9 2 8 1 3
5 15
10
1.旋转5将5mm刻度线拉到十 分之一毫米刻度线0的位置.
7
调
节
读数
95
9 8 7 6 5 4 3 2 1 0
0
4 10 2 8
5 6 9 3 1
4
5 30
11. 计算有关量.
氢与氘原子光谱
实验目的
1、通过拍摄氢(氘)、铁原子光谱,或利用多功 能组合光栅光谱仪采集氢(氘)光谱,求出里德伯 常数,以达到初步掌握光谱定性分析的基本方法; 2、测定氘氢原子核质量比; 3、理想精确测量的意义。
实验原理
1.氢光谱巴尔末线系(在可见光区)的规律为
n2 λH = 364.56 2 nm n −4
R∞ RH = (1 + m / M ) R∞ H RA = ⇒ R∞ (1 + m / M A ) RD = (1 + m / M D ) MD m λH = ⋅ M H M H (λD − λH + λD m / M H )
3.比较光谱法测定谱线的波长
λ1 , λ2 分别为标准谱,
6.求谱线波长 6.求谱线波长 测谱线的坐标:谱片放在阿贝比长仪上,读取标 准谱(铁谱) 准谱(铁谱)和待测谱的坐标。
阿贝比长仪
4 10 2 8 1 5 6 9 3
1.工作台 2.导板 3.主标尺 4.视物显微镜 5.微米计转轮 6.微调旋钮 7.微移转轮 8.固定板 9.读数显微镜 10.热辐射屏罩
点击
8. 峰值检索.
1-1 氢(氘)原子光谱

专题实验1 光谱的测量与分析1.1 氢(氘)原子光谱原子光谱是建立量子理论的实验基础。
1885年,巴尔末(J. J. Balmer )根据已有的观测结果,提出氢光谱线的经验公式。
波尔(N. Bohr )1913年2月看到这一公式,3月6日就建立了氢原子理论;海森堡(W. Heisenberg )在1925年提出量子力学理论也是基于原子光谱的实验成就;光谱的精细结构使人们认识到核外电子的运动状态除了存在主能级量子化以外,还有亚能级量子化。
1932年,尤里(H. C. Urey )将3 liter 液态氢在低压下缓慢蒸发至1 ml 后,注入放电管,拍摄其巴尔末线系光谱,发现在普通氢(氕)每条谱线的短波侧都出现一条弱的伴线,从而证实了氘的存在。
这是原子核质量差异导致里德伯常数发生变化的结果,称为同位素移位。
对于重核,同位素移位并不明显,但是中子数不同会引起核自旋发生改变,光谱结构还是会复杂化,这就是所谓的超精细结构。
今天,原子光谱仍然是研究原子结构的重要方法。
一、实验目的(1)了解光栅光谱仪等常见光谱分析仪器的原理和使用方法; (2)通过测量巴尔末线系的谱线波长,计算氘的里德伯常数。
二、实验原理原子虽然是元素的最小单元,但还具有复杂的核式内部结构,核外是绕核运动的电子。
α粒子散射实验肯定了原子的核式结构,而对核外结构的认识则是从光谱研究开始的。
光谱记录了电磁辐射随波长变化的强度分布,是研究原子结构的重要手段。
通过测量原子发光光谱中各谱线的波长,可以推算出原子的能级结构,从而得到有关原子微观结构的信息。
光谱主要指发射光谱或吸收光谱。
发射光谱是由发光体直接产生的光谱,例如,由炽热的固体、液体和高压气体发光形成的连续光谱和由稀薄气体或者金属蒸汽发光形成的明线光谱都属于发射光谱。
吸收光谱则是连续光谱中某些波长的光被物质吸收后产生的光谱。
吸收光谱中的每条暗线都与物质的特征谱线相对应。
在所有的元素中,氢的原子结构最简单,从氢原子明线光谱理解原子的核外结构也最直观。
近代物理实验氢和氘原子光谱PPT(完整版)

电弧发生器、投影仪、映谱仪、铁电极一对、 仪器的光路图挂在实验室的墙壁上。
摄完谱后,将暗盒拿到暗室中进行洗相,显定影时间由教师指定。
铁光谱标准图一套、洗相设备一套。 RD= R∞ /(1+m/MD) (5)
实验原理
氢原子光谱谱线的规律性,促使人们去寻找一个表示这些谱线波
长的以验公式。1885年巴尔末提出经验公式,表示这些谱线的波
长大小:
ห้องสมุดไป่ตู้
364.56
n2 n2
4
nm
1896年里德伯(Rydberg)引用波长的倒数——波数将巴尔末经验
公式改写成光谱项概念的形式:
v~
1
R
1 22
1
n2
(1)
式中R为里德伯常数。此式完全是从实验中得到的经验公式,然 而它在实验误差范围内与测定值的符合是非常惊人的。在这些经 验公式的基础上,玻尔(Bohr)利用普朗克(Planck)的量子假 设和经典物理理论建立了氢原子理论。根据玻尔理论,原子的能 量是量子化的,即原子具有能级。每条光谱线的产生,都是处于 相同状态的原子中的电子从一个能级跃迁到另一个较低的能级时 释放出能量的结果。将玻尔关于氢原子理论推广到视原子核的质 量与电子质量相比为有限且原子核与电子都绕它们的质心转动的 情况时,可用下式表示氢原子光谱各线系每条谱线的波数:
实验原理
氢原子光谱的巴尔末线系v~的可见(光4波2段有02条e) 比24 mh较3明c亮的1谱线m,1如/下M图所示n。12f
1 n2
(2)
R摄D完=谱R后∞,式/(将1+暗m中盒/M拿D为)到暗(e5)室电中进子行洗电相,荷显定,影时h间为由教普师指朗定。克常数,c为光速,m为电子质
实验氢-氘原子光谱

实验氢-氘原子光谱原子光谱的测定与分析,为量子理论的建立提供了坚实的实验基础。
1885年巴尔末(J. J. Balmer )总结出了氢光谱线的经验公式。
1913年玻尔(N. Bohr ),1925年,海森伯(W.Heisenberg )建立起他们的理论都是建筑在原子光谱的测量基础之上的。
现在,无论在工业生产部门还是在科学研究领域,原子光谱的观察、测定和分析都是研究原子结构、物质分析的重要方法之一。
在物理学、化学化工、材料、生命科学领域内有广泛的实际应用。
一 实验目的1.掌握WPG-100型平面光栅摄谱仪的工作原理和使用方法,学习摄谱、识谱和谱线测量等光谱研究的基本技术。
2.通过所测得的氢(氘)原子光谱在可见和近紫外区的波长(误差小于0.5Å),验证巴耳末公式并准确测出氢(氘)的里德伯常数。
3.测量氢、氘同位素位移,求出质子与电子的质量比。
二 实验原理1.原子的激发与辐射原子内部的不同能量状态称为能级。
处于基态的原子可以吸收能量而跃迁到较高的能量状态,这个过程称为原子的激发。
原子也可以从较高的能级退到较低的能级或基态而放出能量,如果放出的能量取辐射形式,那么放出的能量就成为一个光子的能量hv ,这个过程称为原子的辐射。
要使原子发光必须先将它激发,原子激发的方式通常分为碰撞激发和光激发两种。
具有一定能量的电子、原子、分子与某原子相碰撞而使后者激发称为碰撞激发;原子吸收一个光子引起的激发称为光激发,即光的吸收过程。
本实验采用碰撞激发,它又分为热激发和电场引起的碰撞激发两种形式,前者指在高温下各原子有较大的运动速度,相互碰撞而产生激发,本实验的铁光谱就是这种方式产生的。
电场引起的碰撞激发是带电粒子在电场作用下加速运动,与原子发生非弹性碰撞使原子激发,氢(氘)光谱就是采用这种方式产生的。
2.氢原子光谱的实验规律早在原子理论建立以前人们就积累了有关原子光谱的大量实验数据,发现氢原子光谱可用一个普通的公式表示,即⎪⎭⎫ ⎝⎛-=2211~n mR v (1)其中:m 取1、2、3、4、5等正整数,每一个m 值对应一个光谱线系,如当m=2时便得到谱线在可见光和近紫外区的巴耳末线系;n 取m+1、m+2、m+3、…等正整数,每一个n 值对应一条谱线;R 称为里德伯常数。
