112板蓝根注射液成品内控质量标准
板蓝根质量标准及检验操作规程
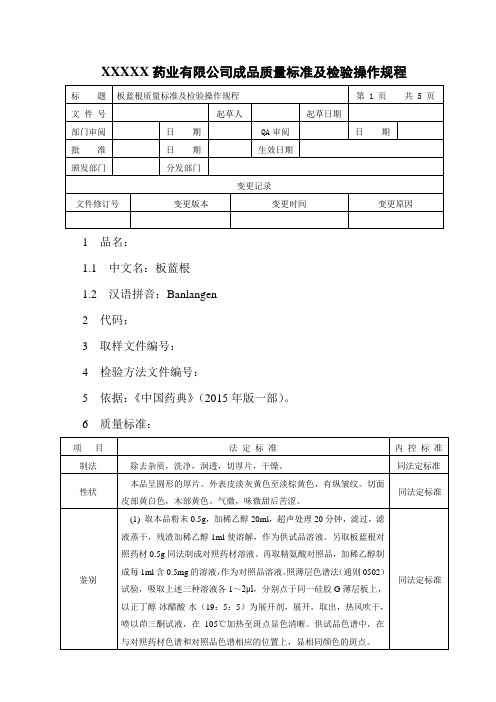
XXXXX药业有限公司成品质量标准及检验操作规程1 品名:1.1 中文名:板蓝根1.2 汉语拼音:Banlangen2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2015年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:稀乙醇、板蓝根对照药材、(R-S)-告依春对照品、甲醇、石油醚(60~90℃)、乙酸乙酯、盐酸、精氨酸对照品、羧甲基纤维素钠、正丁醇、冰醋酸、茚三酮试液、水、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2 仪器与用具:显微镜、电子天平、紫外光灯、超声波清洗器、水浴锅、硅胶G薄层板、硅胶GF254薄层板、烘箱、二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材0.5g 同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各1~2μl,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
7.4.2取本品粉末1g,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材1g同法制成对照药材溶液。
再取(R-S)-告依春对照品,加甲醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各5~10μl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-乙酸乙酯(1:1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
板蓝根冲剂颗粒生产工艺规程

目的:建立板蓝根颗粒的生产工艺规程。
范围:板蓝根颗粒的生产。
职责:生产管理部经理、质量管理部经理、车间主任、工艺员、班长、操作工、QA。
规程:1.品名、剂型与处方依据1.1通用名称:板蓝根颗粒汉语拼音:Banlangen chongji1.2剂型:颗粒剂1.3处方与处方依据项的说明1.3.1处方(共制成1000克)板蓝根 1400g (提取清膏1000g)蔗糖800g糊精520g乙醇(75%) 2000g1.3.2 处方依据项说明:药品的生产批文:国药准字H44024318批准时间:2003年1月24日质量标准编号:S-QC/C-074-002.生产工艺流程:↓↓↓↓↓→←←↓→↓ ←→ ↓一般生产区 三十万级生产区3.生产工艺操作与工艺技术参数中关键的注意事项: 3.1.操作过程与生产过程质量控制● 中药材按原辅料处理岗位标准操作规程采取拣选、剪选、刷擦等方法清除杂质或除去非药用部分,用饮用水对筛选后的药材漂洗。
● 按干燥岗位标准操作规程。
湿药材置于热风循环箱按热风循环干燥柜标准操作规程干燥,开启蒸汽阀、风机,箱内温度控制在75-80℃之间,干燥时限以生产100万克计算,约为2小时。
干燥过程中每两小时翻动一次。
收粒时水份应控制在3-5%范围内。
● 按工艺要求将药材切成2-3厘米的小段。
切制后的药材装洁净容器,贴标鉴注明名称、规格、批号、数量。
● 准确称取中药材置提取罐,加水煎煮2次,第一次2小时,第二次1小时,控制温度60-70℃,合并煎液。
●煎液过板框过滤器过滤,滤液置减压浓缩罐浓缩至适量,控制温度50℃,浓缩液在搅拌状态下加入乙醇,使含醇量为60%,静置12小时,沉淀用乙醇洗涤后过滤,滤液合并上清液中。
●浓缩罐内温度控制为80℃,上清液浓缩至相对密度为1.30-1.33的浸膏,装洁净容器,贴标鉴注明名称、规格、批号、数量、生产日期、操作者。
●车间化验室(中控室)按规定到中间站取浸膏进行检验,经测试,外观、含量、水份符合要求后即可进入下一工序。
板蓝根注射液药品标准

板蓝根注射液药品标准
板蓝根注射液是一种常用的中药注射液,主要成分是板蓝根提取物。
根据国家药典的规定,板蓝根注射液的药品标准包括以下方面:
1. 性状:板蓝根注射液应为棕黄色至深棕红色的澄清液体。
2. 含量测定:板蓝根注射液中板蓝根苷的含量不得低于5mg/
毫升。
3. pH值:板蓝根注射液的pH值应在
4.5-7.5范围内。
4. 质量浓度:板蓝根注射液中板蓝根苷和多糖的总质量浓度不得低于20mg/毫升。
5. 无菌要求:板蓝根注射液应满足无菌注射液的质量标准,不能含有细菌和真菌等微生物污染。
6. 稳定性:板蓝根注射液在规定条件下应具有一定的稳定性,不得有明显的物理化学变化。
另外,板蓝根注射液的生产管理应符合药品生产质量管理规范,确保药品的质量和安全性。
药品生产企业应严格按照相关法律法规的要求进行生产和销售。
板蓝根颗粒质量标准及检验操作规程
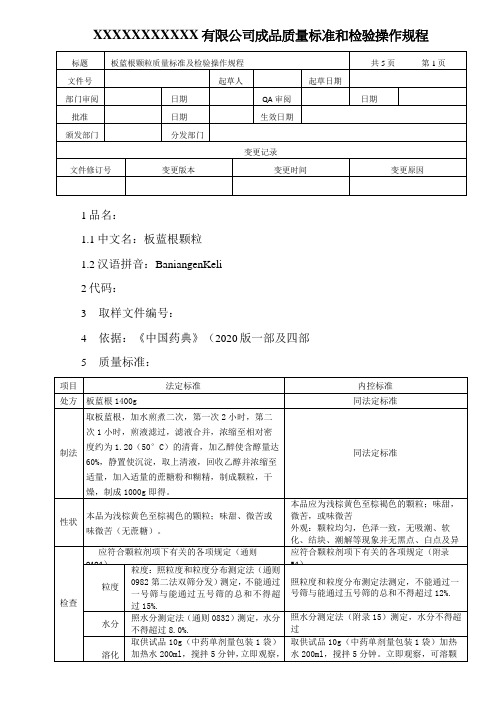
XXXXXXXXXXX 有限公司成品质量标准和检验操作规程1品名:1.1中文名:板蓝根颗粒 1.2汉语拼音:BaniangenKeli 2代码:3 取样文件编号:4依据:《中国药典》(2020版一部及四部 5 质量标准:6检验操作规程:6.1试药与试剂:十八烷基硅烷键合硅胶、甲醇、正丁醇、冰醋酸、水、茚三酮试液、板蓝根对照药材、L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品、尿苷对照品、鸟苷对照品及腺苷对照品。
6.2仪器与用具:电子天平、水浴锅、干燥箱、超声波清洗器、硅胶G薄层板。
6.3性状:取本品适量,在自然光下目测形态和色泽,尝味,并记录结果。
6.4鉴别:(1)取本品适量2g(相当于饮片2.8g),研细,加乙醇10ml,超声处理30分钟,滤过,滤液浓缩至2ml,作为供试品溶液。
另取板蓝根对照药材0.5g,加乙醉20ml,同法制成对照药材溶液,再取L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品,分别加乙醇制成每lml各含1mg的溶液,作为对照品溶液。
照薄层色谱法(通则0502)试验,吸取上述五种溶液各2〜5u l,分别点于同一硅胶G薄层板上,以正丁醇一冰醋酸一水(19:5:5)为展开剂,展开,取出,晾干,喷以茚三酮试液,在105r加热至斑点显色清晰,置日光下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
(2)取尿苷对照品、鸟苷对照品、(R,S)-告依春对照品及腺苷对照品,加5%甲醇制成每1ml含尿苷、鸟苷、(R,S)-告依春各20u g及腺苷25u g的混合溶液,作为对照品溶液,照<含量测定>项下的方法试验,吸取上述对照品溶液及<含量测定〉项下的供试品溶液各5-10u l,注入液相色谱仪,记录色谱图。
供试品色谱中,应呈现与对照品色谱峰保留时间相对应的色谱峰。
6.5检查:应符合颗粒剂项下有关的各项规定(附录54)。
6.6含量测定:6.6.1对照品溶液的制备取尿苷对照品、鸟苷对照品及腺苷对照品适量,精密称定,加5%甲醇制成每1ml含尿苷20u g,鸟苷20u g及腺苷25u g的混合溶液,即得。
8108-2板蓝根检验SOP1

目的:规范药材的检验操作方法及程序。
范围:板蓝根
责任:质检员
程序:
1性状
取本品,在光线明亮处观察其形状、大小、色泽、表面特征、断面、内外表面特征。
取少量鼻闻口尝确定其气味。
2鉴别
2.1取本品横切片,依法制作(附录ⅡC),置显微镜下观察。
2.2取本品水煎液,置紫外光灯(365nm)下观察。
2.3取本品粉末0.5g加稀乙醇20ml声处理20分钟滤过,滤液蒸干,残渣加稀乙醇1ml解,作为供试品溶液。
另取精氨酸对照品,加稀乙醇制成每1ml.含0.5mg 作为对照品溶液,照薄层色谱法(附录VI B)试验,吸取上述两种溶液各1~2µl 别点于同一以羧甲基纤维素钠为粘合剂的硅胶G薄层板上(自然干燥),以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
3.检查
3.1浸出物
3.1.1方法照醇溶性浸出物测定法项下的热浸法(附录XA)测定,用45%乙醇作溶剂。
板兰根标准操作规程第2页
3.1.2计算公式
(m3-m1)×100/25
醇溶物%= ×100%
m2
m1:皿重(g)
m2:取样重(g)
m3:皿+样重(g)
3.2水分取本品剪碎,按“水分测定标准操作程序第一法”测定。
板蓝根内控质量标准

制药GMP管理文件
一、目的:制定板蓝根的内控标准,规范公司板蓝根的采购与使用
二、适用范围:适用于板蓝根的采购与验收
三、责任者:生产部、检验员、仓库保管员
四、正文:
板蓝根
本品为十字花科植物菘蓝Isatis Indigotica Fort,的干燥根.秋季采挖,除去泥沙,晒干.
【性状】本品呈圆柱形,稍扭曲,长10~20㎝,直径0.5~1㎝.表面淡灰黄色或淡棕黄色,有纵皱纹、横长皮孔样突起及支根痕.根头略膨大,
可见暗绿色或暗棕色轮状排列的叶柄残基和密集的疣状突起.体
实,质略软,断面皮部黄白色,木部黄色.气微,味微甜后苦涩. 【鉴别】(1)本品横切面:木栓层为数列细胞.栓内层狭.韧皮部宽广,射线明显.形成层成环.木质部导管黄色,类圆形,直径约至
80um;有木纤维束。
薄壁细胞含淀粉粒。
(2)取本品粉末煎液,置紫外光灯(365nm)下观察,显蓝色荧光。
(3)取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,
滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
照
薄层色谱法试验,吸取上述两种溶液各1~2ul,分别点于同
一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上(自然干燥),
以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,
热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰.
供试品以谱中,在与对照品色谱相应的位置上,显相同颜色的
斑点.
【检查】水分照水分测定法测定,不得过15.0%.
【浸出物】照醇溶性浸出物测定法项下的热浸法测定,用45%乙醇作溶剂,不得少于25.0%.。
板蓝根颗粒执行标准

板蓝根颗粒执行标准板蓝根颗粒是一种常见的中药材,具有清热解毒、抗病毒、抗炎等功效,被广泛应用于临床治疗。
为了保证板蓝根颗粒的质量和安全性,制定了相应的执行标准,以规范其生产过程和质量要求。
一、原料要求。
1. 板蓝根颗粒的原料应选用新鲜、无霉变、无虫蛀、无霉斑、无异物的板蓝根为原料。
2. 原料应符合《中华人民共和国药典》规定的品质标准。
二、生产工艺。
1. 原料处理,应将板蓝根进行清洗、除杂、晾干等处理,确保原料的干净和安全。
2. 提取工艺,采用适当的提取剂和工艺条件,进行板蓝根的提取工艺,确保有效成分的提取率和质量。
3. 干燥工艺,采用适当的干燥工艺,确保板蓝根颗粒的水分符合要求,且不影响有效成分的稳定性。
三、质量指标。
1. 外观,板蓝根颗粒应呈现均匀的颗粒状,无结块、异物和霉变现象。
2. 含量测定,板蓝根颗粒中有效成分的含量应符合国家标准规定的范围。
3. 溶出度,板蓝根颗粒在规定条件下的溶出度应符合国家标准规定的范围。
4. 微生物限度,板蓝根颗粒中细菌总数、霉菌和酵母菌数、大肠杆菌和沙门氏菌均应符合国家标准规定的限度要求。
5. 重金属、有害元素限量,板蓝根颗粒中重金属和有害元素的含量应符合国家标准规定的限量要求。
四、包装和储存。
1. 包装,板蓝根颗粒应采用符合食品包装卫生标准的包装材料,包装应牢固、密封良好,防潮、防污染。
2. 标签,包装上应标注产品名称、规格、生产日期、保质期、生产企业名称、生产许可证编号等信息。
3. 储存,板蓝根颗粒应储存在阴凉、干燥、通风、无异味的环境中,远离有害气体和阳光直射。
五、执行标准依据。
1. 《中华人民共和国药典》。
2. 国家药品监督管理局颁布的相关法规和标准。
3. 国家食品药品监督管理局颁布的相关法规和标准。
六、结论。
板蓝根颗粒执行标准的制定,对于保障板蓝根颗粒的质量和安全性具有重要意义。
各生产企业应严格按照执行标准的要求进行生产,确保产品质量稳定、安全可靠,为广大患者提供优质的药品保障。
成品质量标准

目的:建立山香圆片的检验操作规程。
范围:山香圆片。
责任人:质保部。
内容:1.性状取本品,除去糖衣或薄膜衣后应显棕黑色;味苦、涩。
2.鉴别[鉴别] 取本品1片,除去糖衣或薄膜衣,研细,加水60 ml,煮沸5分钟,滤过,滤液通过装有50ml体积的聚酰胺住(直径2cm)约1小时,用水100ml 洗柱约30分钟,再用80%乙醇100ml洗脱约2小时,洗脱液蒸干残渣加甲醇5ml 使溶解,滤过,滤液蒸发至约0.5ml,作为供试品溶液。
另取山香圆叶对照药材3g,加水100ml,煎煮15分钟,滤过,同法制成对照药材溶液。
照薄层色谱法试验,吸取上述两种溶液各1~2ul,分别点于同一以羧甲基纤维素钠为粘合剂的硅胶G薄层板上,以醋酸乙酯一丙酮—甲酸一水(53:30:10:10)为展开剂展开。
取出,晾干,喷以1%三氯化铝乙醇溶液,晾干,置紫外光灯(365um)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的2~3个黄色荧光斑点。
3.检查:3.1重量差异(见附录2,片剂检验法)3.2崩解时限(见附录2,片剂检查法)3.3微生物限度检查(见附录1微生物限度检查法)目的:建立清火片检验操作规程。
范围:清火片。
责任人:质保部。
内容:1.性状取本品,除去糖衣或薄膜衣后,显棕褐色;味苦。
2.鉴别2.1取本品置显微镜下观察,应“草酸钙簇晶大,直径60~140um。
不规则片状结晶无色,有平直纹理。
2.2取本品少量,进行微量升华,升华物置显微镜下观察应呈不规则的无色片状结晶。
3.检查3.1重量差异(用于薄膜衣片,糖衣片不检此项)(见附录2,片剂检查法)3.2崩解时限(见附录2,片剂检查法)3微生物限度(见附录1,微生物限度检查法)目的:建立增效黄连素片检验操作规程。
范围:增效黄连素片。
责任人:质保部。
内容:1.性状本品就为糖衣片,除去糖衣后显黄色。
2.鉴别2.1取本品的细粉适量(约相当盐酸黄连素50mg),加水5ml,缓缓加热使盐酸黄连素溶解,滤过。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
天津市中升挑战生物科技有限公司GMP管理文件
一、目的:制定板蓝根注射液成品的内控质量标准,确保板蓝根注射液成品的质量。
二、依据:《兽药规范》1978版。
三、适用范围:适用于板蓝根注射液成品的生产和检验。
四、责任者:QC
五、正文:
板蓝根注射液
本品为板蓝根经提取制成的灭菌水溶液。
【制法】取板蓝根500g,加水煎煮二次,第一次2小时,第二次1小时,合并煎液,滤过,滤液浓缩至约750ml,冷却,加乙醇使含醇量达70%,搅匀,静置24小时,滤过,滤液回收乙醇至350~500ml,冷藏,滤过,滤液用氨试液调节pH值为8.0~8.5,搅匀,冷藏48小时,加热除去氨,加注射用水至900ml,冷藏,滤过,滤液用1%氢氧化钠溶液调节pH值为7.0~7.5,冷藏,滤过,滤液加甘露醇10g.并加注射用水调整总量至1000ml,滤过,灌封,灭菌,即得。
【性状】本品为棕黄色至棕色的澄明液体。
【鉴别】取本品作为供试品溶液。
另取板蓝根对照药材1g,加乙醇30ml,超声处理15分钟,滤过,滤液浓缩至约0.5ml,作为对照药材溶液。
再取L-脯氨酸对照品,加80%乙醇制成每1ml含2mg的溶液,作为对照品溶液,照薄层色谱法(附录Ⅵ B)试验,吸取上述三种溶液各2μl,分别点于同一硅胶G薄层板上,以正丁醇-水-冰醋酸(4:1:1)为展开剂,展开,取出,晾干,喷以0.2%茚三酮乙醇溶液,在105℃加热至斑点显色清晰。
供试品色谱中,分别在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
【检查】pH值应为5.0~6.5(附录Ⅶ G)。
炽灼残渣取本品5ml,置已炽灼至恒重的坩埚中,置水浴上蒸干后,依法检查(附录Ⅸ J),遗留残渣不得过1.0%。
重金属取炽灼残渣项下遗留的残渣,依法检查(附录Ⅸ E第一法),含重金属不得过百万分之十。
其他应符合注射剂项下有关的各项规定(附录Ⅰ U)。
【含量测定】取本品,用适宜的氨基酸分析仪进行分离测定,另取L-脯氨酸、L-精氨酸、L-缬氨酸、L-γ-氨基丁酸、L-丙氨酸、L-亮氨酸、L-异亮氨酸、L-苯丙氨酸、L-丝氨酸、L-苏氨酸、L-酪氨酸对照品,制成相应浓度的对照品溶液,同法测定,按外标法的峰面积计算各种氨基酸的含量,并计算出总氨基酸的含量。
本品每1ml含总氨基酸不得少于1.2mg。
【功能与主治】清热解毒,凉血利咽,消肿。
用于扁桃腺炎、腮腺炎、咽喉肿痛、防治传染性肝炎、小儿麻疹等。
【用法与用量】肌内注射,一次2ml,一日1次。
【规格】每支装2ml
【贮藏】密封,避光。
