02-×××胶囊质量标准及内控标准
心脑康胶囊内控标准
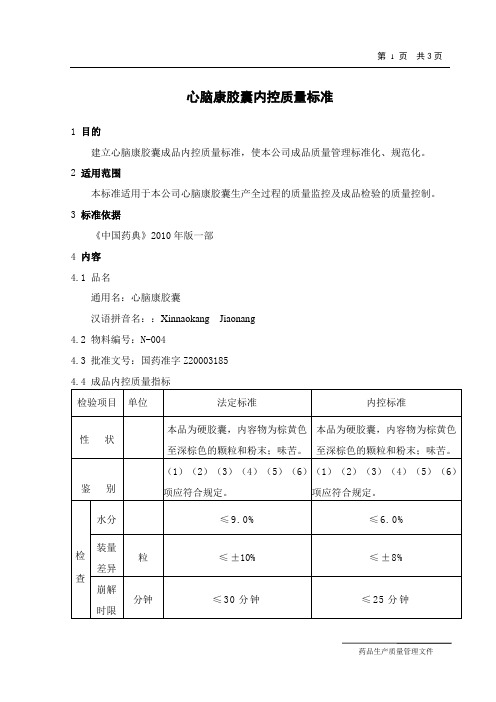
第1页共3页心脑康胶囊内控质量标准1 目的建立心脑康胶囊成品内控质量标准,使本公司成品质量管理标准化、规范化。
2 适用范围本标准适用于本公司心脑康胶囊生产全过程的质量监控及成品检验的质量控制。
3 标准依据《中国药典》2010年版一部4 内容4.1 品名通用名:心脑康胶囊汉语拼音名::Xinnaokang Jiaonang4.2 物料编号:N-0044.3 批准文号:国药准字Z200031854.4 成品内控质量指标检验项目单位法定标准内控标准性状本品为硬胶囊,内容物为棕黄色至深棕色的颗粒和粉末;味苦。
本品为硬胶囊,内容物为棕黄色至深棕色的颗粒和粉末;味苦。
鉴别(1)(2)(3)(4)(5)(6)项应符合规定。
(1)(2)(3)(4)(5)(6)项应符合规定。
检查水分≤9.0% ≤6.0% 装量差异粒≤±10% ≤±8% 崩解时限分钟≤30分钟≤25分钟Q/TJT-1108N·003-04 心脑康胶囊内控质量标准第 2 页共3页微生物限度检查cfu/g细菌数:≤10000cfu/g霉菌和酵母菌数:≤100cfu/g大肠菌群:小于100cfu/g大肠埃希菌:不得检出沙门菌:不得检出活螨:不得检出细菌数:≤3000cfu/g霉菌和酵母菌数:≤50cfu/g大肠菌群:小于10cfu/g大肠埃希菌:不得检出沙门菌:不得检出活螨:不得检出含量测定粒本品每粒含赤芍以芍药苷(C23H28O11)计,不得少于0.35mg。
本品每粒含赤芍以芍药苷(C23H28O11)计,不得少于0.42mg。
成品外观检查件应符合胶囊剂成品外观质量企业标准4.5功能主治:活血化瘀,通窍止痛。
用于瘀血阻络所致的胸痹、眩晕,症见胸闷、心前区刺痛、眩晕、头痛;冠心病、心绞痛、脑动脉硬化见上述证候者。
4.6 贮藏:密封。
4.7 包装规格:每粒装0.25g。
4.8 包装:铝塑包装,瓶装。
4.9检验操作规程照成品检验操作规程执行。
软胶囊质量标准

软胶囊的质量标准通常包括以下几个方面:
1. 感官要求:软胶囊外观应整洁,不得有粘结、变形、渗漏或囊壳破裂现象。
软胶囊的颜色、透明度等应符合规定,且应有特有的气味和滋味。
2. 药物成分及含量:软胶囊应含有规定的药物成分,且每颗软胶囊中药物成分的含量应符合规定,通常以毫克(mg)为单位。
3. 理化性质:软胶囊的理化指标应符合相关标准,如铅、砷、汞等重金属的含量应不超过规定限值。
软胶囊中油脂成分的含量也应符合规定。
4. 微生物指标:软胶囊的微生物指标应符合相关标准,如菌落总数和大肠菌群等应符合规定。
5. 生产过程控制:软胶囊的生产过程应严格控制,如填充重量等应符合要求。
同时,软胶囊的储存和运输也应符合相关规定,以保证其质量稳定。
总之,软胶囊的质量标准是多方面的,包括感官要求、药物成分及含量、理化性质、微生物指标以及生产过程控制等。
这些标准旨在确保软胶囊的质量和安全性,从而保障患者的用药安全。
胶囊质量标准

胶囊质量标准胶囊是一种常见的药物剂型,广泛应用于药物制剂中。
胶囊的质量标准对于药物的安全性和有效性至关重要。
在制定和执行胶囊质量标准时,需要考虑到胶囊的物理性质、化学性质、生物性质以及微生物污染等方面,以确保胶囊的质量符合国家标准和药典规定。
首先,胶囊的物理性质是评定其质量的重要指标之一。
物理性质包括外观、尺寸、均匀度等。
外观应该清晰、无瑕疵、无异物,颜色应一致。
胶囊的尺寸应符合规定的要求,大小、长度、直径应在一定范围内,以保证药物的稳定性和服用的便利性。
此外,胶囊应该具有良好的均匀度,即药物在胶囊内的分布应均匀,避免因为药物分布不均导致用药效果不一致。
其次,胶囊的化学性质也是评定其质量的重要指标之一。
化学性质包括原料药的纯度、稳定性、溶解度等。
原料药的纯度应符合国家药典规定,不得含有杂质,以保证药物的纯度和安全性。
稳定性是指胶囊在储存和使用过程中不易发生化学变化,保持药物的有效成分和药效。
溶解度是指胶囊在体内的溶解速度和程度,影响药物的吸收和药效。
此外,胶囊的生物性质也是评定其质量的重要指标之一。
生物性质包括药物的生物利用度、生物分布、生物转化等。
药物的生物利用度是指药物在体内的吸收速度和程度,直接影响药物的有效性。
生物分布是指药物在体内的分布情况,包括组织分布和血浆蛋白结合情况等。
生物转化是指药物在体内经过代谢转化的过程,影响药物的代谢和排泄。
最后,胶囊的微生物污染也是评定其质量的重要指标之一。
微生物污染可能导致药物的变质和感染,对人体健康造成危害。
因此,胶囊的微生物污染必须符合国家标准和药典规定,严格控制微生物的种类和数量,确保胶囊的无菌性和安全性。
综上所述,胶囊的质量标准涉及物理性质、化学性质、生物性质和微生物污染等多个方面,需要严格执行国家标准和药典规定,确保胶囊的质量符合要求,保障药物的安全性和有效性。
只有通过严格的质量控制和检验,才能生产出符合质量标准的胶囊产品,为人们的健康提供保障。
GMP认证全套文件资料008-××××胶囊质量标准及内控标准

技术标准----质量管理文件名称诺氟沙星胶囊质量标准及内控标准编码TS-ZL-008-00页数4-1 实施日期制订人审核人批准人制订日期审核日期批准日期制订部门质管部分发部门生产部、供应部、检验室、成品仓目的:制订诺氟沙星胶囊质量标准及内控标准。
适用范围:诺氟沙星胶囊质量标准及内控标准。
责任:检验室、生产车间及成品仓执行该标准,质管部负责监督该标准的执行。
标准:1.标准依据:《中华人民共和国药典》2000版二部2.批准文号:&卫药准字(1996)第507063号3.处方:3.1来源:本厂3.2依据:《中华人民共和国药典》2000版二部。
3.3处方:诺氟沙星100g 淀粉112g微晶纤维素50g 15%预胶化淀粉浆124g羧甲淀粉钠8.4g 硬脂酸镁 1.6g共制成1000粒3.4剂型:硬胶囊剂3.5包装规格:0.1g/粒10粒×800盒/箱20粒×300瓶/箱10粒×50板×40盒/箱10粒×5板×160盒/箱4.法定质量标准及内控标准4.1法定质量标准文件名称诺氟沙星胶囊质量标准及内控标准编码TS-ZL-008-00页数4-2项目法定质量标准标准依据性状胶囊剂、内容物为白色至淡黄色粉末中国药典2000年版二部鉴别应符合规定中国药典2000年版二部装量差异应符合规定中国药典2000年版二部溶出度Q≥75% 中国药典2000年版二部含量测定应为标示量的90.0%~110.0%中国药典2000年版二部微生物限度检查细菌总数不得过1000个,霉菌、酵母菌数不得过100个控制菌不得检出中国药典2000年版二部4.2内控质量标准4.2.1外观质量标准及质量控制方法项目外观质量标准质量控制方法整体外观整洁、2号胶囊大小相等、长短一致、无斑点车间质管员在线监控,检验室成品抽样检查。
色泽蓝白胶囊,颜色均匀一致,无褪色、无变色粘连、发霉、变形、异臭不得有砂眼、虫眼、破裂、漏药不得有内容物结块、霉变不得有4.2.2.内在质量标准及检验方法项目质量标准检验方法性状胶囊剂,内容物为白色至淡黄色粉末诺氟沙星胶囊成品检验标准操作规程鉴别应符合规定重量差异应符合规定溶出度Q≥80%含量测定应为标示量的94.0%~107.0% 4.2.3卫生学标准及测定方法文件名称诺氟沙星胶囊质量标准及内控标准编码TS-ZL-008-00页数4-3项目卫生学标准测定方法微生物限度检查细菌总数不得过1000个霉菌、酵母菌数不得过100个控制菌不得检出微生物限度检查标准操作规程5.包装品的质量标准。
胶囊剂质量要求与检查

胶囊剂质量要求与检查
1.外观胶囊外观应整洁,不得有粘结、变形或破裂现象,并应无异臭。
硬胶囊剂的内容物应干燥、松紧适度、混合均匀。
2.水分硬胶囊剂内容物的水分,除另有规定外,不得超出9.0%。
3.装量差异每粒装量与平均装量相比较,超出装量差异限度的不得多于2粒,并不得有一粒超出限度一倍(平均装量为0.3g 以下,装量差异限度为±10.0%;0.3g或0.3g以上,装量差异限度为±7.5%)。
环球网校
4.崩解度与溶出度胶囊剂作为一种固体制剂,通常应作崩解度、溶出度或释放
度检查,除另有规定外,应符合规定。
凡规定检查溶出度或释放度的胶囊不再检查崩解度。
硬胶囊剂或软胶囊剂,除另有规定外,取供试品6粒检查。
硬胶囊剂应在30分钟内、软胶囊剂应在1小时内全部崩解并通过筛网(囊壳碎片除外)。
肠溶胶囊剂,除另有规定外,取供试品6粒检查。
先在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象;再在磷酸盐缓冲液(pH6.8)中进行检查,1小时内应全部崩解并通过筛网(囊壳碎片除外)。
5.定性定量定量
6.卫生学检查
7.应密封贮存。
021-胶囊充填过程的中间质量控制标准操作规程

目的:制订胶囊充填过程的中间质量控制标准操作规程。
加强中间产品质量控制。
适用范围:胶囊充填过程的中间质量控制。
责任:胶囊充填操作人员、质管员执行本规程,质管部对本规程的有效执行承担监督、检查责任。
程序:1.试充填过程的质量控制,在充填开始时,操作工首先须进行下列试验:1.1从不同部位中抽取空囊50粒称总重,得囊壳的平均重量,若使用了不止一批的囊壳,则应分别取样称重;1.2按《硬胶囊剂外观检查标准操作规程》(SOP-SJ-029-00)检查空心胶囊的外观。
1.3按《胶囊平均装量和装量差异的测定标准操作规程》(SOP-SJ-024-00)检查胶囊平均装量和装量差异。
1.4按《胶囊崩解时限的检查标准操作规程》(SOP-SJ-027-00)检查胶囊崩解时限。
在记录表《胶囊充填过程质量监控记录》(REC-SJ-022-00)上记下结果。
待试验合格后,通知质检员重复同样试验。
若测试结果符合要求,则可正式灌装,否则须对灌装机进行调整并重复上述试验。
2.灌装过程中的质量控制2.1操作工取样检查在灌装过程中,每15分钟检查一次平均灌装量。
——按规定装量控制。
——在表上写上品名、批号、空胶囊重量等。
从灌装机出口取10粒胶囊,一起称重,并在表上记录重量差异,称重后的胶囊应废弃。
如果称重的结果超出控制范围,经质管员重新取样复查确实超出规定范围时,应立即停机进行调整并在收集容器上贴上“待处理品”标签。
若在灌装过程中对灌装机作了调整上,调整后必须重复称重检查,并将结果记录在生产记录上。
2.2由质管员作的试验:质管员在灌装的开始、中间、结束阶段至少取5次样品,每次至少抽取10粒胶囊。
按上述的控制项目对胶囊进行检测,所有检查中发现的问题和试验的结果均记录在《胶囊填充过程质量监控记录》(REC-SJ-022-00)中。
3.不合格的质量:任何不合格的质量情况都须通知操作工、工艺员和质管部。
4.报告:灌装完成后,所有的质量控制记录纳入批记录中。
XX软胶囊质量标准样本
XX软胶囊质量标准样本引言XX软胶囊是一种常见的药物剂型,广泛用于药物输送和治疗。
为了确保XX软胶囊的质量和平安性,需要制定相应的质量标准样本。
本文档旨在介绍XX软胶囊质量标准样本的制定方法和要求。
1. 目的本文档的目的是为制定XX软胶囊质量标准样本提供指导,确保该样本能够准确、全面地评估XX软胶囊的质量。
2. 样本制定方法XX软胶囊质量标准样本的制定需要考虑以下因素:2.1 适用范围确定XX软胶囊质量标准样本的适用范围,包括适用的药物成分、剂型要求和适用的生产工艺等。
2.2 抽样方法选择适宜的抽样方法,保证XX软胶囊质量标准样本的代表性。
常用的抽样方法包括随机抽样和分层抽样等。
2.3 样本数量确定XX软胶囊质量标准样本的数量,需要考虑样本的代表性和统计学要求。
样本数量应足够大,以确保对XX软胶囊质量的全面评估。
2.4 样本来源选择适宜的样本来源,例如从正常生产中抽取样本或者向相关单位采购样本。
样本来源应能够代表XX软胶囊的生产过程和质量水平。
2.5 样本保存制定适宜的样本保存方法,确保样本的稳定性和完整性。
样本保存的条件和期限应符合相关的药品质量管理规定。
3. XX软胶囊质量标准样本的要求XX软胶囊质量标准样本应满足以下要求:3.1 药物成分的含量XX软胶囊质量标准样本需要对药物成分的含量进行检测,确保符合规定的标准。
通常使用高效液相色谱法〔HPLC〕或气相色谱法〔GC〕进行检测。
3.2 物理性质对于XX软胶囊,物理性质包括外观、尺寸、包衣厚度等。
质量标准样本应对这些物理性质进行评估,确保符合规定的要求。
3.3 质量控制参数质量控制参数包括溶解度、溶出度、稳定性等。
质量标准样本需要对这些参数进行检测和评估,以确保XX软胶囊的质量控制在可接受范围内。
3.4 杂质和微生物检测对于XX软胶囊,需要检测其中的杂质和微生物污染情况。
质量标准样本应包括这些检测工程,确保符合相关的药品质量标准和规定。
4. 结论XX软胶囊质量标准样本的制定需要充分考虑适用范围、抽样方法、样本数量、样本来源和样本保存等因素。
胶囊质量标准
胶囊质量标准
胶囊是一种常见的药物剂型,广泛应用于药品、保健品等领域。
胶囊的质量标准直接关系到药品的安全性和有效性,因此制定和遵
守胶囊质量标准至关重要。
首先,胶囊的外观质量是评价其质量的重要指标之一。
合格的
胶囊应该外观整齐,无明显变形、破损或污染。
胶囊的颜色、透明
度和光泽也应符合标准要求,不能出现异常情况。
其次,胶囊的成分和含量应符合规定的标准。
药品胶囊的原料
药应符合药典规定,并经过严格的检验和质量控制。
胶囊内所含药
物的含量应符合生产工艺要求,不能出现偏差过大的情况,以确保
药效的稳定性和一致性。
此外,胶囊的溶解性和释放性也是评价其质量的重要指标。
胶
囊在体内的释放行为直接关系到药物的吸收和疗效,因此其溶解性
和释放性必须符合规定的标准要求,以确保药效的发挥。
另外,胶囊的微生物限度和重金属残留也是评价其质量的重要
指标之一。
微生物限度的合格标准能够反映出胶囊生产过程中的卫
生状况和质量控制水平,而重金属残留则直接关系到药品的安全性,必须符合国家规定的限量要求。
最后,胶囊的包装质量也是不可忽视的一部分。
胶囊的包装材
料应符合药品包装的相关标准,能够保护胶囊不受外界环境的影响,确保其质量稳定。
总之,胶囊作为一种重要的药物剂型,其质量标准的制定和遵
守对于保障药品的质量和安全至关重要。
各生产企业应严格按照国
家相关标准执行,加强质量管理,确保胶囊质量符合标准要求,为
人们的健康提供更可靠的保障。
胶囊质量标准
胶囊质量标准胶囊是一种常见的药剂形式,具有便携、易于服用的特点,广泛应用于医药领域。
为了确保药品的质量和安全性,制定了一系列胶囊质量标准。
本文将就胶囊质量标准进行探讨,从胶囊外观、尺寸、容量、填充物、密封性等方面进行讨论。
一、胶囊外观胶囊外观是判断胶囊质量的首要指标之一。
合格的胶囊应具备以下特征:1.无明显的异物或杂质,如无色斑点、漆膜破损、凹凸等现象;2.胶囊的色泽均匀,无色差;3.不能有异味和刺激性气味。
二、胶囊尺寸胶囊的尺寸一般根据药物的用量来确定,因此合格的胶囊尺寸应符合以下要求:1.胶囊尺寸应与所含药物的剂量相对应,不得超过药物的包装说明;2.胶囊的长度和内径应稳定,不得存在较大的尺寸误差;3.盖帽和底盘的尺寸应与胶囊身体相符合,不能有明显的不合适情况。
三、胶囊容量胶囊的容量指的是胶囊所能容纳的药物的总量。
为了确保药物的准确剂量,胶囊容量需符合以下要求:1.胶囊的容量应与标识的容量一致,不得存在较大的误差;2.胶囊的容量应稳定,不受温度和湿度的影响;3.容量误差应在规定范围内,一般不得超过1%。
四、胶囊填充物胶囊的填充物也是衡量胶囊质量的重要标准之一。
合格的填充物应具备以下特征:1.填充物应与药物兼容,并能保证药物的稳定性;2.填充物应具备良好的流动性,易于填充进胶囊中;3.填充物应具有一定的可溶性和可吸湿性,以保证药物的释放速度。
五、胶囊密封性胶囊的密封性是确保胶囊中药物的保存和药效的重要指标。
合格的胶囊密封性应满足以下条件:1.胶囊的封口应完好,无破损或脱落现象;2.胶囊封口处应无明显的胶囊毛刺;3.胶囊应具备一定的抗潮湿性,能够有效防止水分的侵入。
六、其他质量标准除以上几个方面的质量标准外,胶囊的生产还需符合以下要求:1.胶囊的材质应符合相关药典的要求,不得使用有害物质;2.胶囊的生产过程应符合GMP标准,生产场所应符合卫生要求;3.胶囊的包装应符合药品的包装要求,保证产品的完整性。
胶囊质量标准
胶囊质量标准一、原料1.1 胶囊的原料应符合相关法规和标准,来源合法且质量稳定。
1.2 胶囊的原料应具有相应的检验报告和合格证明,以确保其质量和安全性。
二、胶囊壳2.1 胶囊壳的材料应为食用级明胶,且符合相关法规和标准。
2.2 胶囊壳的颜色应均匀,表面光滑,无明显瑕疵和变形。
2.3 胶囊壳的厚度应适中,且具有足够的强度和韧性,以保证填充和运输过程中的安全性。
三、内容物3.1 胶囊的内容物应符合相关法规和标准,质量稳定且对人体无害。
3.2 胶囊的内容物应具有良好的流动性,以便于填充和计量。
3.3 胶囊的内容物不应与胶囊壳发生化学反应或产生有害物质。
四、胶囊填充4.1 胶囊填充应保证内容物量的准确性,误差应在规定范围内。
4.2 填充过程中应避免污染和交叉污染,确保产品的卫生质量。
4.3 填充完成后,应对胶囊进行质量检查,确保其完整性、美观性和功能性。
五、胶囊密封性5.1 胶囊的密封性应符合相关法规和标准,确保其在使用过程中不漏药、不变质。
5.2 胶囊的密封性检验应包括压力测试、渗透测试等项目,以确保其满足使用要求。
六、胶囊标识6.1 胶囊的标识应清晰、易读,包括产品名称、生产日期、有效期、生产批号、使用方法等信息。
6.2 标识应采用合适的材料和颜色,以突出显示重要信息,避免误导消费者。
七、稳定性7.1 胶囊应具有良好的稳定性,确保在正常储存和使用条件下不发生变质或性能下降。
7.2 稳定性测试应包括加速老化试验、温度湿度试验等项目,以评估胶囊的质量和可靠性。
八、安全性8.1 胶囊应符合食品安全性标准,无毒无害,不含有对人体健康造成危害的物质。
8.2 安全性测试应包括急性毒性试验、慢性毒性试验、致畸致突变试验等项目,以确保产品的安全性和可靠性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目的:制订盐酸雷尼替丁胶囊质量标准及内控标准。
适用范围:盐酸雷尼替丁胶囊质量标准及内控标准。
责任:检验室、生产车间及成品仓执行该标准,质管部负责监督该标准的执行。
标准:
1.标准依据:《中华人民共和国药典》2000版二部
2.批准文号:*卫药准字(1996)第507030号
3.处方:
3.1来源:本厂
3.2依据:《中华人民共和国药典》2000版二部。
3.3处方:
盐酸雷尼替丁150g 滑石粉51g
磷酸氢钙57g 75%乙醇21g
二氧化硅 2.775g
共制成1000粒
3.4剂型:硬胶囊剂
3.5包装规格:0.15g 20粒×300瓶/箱
30粒×200瓶/箱
4法定质量标准及内控标准
4.1法定质量标准
4.2内控质量标准
4.2.2内在质量标准及检验方法
4.2.3卫生学标准及测定方法
5包装品的质量标准。
5.1固体药用聚烯烃塑料瓶:YY0057-91《固体药用聚烯烃塑料瓶》质量标准。
5.2药用填充纸:YY0236与GB9687-84《药用填充纸》质量标准。
5.3标签:厂内控标签质量标准。
5.4空心胶囊:GB13731-92《药用明胶硬胶囊》质量标准。
6.5小盒、中盒:厂内控小盒、中盒质量标准。
5.5纸箱:厂内控纸箱质量标准。
6取样规定
6.1外观质量检查
6.1.1车间质管员在线监控,厂部质管员在包装线抽样及在成品仓抽样检查。
6.1.2质检员在包装线抽样应至少抽检20瓶(小盒)及已包装好两件,在成品仓抽样应不少于三件。
6.2内在质量检查
6.2.1内在质量由质管部实行在包装线抽样,定期在成品仓抽样检查。
6.2.2质检员在包装线抽样20瓶,成品仓抽样20瓶,如不合格,应重新抽样,数量加倍。
6.2.3质检员在取样过程中,应按照《取样操作规程》执行。
6.3卫生学检查
6.3.1卫生学检查由质管部在包装线抽样检查,定期在成品仓抽样检查。
6.3.2质检员在包装线抽样2瓶,成品仓抽样2瓶,如不合格,应重新抽样,数量加倍、同时做2个样。
6.3.3质检员在取样过程、应按照《取样操作规程》执行。
7.贮存条件及注意事项:
密封保存。
8.使用期:2年。
9.标签、使用说明书:产品合格证,封口证标准样张附后。
