【配套K12】2019年高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习
2019年高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习
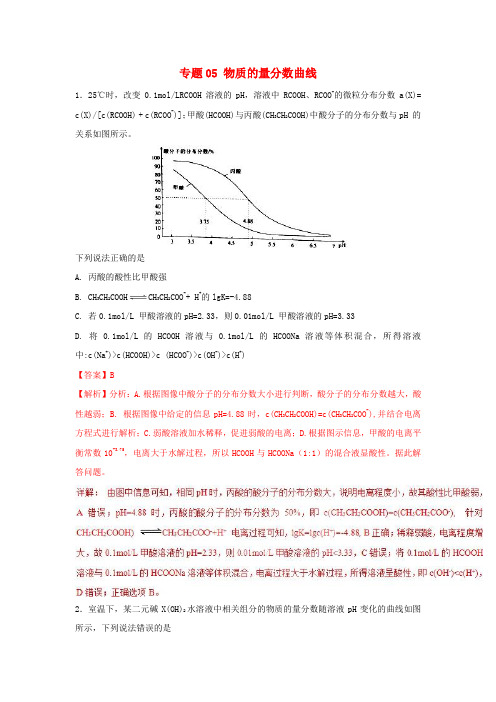
专题05 物质的量分数曲线1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。
下列说法正确的是A. 丙酸的酸性比甲酸强B. CH3CH2COOH CH3CH2COO-+ H+的lgK=-4.88C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)【答案】B【解析】分析:A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B. 根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3.75,电离大于水解过程,所以HCOOH与HCOONa(1:1)的混合液显酸性。
据此解答问题。
2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是A. K b2的数量级为10-8B. X(OH)NO3水溶液显碱性C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)【答案】C【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。
详解:A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以K b2=,选项A正确。
推荐学习K122019年高考化学一轮复习 酸碱中和滴定曲线大全 专题10 酸滴定碱的曲线练习

专题10 酸滴定碱的曲线1.常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-1g(OH-)变化的关系如图所示。
下列叙述错误的是A. 反应N2H62++N2H4=2N2H5+的pK=90(已知pK=lgK)B. N2H5Cl溶液中存在:c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)C. N2H5Cl溶液中c(H+)>c(OH-)D. K b1(N2H4)=10-6【答案】A2.某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。
向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是A. 交点a处对应加入的盐酸溶液的体积为5mLB. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B (OH)+)>c(H+)>c(OH-)>c(B2+)C. 交点b处c(OH)=6.4×10-5D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),【答案】C【解析】图中曲线①B(OH)2,②为B(OH)+③为B2+;交点a处对应加入的盐酸溶液的体积为5mL时,反应生成等浓度的B(OH)Cl和B(OH)2混合液,由于两种溶质水解电离能力不同,所以B(OH)2、B(OH)+浓度分数δ不相等,A错误;当加入的盐酸溶液的体积为10mL时,溶液为B(OH)Cl,溶液显酸性,根据B(OH)2(K1=5.9×10-2、K2=6.4×10-5)可知,c(Cl-)>c(B(OH)+)>c(H+)> c(B2+)>c(OH-),B错误;交点b处时,c(B(OH)+)= c(B2+),根据B(OH)+ B2++ OH-,K2= c(OH-)=6.4×10-5, C正确;当加入的盐酸溶液的体积为15mL时,生成等体积等浓度B(OH)Cl和BCl2的混合液,存在电荷守恒为c(Cl-)+c(OH-)= 2c(B2+)+c(B(OH)+)+ c(H+),D错误;正确选项C。
2019年高考化学一轮复习 酸碱中和滴定曲线大全 专题01 强碱滴定二元弱酸曲线练习

专题01 强碱滴定二元弱酸曲线1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是( )A. H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H +)>c(OH-)【答案】C2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH 溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是A. A点所得溶液中:V o等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中水解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为K a1=c(H+)c(HSO3−)/c(H2SO3)=10-1.85mol/L,所以c(H+)=K a1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),B正确;C.H2SO3的二级电离平衡常数为K a2=c(H+)c(SO32-)/c(HSO3−)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=K a2,表明溶液中c(SO32-)=c(HSO3−),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3−),C正确;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则K h1=K w/K a2=10−14/10−7.19=10-6.81,D正确。
高三化学上学期第一轮复习酸碱中和滴定(PPT)5-3

(2)溶液使指示剂改变颜色,发生的化学变 化。指示剂滴加太多比将消耗一部分酸碱溶液 (一般为1~2滴)。
一、酸碱中和滴定
1、定义:用已知物质的量的浓度的酸(或碱)来测定 未知浓度的碱(或酸)的方法
2、原理:在酸碱中和反应中,使用一种已知物质的量 浓度的酸或碱溶液跟未知浓度的碱或酸溶液完全中和, 测出二者的体积,根据化学方程式中酸和碱的物质的量 的比值,就可以计算出碱或酸的溶液浓度。
“恰好完全反应”与“溶液呈中性”两句话的区别
HCl + NH3·H2O = NH4Cl + H2O 1mol 1mol 1mol
恰好完全反应,PH≠7
溶液呈中性,碱肯定过量
【兵燹】ī〈书〉名战争造成的焚烧破坏等灾害:藏书毁于~。 【兵饷】ī名军饷。 【兵役】ī名指当兵的义务:服~。 【兵役法】ī名国家根据宪法规定公民服兵役的法律。 【兵营】ī名军队居住的营房。 【兵勇】ī名旧指士兵。 【兵 油子】ī?名旧时指久在行伍而油滑的兵。 【兵员】ī名兵;战士?(总称):补充~|五十万~。 【兵源】ī名士兵;收藏加购 https:/// 收藏加购;的来源:~充足。 【兵灾】ī名战乱带来的灾难。 【兵站】ī 名军队在后方交通线上设置的供应、转运机构,主要负责补给物资、接收伤病员、接待过往部队等。 【兵种】ī名军种内部的分类,如步兵、炮兵、装甲兵、工程兵等是陆军的各兵种。 【兵卒】ī名士兵的旧称。 【屏】ī[屏营](ī) 〈书〉形惶恐的样子(多用于奏章、书札):不胜~待命之至。 【栟】ī[栟榈](īǘ)名古书上指棕榈。 【槟】(檳、梹)ī[槟榔](ī?)名①常绿乔木,树干很高,羽状复叶。果实可以吃,也供用。生长在热带地方。②这种植 物的果实。 【丙】①名天干的第三位。参看页〖干支〗。②〈书〉丙丁:阅后付~。③()名姓。 【丙部】名子部。 【丙丁】ī〈书〉名火的代称:付~。 【丙纶】名合成纤维的一种,质轻,耐磨,吸湿性和染色性差,制成的衣物 不易走样。工业上用来制造绳索、滤布、渔网等。 【邴】名姓。 【秉】①〈书〉拿着;握着:~笔|~烛。②〈书〉掌握;主持:~政。③量古代容量单位,合斛。④()名姓。 【秉承】(禀承)动承受;接受(旨意或指示)。
2019年高考化学一轮:第3讲-物质的量与化学计算(含答案) PPT 课件

化学 ·2019年高考一轮复习
第3讲 物质的量与化学计算
考试说明 1.了解溶液的含义。2.了解溶解度、饱和溶液的概 解溶液浓度的表示方法。理解溶液中溶质的质量分数 量浓度的概念,并能进行有关计算。4.掌握配制一定溶 数溶液和物质的量浓度溶液的方法。
知识梳理 在每年的化学高考试题中,计算题的分值大约要占 每年的高考试卷抽样分析报告中经常会说计算题的得分 高考化学中计算类型比较多,其中有些计算类型经常考 方法,掌握技巧,一定能达到节约时间,提高答题的正 谈一谈解答计算的一些巧解和方法。主要有:估算法、 法、十字交叉法、平均法、极值法、关系式法、等量代
【例4】已知氧化剂XO(OH)2+被Na2SO3还原到低价。如
2.4×10-3mol XO(OH)2+的溶液,需30mL0.2 mol/L 的Na2
X元素的最终价态为
( C)
A.+2 B.+1 C.0 D.+3
【例5】将纯铁丝5.21克溶于过量稀盐酸中,在加热条件
克KNO3去氧化溶液中亚铁离子,待反应后剩余的Fe2+离 12mL0.3mol/LKMnO4溶液才能完全氧化,写出硝酸钾和 全反应的方程式 KNO3+3FeCl2+4HCl=3FeCl3+KCl+NO
近年高考化学总复习第一章化学计量在实验中的应用——物质的量1-1-1考点一物质的量摩尔质量学后即练

2019高考化学总复习第一章化学计量在实验中的应用——物质的量1-1-1 考点一物质的量摩尔质量学后即练新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习第一章化学计量在实验中的应用——物质的量1-1-1 考点一物质的量摩尔质量学后即练新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习第一章化学计量在实验中的应用——物质的量1-1-1 考点一物质的量摩尔质量学后即练新人教版的全部内容。
1-1-1 考点一物质的量摩尔质量1.设N A表示阿伏加德罗常数的值,下列说法正确的是( )A.含N A个N2分子和O2分子的混合气体中质子数不可能是15N AB.1 L 1 mol·L-1的CH3COONa溶液中CH3COOH和CH3COO-的总数为N AC.58 g分子式为C4H10的有机物中,所含有的甲基数一定为2N AD.N A个CH4分子和N A个Cl2分子在光照下充分反应,被取代的氢原子数为2N A解析:N A个N2分子中含有14N A个质子,N A个O2分子中含有16N A个质子,根据平均值规律,含N A个N2分子和O2分子的混合气体中质子数可能是15N A,A 项错误。
根据物料守恒可知B项正确.C4H10的结构可能是CH3CH2CH2CH3或CH (CH3)3,58 g分子式为C4H10的有机物中,所含有的甲基数介于2N A~3N A之间,C 项错误。
N A个CH4分子和N A个Cl2分子在光照下充分反应,被取代的氢原子个数为N A,D项错误。
答案:B2.设N A表示阿伏加德罗常数的值,N表示粒子数.下列叙述正确的是( )A.将CO2通过Na2O2使其增重a g时,反应中转移电子数为错误!B.将1 mol Cl2通入水中,则N(HClO)+N(Cl-)+N(ClO-)=2N AC.2.24 L CH4中含有的C—H键数为0。
配套K122019年高考化学一轮复习酸碱中和滴定曲线大全专题09强碱滴定三元酸曲线练习

专题09 强碱滴定三元酸曲线1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液p K a2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)【答案】B【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;B.根据H3AsO4的电离平衡常数计算;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;B.H3AsO4的K a2=,pH=7时c(HAsO42-)=c(H2AsO4-),K a2=c(H+)=10-7,pK a2=7,B错误;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。
2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度【答案】C3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
(人教版)2019-2020学年高三化学一轮复习 滴定曲线 考点深度剖析(解析版)

滴定曲线考点深度剖析【解题思路分析】滴定曲线分析的方法(1)分析步骤:首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
(2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②物料守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系。
【考点深度剖析】一、中和滴定的实验操作1.原理(1)酸碱恰好中和是指酸与碱按化学方程式中化学计量数关系恰好完全反应生成正盐。
利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法称为酸碱中和滴定。
(2)在酸碱中和滴定过程中,开始时由于被滴定的酸(或碱)浓度较大,滴入少量的碱(或酸)对其pH的影响不大。
当滴定接近终点(pH=7)时,很少量(一滴,约0.04 mL)的碱(或酸)就会引起溶液pH突变(如图所示)。
[注意] 酸碱恰好中和时溶液不一定呈中性,最终溶液的酸碱性取决于生成盐的性质,强酸强碱盐的溶液呈中性,强碱弱酸盐的溶液呈碱性,强酸弱碱盐的溶液呈酸性。
2.酸碱中和滴定的关键(1)准确测定参加反应的酸、碱溶液的体积。
(2)选取适当指示剂,准确判断滴定终点。
3.实验用品(1)仪器酸式滴定管(如图A)、碱式滴定管(如图B)、锥形瓶、滴定管夹等。
(2)试剂标准液、待测液、指示剂、蒸馏水。
[注意] ①滴定管的精确度为0.01 mL。
②酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易腐蚀橡胶管。
③碱性的试剂一般用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开。
④常用酸碱指示剂及变色范围4.中和滴定实验操作(以酚酞作指示剂,用盐酸滴定氢氧化钠溶液)(1)滴定前的准备(2)滴定(3)终点判断等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题05 物质的量分数曲线1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。
下列说法正确的是A. 丙酸的酸性比甲酸强B. CH3CH2COOH CH3CH2COO-+ H+的lgK=-4.88C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)【答案】B【解析】分析:A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B. 根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3.75,电离大于水解过程,所以HCOOH与HCOONa(1:1)的混合液显酸性。
据此解答问题。
2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是A. K b2的数量级为10-8B. X(OH)NO3水溶液显碱性C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)【答案】C【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。
详解:A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以K b2=,选项A正确。
B.X(OH)NO3水溶液中X的主要存在形式为X(OH)+,由图示X(OH)+占主导位置时,pH为7到8之间,溶液显碱性,选项B正确。
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)和c[X(OH)+]近似相等,根据图示此时溶液的pH约为6,所以溶液显酸性X2+的水解占主导,所以此时c(X2+)<c[X(OH)+],选项C错误。
D.在X(OH)NO3水溶液中,有电荷守恒:c(NO3-)+c(OH-)=2c(X2+)+c(H+)+c[X(OH)]+,物料守恒:c(NO3-)=c(X2+)+c[X(OH)2]+c[X(OH)]+,将物料守恒带入电荷守恒,将硝酸根离子的浓度消去,得到该溶液的质子守恒式为:c[X(OH)2]+c(OH-)=c(X2+)+c(H+)。
3.25℃时,在“H2A―HA-―A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。
下列说法正确的是A. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大B. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)C. NaHA溶液中,HA-的水解能力小于HA-的电离能力D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA -)一定相等【答案】C【解析】A.根据图像,在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,溶液的酸性减弱,α(HA-)可能增大,可能减小,与原溶液的成分有关,故A错误;B. 根据图像,将等物质的量的NaHA和Na2A混合物溶于水时,溶液的pH在4~5之间,溶液显酸性,以HA-电离为主,所得的溶液中α(HA-)<α(A2-),故B错误;C.NaHA溶液显酸性,以电离为主,可知其电离程度大于其水解程度,故C正确;D. 在含H2A、HA-和A2-的溶液中,根据电荷守恒,有2c(A2-)+c(OH-)+c(HA-)=c(H+)+ c(Na+),因为c(H2A)+2c(A2-)+c(OH-)=c(H+),则2c(A2-)+c(OH-)+c(HA-)=c(H+)+ c(Na+)=c(H2A)+2c(A2-)+c(OH-)+ c(Na+),因此c(HA-)=c(H2A) + c(Na+),故D错误;故选C。
4.常温下,HA为一元弱酸。
已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。
向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。
下列不正确的是A. 常温下,HA的电离平衡常数K a=10-9B. x=0时,1<pH<7C. x=5时,C(A-)=c(HA)D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L【答案】C【解析】A. 当pH值为9时,溶液中c(H+)=1×10-9mol/L,由c(HA)= c(A-)得,K a=10-9,A 正确;B. HA为弱酸,当不添加NaOH时,溶液呈酸性,且不完全电离,c(H+)<0.1mol/L,B 正确;C. 当x=5时,不能将电离出的H+完全中和,溶液呈酸性,C(A-)与c(HA)不相等,C 错误;D. x=10时,溶液体积为20mL,则此时c(A-)+c(HA)==0.05mol/L,c(Na+)=0.05mol/L,D正确。
故选择C。
5.已知常温下,K a1(H2CO3)=4.3×10-7, K a2(H2CO3)=5.6×10-11。
某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是()A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)B. 等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小C. 等浓度的NaOH溶液与H2R溶液按体积比1∶2混合,溶液的pH=1.3D. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-【答案】C6.常温下,现有0.1mol· L-1NH4HCO3溶液,pH=7.8。
已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH 的关系如图所示。
下列说法正确的是A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c( CO32-)B. NH4HCO3溶液中存在下列关系:<1C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小D. 分析可知,常温下水解平衡常数K h(HCO3-)的数量级为10-7【答案】B【解析】分析:A项,由NH3·H2O的分布分数的变化分析NH4+的分布分数的变化,再结合图像判断当pH=9时,溶液中各离子浓度大小;B项,根据碳酸氢铵溶液pH=7.8,判断NH4+与HCO3-的大小关系,结合物料守恒解决该项;C项,结合图像判断滴入氢氧化钠溶液后NH4+和HCO3-浓度变化;D项,利用图像中的特殊点(如pH=6.5时)对应的离子浓度,计算水解平衡常数K h(HCO3-)。
7.25℃时,向20mL 0.1mol/L HAuCl4溶液中滴加0.1mol/LNaOH 溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ) 随pH变化关系如图2,则下列说法不正确的是A. 在c点溶液中: c(Na+)=c(AuCl4-)B. a 点对应溶液pH 约为5C. 25℃时,HAuCl4的电离常数为1×10-3D. d点时,溶液中离子浓度大小关系为: c(Na+)>c(AuCl4-)>c(OH-) >c(H+)【答案】C【解析】c点溶液中,pH=7,c(OH-)=c(H+),根据电荷守恒可知:c(Na+)=c(AuCl4-),A正确;根据Ka= c(H+)×c(AuCl4-)/c(HAuCl4)=10-3×10-3/(0.1-10-3)≈10-5,由于a点时,c(AuCl4-)= c(HAuCl4),所以c(H+)≈10-5mol/L, pH≈5,B正确;0.1mol/LHAuCl4溶液pH=3,根据HAuCl4=H++ AuCl4-可知,该反应的电离常数为Ka=c(H+)×c(AuCl4-)/c(HAuCl4)= 10-3×10-3/(0.1-10-3)=10-5,C错误;d点时,溶液溶质为NaAuCl4,溶液显碱性,所以溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+),D正确;正确选项C。
8.常温下向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液中NH4+和NH3·H2O 的物质的量分数φ与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是A. 表示NH3·H2O物质的量分数变化的曲线是BB. pH=9.26时的溶液中,NH3·H2O的电离程度小于NH4+的水解程度C. 常温下,NH3·H2O的电离常数为1.8×10-5mol/L (已知lg1.8=0.26)D. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5+10-9)mol/L【答案】C【解析】NH3·H2O与HCl能够发生反应: NH3·H2O+HCl=NH4Cl+H2O,随着HCl的滴入,NH3·H2O 浓度逐渐减小,NH4+的浓度逐渐增大,所以曲线B表示的是NH4+,不是NH3·H2O的物质的量分数,A选项错误;pH=9.26时,溶液呈碱性,说明NH3·H2O的电离程度大于NH4+离子的水解程度,B选项错误;NH3·H2O NH4++ OH-,K=[C(NH4+)×C(OH-)]/C(NH3·H2O),根据图示得:当PH=9.26时,溶液中NH3·H2O和NH4+的物质的量分数相同,即浓度相同,所以K=C(OH-)=Kw/C(H+)=1×10-14/10-9.26=10-4.74=1.8×10-5,C选项正确;当加入盐酸体积为50mL时,C(Cl-)=1/15mol·L-1,C(NH3·H2O)+C(NH4+)=2/15 mol•L-1,所以有:2C(Cl-)= C(NH3·H2O)+C(NH4+),根据电荷守恒:2C(H+)+2C(NH4+) =2C(Cl-)+2C(OH-),所以c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol/L,D选项错误,正确答案是C。
