沉淀表
沉淀表格初中化学

沉淀反应是化学中常见的一种反应类型,涉及到反应物溶液中某些离子的结合形成沉淀。
下面是一个可能的沉淀反应实验记录表格的示例,适用于初中化学实验:实验名称:沉淀反应实验
实验材料:
•氯化银(AgCl)固体
•氯化银溶液
•氯化钠溶液
•硝酸银溶液
•氯化钠(NaCl)溶液
•试管
•滴管
•纸巾
实验步骤:
1.取2个试管,标记为试管A和试管B。
2.在试管A中加入3-4滴氯化银溶液。
3.在试管B中加入3-4滴硝酸银溶液。
4.向试管A中滴加3-4滴氯化钠溶液,观察反应产物。
5.向试管B中滴加3-4滴氯化钠溶液,观察反应产物。
6.结果记录和观察。
实验结果和观察:
•试管A中:无明显变化或出现白色沉淀。
•试管B中:无明显变化或无沉淀形成。
结论:根据实验结果,我们可以得出以下结论:
•在试管A中,氯化银溶液与氯化钠溶液发生沉淀反应,形成白色的氯化银沉淀。
•在试管B中,硝酸银溶液与氯化钠溶液没有发生明显的反应和沉淀形成。
注意事项:
•实验完成后,将试管和滴管清洗干净。
•在处理实验化学品时,戴上实验室安全眼镜和实验手套,确保实验操作的安全性。
这只是一个基本的沉淀反应实验记录表格示例,具体实验内容和数据可能会根据实验的具体要求而有所不同。
在进行任何化学实验之前,请确保阅读和遵守实验的安全操作规程,并在有经验的教师或专业人士的指导下进行。
沉淀溶解表
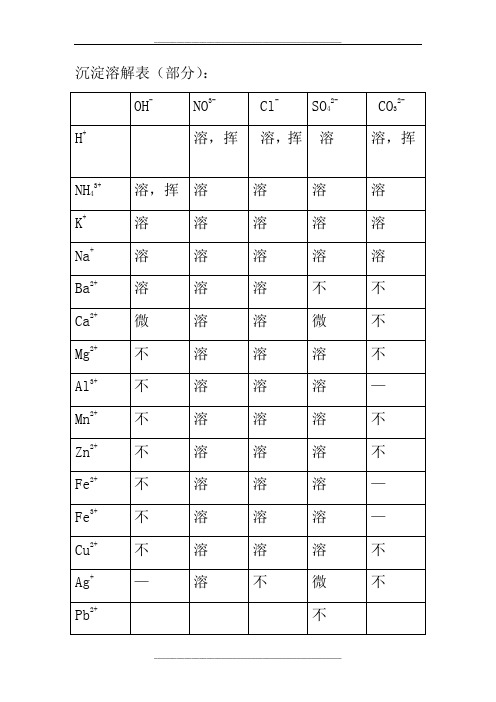
沉淀溶解表(部分):钾钠,都能容在水里边。
和,容的只有钾钠铵。
可容性碱:俺拿假被盖(铵钠钾钡钙)。
,毛病少,不溶只有。
,也还行,钙。
高中常见物质颜色分类归纳黑色:Ag2S 、Ag2O 、C粉、CuO 、CuS 、Cu2S 、Fe3O4、FeO 、FeS 、MnO2、PbS、石油等。
紫黑色:O3(固态) 、I2、KMnO4灰黑色:石墨、晶体硅灰色:As 、Fe3C 、Se、Sn银灰色:Ge:AgCl 、AgOH 、Al(OH)3、 Al2O3、BaCO3、BaSO4、CaCO3、CaSO3、无水CuSO4、Fe(OH)2、Fe(略带灰色) 、KClO3、 KCl 、K2SO4、MgO、Mg(OH)2、MgCO3、 NH4HCO3、 NH4NO3、(NH4)2SO4、Na2O、NaOH、Na2CO3、NaHCO3、 P2O5、 P4(白磷)、 ZnSO4、C6H12O6(葡萄糖)、(C6H10O5)n(淀粉)、(C6H10O5)n(纤维素)、三溴苯酚等。
银白色:K、 Na、 Mg、 Al、 Sn 、Sb 、Bi 、Te 、Ti 、Hg 、Li 、Rb、 Cs(略带金色)等。
青白色:Zn蓝白色:Pb红色:[FeSCN]2+(血红色) 、Cu2O(砖红色)红棕色:P(红磷)、NO2、Fe2O3紫红色:Cu 、MnO4-红褐色:Fe(OH)3、碘酒(褐色)深红棕色:Br2黄色:AgI 、P4(黄磷) 、Au 、Ag3PO4、FeS2、Al2S3、K2CrO4淡黄色:Na2O2 、AgBr 、TNT 、S、PCl5、混有NO2的浓HNO3、混有Fe3+的浓HCl、溶有NO2的硝基苯灰黄色:Mg3N2棕黄色:FeCl3、CuCl2橙色:溴水、K2Cr2O7溶液绿色:Cu(OH)2CO3、 Cr2O3浅绿色:Fe2+、FeSO4·7H2O黄绿色:Cl2浅黄绿色:氯水、F2蓝色:CuSO4·5H2O 、Cu(OH)2、Cu2+的稀溶液淡蓝色:O3(气体)深蓝色:O3(液态)常见与Cu有关的颜色:Cu紫红色; Cu2O红色; CuO黑色;CuF2白色; CuCl2黄棕色; CuBr2棕黑色; CuI白色; Cu(OH)2淡蓝色; Cu2S黑色;CuS黑色; CuSO4·5H2O蓝色;无水CuSO4白色;含Cu2+溶液:浓度很浓显黄绿色,浓度浓显绿色,浓度稀显蓝色。
高中化学书最后一面离子沉淀表

高中化学书最后一面离子沉淀表篇一:化学常见常见沉淀及溶解性口诀常见沉淀白色:BaSO4/BaCO3/CaCO3/AgCl/Ag2CO3/Mg(OH)2/Fe(OH)2/A l(OH)3/CuCO3/ZnCO3/MnCO3/Zn(OH)2Fe(OH)2蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3沉淀鉴别Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 黑色沉淀Cu2O 红色沉淀Fe2O3 红棕色沉淀FeO 黑色沉淀FeS2 黄色沉淀PbS 黑色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)相关口诀钾钠铵盐硝酸盐均可溶盐酸盐银不溶硫酸盐钡不溶白色沉淀: CaCO3. BaCO3 . BaSO4. AgCL. Mg(OH)2蓝色沉淀: Cu(OH)2红褐色沉淀: Fe(OH)3不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③氢氧根多溶一个钡④口诀中未有皆下沉。
⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
物质溶解性表及沉淀颜色

物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== C aCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2= === Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2 NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2C O3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaC O3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+ 2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+ 3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H 2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2 O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO= === 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+ H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO3 53.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca (HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2 O64.浓硫酸与碳的反应2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O 寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO 2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O 68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+ O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2HCl+S↓71.硫化氢与浓硫酸的反应H2S+H2SO4(浓)==== S↓+SO2↑+2H2 O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+C l2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca (OH)2(3) Mg2++2OH2-==== Mg(OH)2↓(4) Mg(OH)2+2HCl==== MgC l2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3 105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3 H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3 113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al (OH)4]115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH) 3↓+3(NH4)2SO4117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH) 4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al (OH)3↓+NaCl+H2O122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O 123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== A lCl3+NaCl+4H2O124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al (OH)3↓+3NaCl125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2C O3127.铜与氧气的反应2Cu+O2==== 2CuO128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O2↑130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体 (1)(2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1) (2)()()()2332222332HH HCO HCO CO S HS HS SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体:S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体(1)单质 (2)化合物5.强烈双水解⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SOH HNO SO H HNO SOH HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na ()()⎪⎧↓+↑−−→−----+232323322OH Al CO HCO CO O H OH6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
沉淀口诀表高中

高中化学沉淀口诀如下:
1.口诀1:酸类大多都可溶,铵钾钠钡碱可溶。
钾钠铵盐全都
溶,氯化物只银不溶。
硫酸铅钡不怕水,硝酸银见水影无踪。
2.口诀2:钾钠铵盐水中溶,硝酸盐入水无影踪。
氯化物中除去
银亚汞,硫酸盐中除去钡铅都可溶。
若问碳酸磷酸其他盐,钾钠铵外都不溶。
3.口诀3:钾钠铵盐水中溶,硝酸盐入水无影踪。
氯化物中除去
银亚汞,硫酸盐中除去钡铅都可溶。
若问碳酸磷酸其他盐,钾钠铵外都不溶。
4.口诀4:钾钠铵盐水中溶,硝酸盐入水无影踪。
氯化物中除去
银亚汞,硫酸盐中除去钡铅都可溶。
若问碳酸磷酸其他盐,钾钠铵外都不溶。
5.口诀5:碱性氧化物,难容寻常见。
碱土金属只六君,三钡八
氨碱超半。
别的金属能全溶,钾钠铵硝全水溶。
高中沉淀物质表

高中沉淀物质表沉淀,又称积沙或沉淀物,可以被定义为溶液中溶解物质逐渐增加,使其沉积到溶液下方固体表面上的过程。
这些沉淀物质可以是化学分子或矿物质,有时会形成凝胶状物质或混合溶液,这取决于沉淀物中包含哪些类型的物质。
沉淀是一种现象,它可以发生在化学、物理或生物体系中。
本文将着重讨论高中沉淀物质的表。
一般而言,高中沉淀物质是由各种被溶液隔离的固体组成的,这些固体可以是多种化学单位,如氧化物、离子或晶体。
这些沉淀物质可以通过显微镜、扫描电镜和电子能谱仪等仪器进行检测。
其中,显微镜可以放大图像,便于观察沉淀物质的形状,而扫描电镜可以放大沉淀物质的细节,以便了解其结构和特性。
最后,电子能谱仪可以识别沉淀物质的组成,以及它们之间的互相作用。
以下是高中沉淀物质的表:1.化物:氧化物是由一种元素的氧原子和另一种元素的原子组成的化合物,例如二氧化硫(SO2)、三氧化二磷(P2O5)和三氧化氯(ClO3)等。
2.子:离子是带有正或负电荷的原子或分子,它们在被溶液隔离时能够沉淀下来,例如钠离子(Na+)、钙离子(Ca2+)和氯离子(Cl-)等。
3.体:晶体是由组成原子或分子经过极其复杂的堆积聚集而形成的固体,它们在被溶液隔离时能够沉淀下来,例如石膏(CaSO4)和盐酸(HCl)等。
4.合溶液:混合溶液是由两种或更多种不同类型的溶解物质组成的溶液,它们在被溶液隔离时也能沉淀下来,例如铝酸钡(BaAl2(SO4)2)和碳酸氢钠(NaHCO3)等。
以上就是关于高中沉淀物质的表的部分介绍,从沉淀物质的定义、检测仪器和表的内容中可以看出,沉淀是一种重要的化学现象,在实验室中常用来研究不同类型的物质的溶解性和结构性质。
而高中沉淀物质的表则是用来帮助更好地理解和研究这一现象的重要工具,因此,有必要进行详细的研究。
只有通过深入地研究,才能更全面、准确地理解高中沉淀物质的表现形式及其特性,从而更好地利用它们在化学实验中。
