肺泡蛋白沉积征
肺泡蛋白沉积症诊断与治疗PPT

临床表现:咳嗽、 呼吸困难、胸痛、 咯血等
诊断标准:胸部X 线检查、肺功能检 查、支气管镜检查 等
治疗方法:药物 治疗、手术治疗、 呼吸支持治疗等
预后:取决于病情严 重程度和治疗效果, 部分患者可治愈,部 分患者预后较差。
发病率:全球范围内发病率较低,但近年来有上升趋势 性别差异:男性发病率略高于女性 年龄分布:主要发生在儿童和青少年,但也可见于成年人 地域分布:全球范围内均有病例报告,但主要集中在发达国家和地区
药物治疗:使用 抗炎药、支气管 扩张剂等药物进 行治疗,效果因 人而异
手术治疗:对于 严重肺泡蛋白沉 积症患者,可以 考虑进行肺移植 手术,但风险较 大
辅助治疗:进行 呼吸训练、营养 支持等辅助治疗, 有助于改善患者 生活质量
效果评估:根据 患者症状、肺功 能、影像学检查 等指标进行评估, 以确定治疗效果
疗。
肺泡蛋白沉积症的 病例分析
患者基本信息:年龄、性别、职业等 症状表现:咳嗽、呼吸困难、胸痛等 诊断方法:胸部X线、CT、肺功能检查等
治疗方案:药物治疗、手术治疗、康复治 疗等
预后情况:病情好转、稳定、恶化等
病例分析:病因、病理、治疗效果等
评估指标:肺 功能、影像学 检查、临床症
状等
治疗方法:药 物治疗、手术 治疗、辅助治
保持室内空气清新,避免接触刺激性气体和粉尘 保持良好的生活习惯,如戒烟、限酒、避免熬夜等 保持良好的饮食习惯,如多吃蔬菜水果、少吃油腻食物等 保持良好的心理状态,如保持乐观、避免焦虑等 定期进行身体检查,如肺功能检查、胸部X线检查等 及时就医,如出现咳嗽、胸闷、气短等症状时,及时就医进行诊断和治
06
抗纤维化药物:如吡非尼酮、尼达尼布等,可抑制 纤维化,减轻症状
肺泡蛋白沉积症影像诊断及其鉴别诊断

肺泡蛋白沉积症(PAP)是一种原因不明的罕见肺疾病,其特点是以非可溶性富磷脂蛋白物质沉积于肺泡腔为特征的肺弥漫性疾病,而气道、肺泡壁或血管结构很少破坏。
PAP是一种少见病,于1958年由 Rosen等首先报道。
PAP可分为“原发性”和“继发性”2型.原发性 PAP是肺泡表面活性物质代谢异常的一种疾病,与肺泡巨噬细胞清除表面活性物质的功能下降有关,婴幼儿多见,部分患者可自行缓解甚至痊愈。
继发性PAP为继发于其他系统的疾病:与免疫机制障碍、血液及淋巴系统的恶性肿瘤以及细胞毒性药物应用有关,或与吸入无机矿物质、化学物质有关。
本病的临床表现缺乏特征性,X线胸片表现与多种疾病类似,利用BAL松解肺泡腔及小气道内黏附的蛋白物质是目前首选且有效的治疗方法,诊断正确是采用上述治疗方法的前提,否则,将是LB或开胸肺活检来确诊,开胸肺活检虽是金标准,但一种既给病人带来较大痛苦又无疗效的结果,长期以来一直依靠TB标准”,但因其危险性高、并发症多、病人较痛苦等不确定因素较多而难以全面开展,因此影像学结合痰检及BAL是目前诊断PAP的主要手段,胸部HRCT能准确观察病变的形态和分布,典型的CT表现可对PAP作出临床诊断,故临床应用愈来愈普遍。
影像表现:(1)气腔实变及磨玻璃影。
本组6例患者均见磨玻璃影,即HRCT图像上肺密度轻度增高,呈浅淡斑片状影,不掩盖其中的肺血管和支气管影,其相应的病理改变为肺泡内富磷脂蛋白样物质充盈;(2)地图样改变。
本组4例患者胸部HRCT表现为两肺斑片状磨玻璃影与周围相对正常肺组织之间边缘清楚,边缘可有成角现象或呈弧形,病变在周围低密度的肺组织衬托下呈地图样改变,这种表现是PAP在HRCT上的一个特征性改变。
地图样改变的病理基础是肺泡内富磷脂蛋白样物质充盈,肺泡间隔正常或轻度慢性炎症,以肺小叶为单位,小叶间隔在一定程度上限制病变的蔓延,使病变周围肺组织相对正常,肺组织结构完整。
(3)铺路石样改变。
PAP专场(肺泡蛋白沉积症)

PAP专场(肺泡蛋⽩沉积症)阅读 1157王俊豪关注兰天龙——肺泡蛋⽩沉着症(pulmonary alveolar proteinosis)指原因不明的肺泡内弥漫性蛋⽩沉着,⾸先由Rose于1958年报告,迄今⽂献报告约400~500例,国内于1965⾸例报告。
临床以进⾏性⽓促为特征,⽀⽓管肺泡灌洗是诊断与治疗的主要⼿段。
预后相差很⼤,有⾃愈,也有发现后⼀、⼆年内死亡的。
这是⼀种病因不明的罕见疾病,病理特点是肺泡内充满主要含磷脂和蛋⽩质的过碘酸-Schiff(PAS)染⾊阳性颗粒状物质。
肺泡蛋⽩沉着症(PAP)主要发⽣于20~60岁原来⾝体健康的⼈,PAP偶可发⽣于接触⽆机粉尘(如⼆氧化硅、铝、钛)的病⼈以及因卡⽒肺囊⾍,慢性感染,多种出⾎性恶性肿瘤,⾻髓及外⾻髓增殖性疾病或免疫抑制的病⼈。
这种相关性的意义尚不清楚。
病理变化限于肺脏.典型的表现是肺泡上⽪和间质细胞正常,但肺泡内充填着含各种⾎清和⾮⾎清蛋⽩的⽆定形PAS染⾊阳性颗粒。
肺泡内脂含量⾼,可能是因为肺泡磷脂的清除异常。
间质纤维化少见。
病理过程可能为弥漫性或局限性,可能进展亦可能稳定,或⾃⾏消失。
最常受累的是肺基底部和后部,偶尔侵犯前段,胸膜和纵隔不受影响。
临床表现 PAP最显著的特点是临床症状⼀般表现隐匿、轻微⽽胸部CT表现严重。
临床表现缺乏特异性,男⼥之⽐为2~3∶1,可发⽣于任何年龄,多数在20~50岁之间。
起病隐匿,主要症状为进⾏性⽓促。
约1/3病例有低热,⼤部分有咳嗽,痰呈乳⽩⾊泡沫状,有时见块状、胶冻状或管型咳出。
体检可有呼吸运动减弱,叩诊轻度浊⾳,肺内明显的病理性⽀⽓管呼吸⾳,偶有湿罗⾳。
重症有杵状指、紫绀及肺动脉⾼压的表现。
影像学表现1、X线:胸部X线平⽚表现为两肺中下肺野为主的斑⽚状、磨玻璃样密度增⾼影,其内可见⼩结节影,病灶对称或不对称。
部分呈蝶翼状,易误诊为肺⽔肿。
2、CT表现:胸部CT表现呈多样化,其影像改变取决于肺泡蛋⽩样物质的多少⼜跟它的分布有关,其中以两肺中下野分布多见。
肺泡蛋白沉积症20例诊治分析

肺泡蛋白沉积症20例诊治分析摘要目的提高对肺泡蛋白沉积症(PAP)的认识。
方法回顾性分析20例确诊为肺泡蛋白沉积症患者的病例资料。
结果肺泡蛋白沉积症以呼吸困难、咳嗽、咳痰为主要表现,影像学多表现为双肺弥漫性磨玻璃影及斑片影,部分呈“地图征”及“铺路石征”改变。
20例患者均行支气管肺泡灌洗液(BALF)病理分析,过碘酸雪夫(PAS)染色阳性;10例经支气管镜肺活检(TBLB)提示肺泡腔见蛋白物沉积。
结论肺泡蛋白沉积症临床症状及实验室检查无特异性,对于以咳嗽伴进行性呼吸困难为主要临床表现,CT双肺弥漫性病变,呈“地图征”及“铺路石征”改变的病例应警惕本病,尽早行BALF及TBLB,必要时行胸腔镜肺活检确诊,避免误诊。
关键词肺泡蛋白沉积症;大容量全肺灌洗术肺泡蛋白沉积症(pulmonary alveolar proteinosis,PAP)是一种罕见病,以肺泡内充满大量PAS阳性的磷脂蛋白样物质,而肺组织结构完整为病理特点的弥漫性肺部疾病[1]。
其发病机制复杂,临床症状缺乏特征性,影像学检查不易鉴别,误诊率高。
现对2012年4月~2013年4月华西医院收治的20例PAP 患者资料进行分析,以提高对本病的认识。
现报告如下。
1 资料与方法1. 1 一般资料本组20例患者中男12例,女8例,男女比例为1.5:1,发病年龄25~62岁。
其中30~50岁病例14例,占70%。
10例有吸烟史,20例病例均无无机矿物质及化学物质吸入史。
1. 2 治疗方法17例在全身麻醉下经Carlens双腔管行分侧大容量全肺灌洗术(WLL):患者经静脉诱导麻醉后,插入分侧气管导管,应用全身麻醉呼吸支持系统进行分侧肺泡灌洗。
2 结果2例转外院行全肺灌洗术,2例予粒细胞-巨噬细胞集落刺激因子(GM-CSF)治疗,1例自动出院。
进行全肺灌洗17例患者术后复查血气分析血氧分压(PO2)改善,胸部CT病灶吸收。
2. 1 临床表现及体征20例中呼吸困难14例(70%),咳嗽、咳痰12例(60%),干咳2例,胸闷6例,胸痛8例,伴体重下降8例。
肺泡蛋白沉积症诊断标准

肺泡蛋白沉积症诊断标准
肺泡蛋白沉积症(PAP)是一种罕见的肺部疾病,主要特点是肺泡中积累了大量的蛋白质。
本文将介绍PAP的诊断标准。
诊断PAP的关键是肺泡灌洗(BAL)和肺活检。
BAL是一种方法,通过将液体注入肺部并抽出肺泡内液体样本进行检查,判断肺泡内是否有异常的蛋白质积聚。
肺活检是常见的组织活检方法,可以直接在肺部进行,为确诊PAP提供直接证据。
以下是PAP诊断的标准:
1.临床症状:患者的主要症状包括咳嗽、气促、乏力、发热以及体重减轻等。
这些症状可以从患者的病史中获得。
2.影像学:肺部影像学显示可以显示肺部的异常变化。
X线和CT扫描是常见的影像学检查方法。
在CT扫描中,PAP通常表现为双侧弥漫性地增加肺泡实质密度。
3.肺功能测试:肺功能测试主要是针对患者的肺功能进行检查,并判断是否存在肺功能不全。
患者肺功能测试也是PAP的一个重要指标。
4.肺泡灌洗:BAL可以为PAP的诊断提供直接证据。
通过BAL检测,PAP患者肺泡内明显可看到蛋白质物质沉积,表现为“沙漏状玻璃影”。
5.肺活检:肺活检是最准确诊断PAP的方法。
通过对肺泡组织的检查,可以确定PAP的存在,并帮助确定病变的性质和病变紧密度。
以上是PAP的诊断标准。
尽管其中余地存在,还需要进行更多研究,但它们为医生诊断PAP提供了基本框架,提高了PAP的诊断准确性。
一例肺泡蛋白沉积症病例分析

一例肺泡蛋白沉积症病例分析肺泡蛋白沉积症,又称隐球蛋白沉积症,是一种罕见的肺部疾病。
它的病因尚不明确,但主要特征是肺泡内隐球蛋白的沉积,导致肺部功能障碍。
在本文中,我们将对一位肺泡蛋白沉积症患者的病例进行分析。
患者是一位60岁的男性,主要症状是呼吸困难,并且活动能力明显下降。
他报告说,这些症状已经持续了大约6个月。
他表示逐渐加重的呼吸困难,夜间咳嗽,以及咳出的黏液血痰。
他还存在明显的乏力感和纳差。
他向医生描述了这些症状影响了他的日常生活和工作。
初步的体格检查显示该患者呈现呼吸困难,但没有明显的杂音。
肺部听诊发现两肺有散在的干性啰音。
血氧饱和度为88%,动脉血气分析显示氧分压(PaO2)降低,同时二氧化碳分压(PaCO2)略有升高。
在进一步的检查中,患者接受了胸部X线和CT扫描。
X线显示双肺有片状和磨砂玻璃样阴影,且呈弥漫性分布。
CT扫描显示双肺有广泛分布的磨砂玻璃样密度影像,特别是在肺基底区。
根据临床表现和影像学结果,医生初步怀疑该患者患有肺泡蛋白沉积症。
进一步的确认需要通过肺活检获得组织标本进行病理学检查。
病理学检查显示肺组织中肺泡内充满了均质、玻璃状的物质。
免疫组织化学染色显示这些物质主要由隐球蛋白组成。
结合临床症状、影像学结果和病理学检查,患者最终被确诊为肺泡蛋白沉积症。
治疗方面,该患者接受了以糖皮质激素为主的免疫抑制治疗。
糖皮质激素可以减少炎症反应和隐球蛋白的沉积。
此外,患者还接受了辅助氧疗以提高氧合能力。
在治疗后的几个月内,患者的症状明显改善。
他的呼吸困难减轻,咳嗽和咳痰也明显减少。
动脉血气分析显示PaO2有所上升,PaCO2略有下降。
他的血氧饱和度也提高到了95%。
这个病例分析强调了肺泡蛋白沉积症的临床特征和诊断阶段的重要性。
虽然病因尚不明确,但通过影像学和病理学检查,可以对患者进行准确的诊断。
此外,糖皮质激素和辅助氧疗是目前常用的治疗方法,可以显著改善患者的症状和生活质量。
需说明的是,本文中的病例仅是一个针对肺泡蛋白沉积症的典型实例。
肺泡蛋白沉积症CT表现
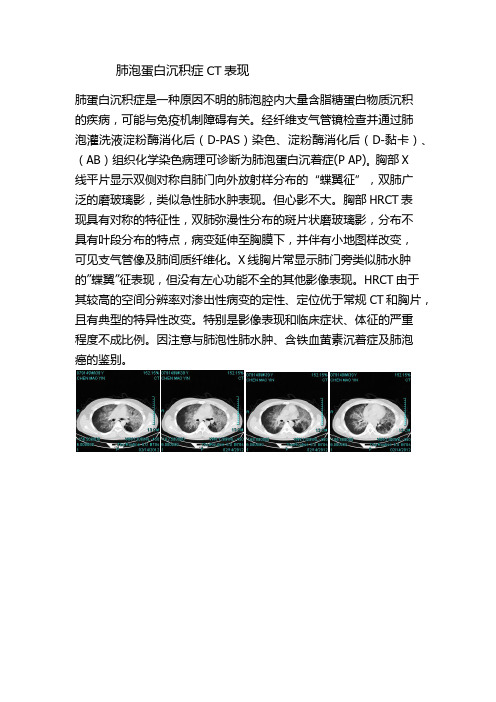
肺泡蛋白沉积症CT表现
肺蛋白沉积症是一种原因不明的肺泡腔内大量含脂糖蛋白物质沉积
的疾病,可能与免疫机制障碍有关。
经纤维支气管镜检查并通过肺
泡灌洗液淀粉酶消化后(D-PAS)染色、淀粉酶消化后(D-黏卡)、(AB)组织化学染色病理可诊断为肺泡蛋白沉着症(P AP)。
胸部X
线平片显示双侧对称自肺门向外放射样分布的“蝶翼征”,双肺广
泛的磨玻璃影,类似急性肺水肿表现。
但心影不大。
胸部HRCT表
现具有对称的特征性,双肺弥漫性分布的斑片状磨玻璃影,分布不
具有叶段分布的特点,病变延伸至胸膜下,并伴有小地图样改变,
可见支气管像及肺间质纤维化。
X线胸片常显示肺门旁类似肺水肿的”蝶翼”征表现,但没有左心功能不全的其他影像表现。
HRCT由于其较高的空间分辨率对渗出性病变的定性、定位优于常规CT和胸片,且有典型的特异性改变。
特别是影像表现和临床症状、体征的严重
程度不成比例。
因注意与肺泡性肺水肿、含铁血黄素沉着症及肺泡
癌的鉴别。
肺泡蛋白沉积症治疗进展实习

肺泡蛋白沉积症的治疗进展肺泡蛋白沉积症 (pulmonary alveolar proteinosis,PAP) 是 Rosen 等于 1958 年首先报道的一种少见的肺部疾病。
PAP 的病理学特征为肺泡及细支气管腔内充满无定形的过碘酸雪夫 (periodicacid-Schiff,PAS) 染色阳性的磷脂蛋白样物质。
过量的磷脂蛋白样物质沉积导致患者肺通气和换气功能障碍,引起进行性呼吸困难等。
PAP 分为先天性、继发性、免疫性三类,其中约 90%为免疫性。
长期以来临床治疗方法主要是全肺灌洗术 (whole lung lavage,WLL),但近年来随着医学界对 PAP 发病机制认识的进一步深化,一些新方法逐渐应用于临床实践中。
现将 PAP 的治疗研究进展综述如下。
1 支气管肺泡灌洗:Ramirez1965 年首次使用支气管肺泡灌洗术治疗 PAP 后,此方法已成为目前治疗 PAP 的首选手段,有效率约为85%。
支气管肺泡灌洗通过去除 PAP 患者体内过量的肺泡磷脂样物质、抗 GM-csF 抗体、肺泡巨噬细胞 (GM-csF 的靶细胞),从而改善PAP 患者的肺功能,缓解患者症状。
临床工作中肺泡灌洗术主要有两种形式:(1) 全肺灌洗术:患者全身麻醉后行双腔气管内插管,灌洗下侧肺,上侧肺行机械通气,灌洗单侧肺常需要 10~20 L 生理盐水。
WLL 的优势为灌洗较彻底,效果显著,疗效维持时间长,因此仍是目前治疗 PAP 最有效的方案。
但是 WLL 时需要患者行全身麻醉准备,灌洗液体量大,耗费时间长,并非所有患者可耐受,特别是婴幼儿、老年人,或机械通气也不能改善低氧血症的 PAP 患者,可在体外循环支持下或采用高频通气技术辅助对以上人群进行 WLL。
(2) 支气管镜下分段肺泡灌洗术:患者局部麻醉后在支气管镜下行肺叶或肺段灌洗治疗,灌洗单叶肺每次需200~300 ml。
此方法优势为灌洗液量少、操作时间缩短,灌洗造成的不良反应较轻,适用于不能耐受全身麻醉或单侧肺通气的患者。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
影像-病理基础
碎石路征:由于肺泡内表面活性样物质充盈, 肺泡密
度增高,同时肺泡间隔轻度炎症反应及胶原沉积致间 隔增厚, 从而形成类似的影像学表现。 地图样改变:病变常以肺小叶为单位, 小叶间隔的增 厚在一定程度上限制病变的蔓延, 使病变周围肺组织 相对正常, 继而形成地图样改变。
常规CT图像显示双肺对称 分布的大片磨玻璃样影;
肺活检HE染色:肺泡内充满嗜酸性样物质。
肺泡灌洗液:可见厚层的沉淀物。
影像表现-X线
不特异。
典型的PAP表现为双侧对称分布的肺泡腔实变影, 病变
常自肺门区向肺外带延伸, 并可以表现为‘蝶翼征’改 变, 与肺水肿、卡氏肺囊虫性肺炎表现类似。 另外, 胸片上还可以看到局灶性浸润、网结节状及不对 称的肺部浸润改变。 PAP患者很少出现胸腔积液和淋巴结肿大的征象, 并且 存在影像表现与临床症状不一致的现象:影像表现明 显异常而临床症状轻微。
鉴别诊断
间质性肺炎:影像学均表现为弥漫性间质病变, 较
易与PAP相混淆。但间质性肺炎患者病灶多位于下 肺及胸膜下, 主要表现为弥漫磨玻璃样改变或弥漫 网格状和网状小结节, 可出现牵张性支气管扩张改 变, 其病变呈进行性发展, 病程后期, 肺体积渐缩小, 可出现蜂窝肺, 常有膈胸膜增厚、粘连。而PAP为 肺泡充填性改变, 除了部分职业接触史者外, 肺结 构一般都保持完整, 不会出现肺实质的破坏及肺体 积缩小。其典型的地图征或碎石路征有助于与间 质性肺炎相鉴别。
男, 33岁d: 肺底层面CT图像显示双肺大片肺泡实变-间质浸润改变; E: 为首次全肺泡灌洗术后、F: 为再次全肺泡灌洗术后复查CT 图 像, 显示病变逐步好转。G:肺活检组织病理学检查:光镜下可见肺泡间隔及肺泡腔内大量淡红色蛋白样物质沉积。(HE 染色)
病理
主要是肺泡及细支气管内有嗜酸PAS强阳性物质填 充,是Ⅱ型肺泡细胞产生的表面活性物质磷脂与肺 泡内液体中的其他蛋白质和免疫球蛋白的结合物, 其成分为糖蛋白和磷脂。肺泡隔及周围结构基本 完好。
电镜可见肺泡巨噬细胞大量增加, 肺泡肿胀, 呈空
泡或泡沫外观。 支气管肺泡灌洗液呈米汤样或豆腐渣样白色混浊, 静置后有沉淀, 是其典型特征。
发病机制
分为三种独立的亚型: 特发性、继发性和先天性。
特发型占90%以上,抗粒细胞- 巨噬细胞集落刺激因子
( GM-CSF)抗体在特发性PAP的发生发展中起重要作用。 由于抗GM-CSF中和抗体的存在, 导致单核- 巨噬细胞分化 成熟障碍及中性粒细胞吞噬能力下降, 并最终引发肺泡内 表面活性剂样物质沉积。因此, 特发性PAP如今也被归为 一种自身免疫性疾病。 继发性PAP约占5% ~10%, 它与各种潜在的致病因素或基 础疾病密切相关, 主要见于工业环境中有害物质吸入性暴 露的病人, 如二氧化硅微粒、水泥粉尘、铝尘、玻璃纤维 等物质; 或见于恶性血液系统疾病、免疫缺陷病的病人。 先天性PAP, 很罕见, 约占2%, 主要见于新生儿PAP患者。
北大医院放射科 程晓悦
Patient, female, 44 years old.
Main reference: cough, sputum and breath-
holding for six months. Chest X-ray: bilateral lung field’s brightness reduced, with diffusely blurred miliary nodules. HRCT: bilateral interlobular septal thickening 、 multiple ground-glass opacity (GGO) lesions , consist with ‘crazy paving’ patterns. some areas shows lung consolidations。 CT: after the whole lung lavage, showing lesions shrinkage。
影像表现-CT
胸部CT是PAP最具诊断价值的影像学检查方法, 薄层CT尤
其是高分辨率CT (HRCT)能够提供更多解剖细节和有关病 变范围的信息。 典型的表现为双肺斑片状磨玻璃样影和小叶间隔增厚, 即 所谓的碎石路征( crazy paving )。 同时,病灶边缘与正常肺组织分界清楚, 从而使肺部病变形 成一种地图样分布表现( geographic appearance)。 病变通常分布于整个肺野, 平均累及13个肺段。 肺内阴影累及的范围、磨玻璃样阴影的密度高低与PAP患 者的病情严重程度相关, 严重患者阴影可累及全肺, 同时 肺内出现大片实变,可见支气管充气征。
同层面薄层CT图像显示病变内 部铺路石征改变及支气管气象;
c: 冠状位重组图像显示病变广泛累及双侧肺野,双侧肺尖区及肋 膈角区受累较轻。
碎石路征。
碎石路征及地图样分布。
临床诊断
( 1) PAP的诊断在X线胸片上缺乏特异征象, 需密切
综合CT和HRCT 检查。 ( 2)PAP的特征性表现是弥漫性、随机分布的实变 影和磨玻璃影, 而与病变相间的肺组织完全正常,呈 地图样改变。 ( 3)碎石路征是一个重要征象, 但要与其他病变鉴 别。 ( 4) PAP早期诊断困难,肺部影像表现重于临床症状, 此为PAP的特点。 ( 5) PAP的确诊有赖于肺泡灌洗术或肺活检, 肺泡 灌洗术是首选。
治疗
全肺灌洗( whole lung lavage, WLL) 是公认的特发性 PAP的标准治疗方法。W LL属于支持治疗, 它是用物 理的手段清除肺泡内表面活性样物质, 安全、有效,
能够迅速改善PAP患者的肺通气和换气功能、临床症 状和影像学表现。 近年来, 针对PAP发病机制中抗GM-CSF抗体的作用 而开发的GM-CSF替代治疗已经逐渐应用于临床, 初 见疗效。
定义
肺泡蛋白沉积症( pulmonary alveolar proteinosis,
PAP) 是一种原因未明的少见疾患, 病理以大量不 定形的非可溶性富磷脂蛋白物质沉积于肺泡腔和 细支气管腔为特征的肺弥漫性疾病。 本病好发于中青年, 男性发病率约为女性的2倍。 其最常见的临床表现为进行性呼吸困难, 咳嗽和咳 痰。 PAP的确诊依赖于组织病理学检查。 1965年由Ram irez发明的全肺灌洗法是目前证实的 唯一有效的治疗方法, 既能治疗又能确诊。
