手性分子介绍
什么是手性分子

什么是手性分子
手性分子是指与其镜像不相同不能互相重合的具有一定构型或构象的分子。
手性一词来源于希腊语“手”(Cheiro),由Cahn等提出用“手性”表达旋光性分子和其镜影不能相叠的立体形象的关系。
手性等于左右手的关系,彼此不能互相重合。
所有的手性分子都具有光学活性,同时所有具有光学活性的化合物的分子,都是手性分子。
手性分子包括不具有任何对称因素的不对称分子和具有简单对称轴而不具有其他对称因素的非对称分子。
手性分子的研究具有广泛的应用前景,例如在手性合成和手性催化中具有重要意义。
此外,手性分子还被用于手性识别、手性分析和手性生物活性研究等领域。
如需更多信息,可以阅读化学类专业书籍或请教化学专业人士。
手性分子

手性分子什么是手性分子英文名:chiral molecules我们知道,生命是由碳元素组成的,碳原子在形成有机分子的时候,4个原子或基团可以通过4根共价键形成三维的空间结构。
由于相连的原子或基团不同,它会形成两种分子结构。
这两种分子拥有完全一样的物理、化学性质。
比如它们的沸点一样,溶解度和光谱也一样。
但是从分子的组成形状来看,它们依然是两种分子。
这种情形像是镜子里和镜子外的物体那样,看上去互为对应。
由于是三维结构,它们不管怎样旋转都不会重合,就像我们的左手和右手那样,所以又叫手性分子。
对于非碳原子手性中心的分子,只要没有对称面和对称中心即为手性分子。
手性分子的基本标志一个化合物的分子与其镜像不能互相叠合,则必然存在一个与镜像相应的化合物,这两个化合物之间的关系,相当于左手和右手的关系,即互相对映。
这种互相对应的两个化合物成为对映异构体(enantiomers)。
这类化合物分子成为手性分子(chiral molecule)。
不具有对称面和对称中心的分子有一个重要的特点,就是实体和镜象不能重叠,镜面不对称性是识别手性分子与非手性分子的基本标志。
生物分子手性原则是什么生物分子都有手性,即分子形式的右撇子和左撇子(或左旋、右旋)。
在法国生物学家巴斯德发现酒石酸晶体的镜像后就更激起了科学家的兴趣。
然而,手性分子是如何形成的却一直让人迷惑不解。
过去,生物化学领域趋向于认为,单一手性形式的分子合成通常从一开始就要利用手性本体,也就是说生物分子自身在催化着手性形式的形成。
而且在一些化学反应中手性产物的形成进一步扩大了。
2006年6月16日出版的英国《自然》刊发文章称,最近,美国研究人员发现,物质的固(体)-液(体)相平衡可能参与了生物分子手性的形成。
比如,氨基酸固(体)-液(体)相的平衡,可以由刚开始时的小小的不平衡导致严重偏向一种手性形式,即左旋或右旋。
而这种现象出现在水溶液中,因而也可以解释生命起源以前的左手性和右手性,即为何左右手性数量相当的分子为何会转变成生物分子偏爱一种手性。
手性分子
纸面上旋转180° 纸面上旋转180° 180
= HO
CH3 H
OH
COOH
COOH
H
纸面上旋转90° 纸面上旋转90° 90
H CH3 OH H3C OH COOH
投影式不能离开纸面进行翻转。 2、 Fischer 投影式不能离开纸面进行翻转。 3、如果使Fischer 投影式中的一个基团保持 如果使Fischer 固定, 固定,而把另外三个基团顺时针或逆时针调换 位置,不会改变原化合物的构型。 位置,不会改变原化合物的构型。
外消旋体:等量左旋体与右旋体的混合物。 外消旋体:等量左旋体与右旋体的混合物。无 混合物 旋光性。 用 (±) 、RS或 (dl)表示。 旋光性。 ± 或 表示。 表示 (±) –乳酸 ± 乳酸
原因:一对映体,旋光度相等,旋光方向相反。 原因:一对映体,旋光度相等,旋光方向相反。 性质: 性质:外消旋体的物理性质与纯的单一对映体 比较有所不同。 比较有所不同。
课堂练习:问题 - 课堂练习:问题5-2
第二节
一、投影方法
费歇尔投影式
COOH
HO
H
CH3
把主链竖 立,编号 最小碳放 在上端
划十字线, 划十字线, 交点代表手性 横键向前, 碳,横键向前,竖键向 。
含有两个手性碳的手性分子的投影
CH3 HO
HO C C OH CH3 H
H OH CH3
H
H H3 C
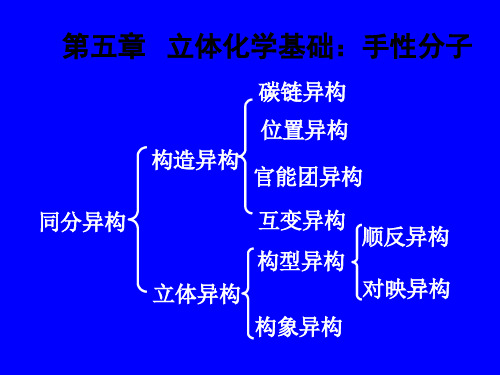
立体化学基础: 第五章 立体化学基础:手性分子
碳链异构 位置异构 构造异构 同分异构 立体异构 构象异构 官能团异构 互变异构 构型异构 对映异构 顺反异构
构造异构:分子组成相同而原子( 构造异构:分子组成相同而原子(团)相互连接方 异构 式和顺序不同 空间排列方式不同 立体异构:分子中原子( 立体异构:分子中原子(团)在空间排列方式不同
手性分子的判断方法

手性分子的判断方法手性分子是指具有非重合镜像的分子或物质。
它由手性中心、对映体、手性异构体等组成。
手性分子的判断方法包括物理方法、化学方法和计算方法。
物理方法是基于手性分子的光学活性性质进行判断的。
主要包括旋光度测定和比旋光度测定。
旋光度测定是通过测定物质对极化光产生的旋光角来判断其是否为手性分子。
极化光在通过手性分子后会分为两束独立的旋转的光线,其旋转方向和角度可测得并用来计算旋光度。
若旋光度不为零,则可以断定分子为手性分子。
比旋光度测定是通过测量两种对映体的旋光度差来判断其是否为手性分子。
一般情况下,两种对映体的旋光度差应该是固定值,若差值在测定误差范围内,则可以断定为手性分子。
化学方法是通过手性分子的反应性质判断其是否为手性分子。
主要包括光学活性试剂法和配位试剂法。
光学活性试剂法是用具有手性基团的试剂与待测分子进行反应,通过反应结果来判断待测分子是否具有手性。
如果存在转化物,则可以判定为手性分子。
配位试剂法是利用具有光学活性的配体与手性分子形成配合物,通过测定配合物的旋光参数来判断分子是否为手性分子。
如果配位物具有非零的旋光度,则可以断定分子为手性分子。
计算方法是通过计算分子的化学键、能级结构等参数来判断其是否为手性分子。
主要包括量子化学计算、密度泛函理论等方法。
量子化学计算是将分子的几何构型输入计算软件中,通过计算分子的最低能量结构和能级结构等参数来判断其是否具有手性。
如果计算结果表明存在非重合的镜像异构体,则可以判定分子为手性分子。
密度泛函理论是一种基于电子密度的理论计算方法,通过计算分子的电子密度来判断其手性性质。
如果电子密度分布在空间中不能通过旋转和平移使得与其镜像式重合,则可以断定分子为手性分子。
总结起来,手性分子的判断方法包括物理方法、化学方法和计算方法。
物理方法主要是通过旋光度和比旋光度测定来判断;化学方法主要是通过光学活性试剂法和配位试剂法来反应性质判断;计算方法主要是通过量子化学计算和密度泛函理论等方式进行计算分析来判断。
化学分子的手性研究

化学分子的手性研究手性是化学中一个重要的概念,它指的是物质在空间中的非对称性。
在化学分子中,手性是指分子的镜像和原始分子无法通过旋转和平移重合。
手性分子是由手性中心所引起的,在自然界中存在着大量手性分子的原因是其存在两种不对称的构型。
手性分子的研究在化学领域具有重要的理论和应用价值。
一、手性分子的定义和特点1. 定义:手性分子是指不对称的分子,其镜像和原始分子无法通过旋转和平移重合。
2. 特点:手性分子在物理、化学性质上与其非手性镜像分子有明显的差异,如旋光性、光学活性、生物活性等。
二、手性分子的研究方法1. 空间构型分析:通过X射线衍射、核磁共振等技术来确定分子内部的空间构型。
2. 旋光度测定:利用旋光度仪等仪器测定手性分子的旋光性。
3. 显示手性试剂:使用显示手性试剂,如酒石酸铵等,观察其对手性分子的特异性反应。
三、手性分子的应用领域1. 药物合成:药物分子通常都是手性的,研究手性分子的性质和构型有助于合成优异的药物。
2. 化学合成:手性催化剂在有机合成中起到重要作用,控制手性选择性能够合成具有特殊功能的化合物。
3. 生物领域:研究手性分子的生物活性和与生物体的作用,有助于理解生物分子的结构和功能。
四、手性分子的发展趋势1. 多功能手性分子的设计:通过合理设计手性分子的结构,实现多功能性质和应用。
2. 手性分子的催化研究:发展更高效、选择性更好的手性催化剂,促进有机合成反应的发展。
3. 生物手性研究:深入研究手性分子在生物体内的作用机制,为药物研发提供更多的信息。
综上所述,手性分子的研究在化学领域具有重要的意义。
通过研究手性分子的定义和特点、研究方法、应用领域以及发展趋势,可以更好地理解手性分子的性质和应用。
希望在未来的研究中,能够深入探索手性分子的奥秘,为科学研究和应用领域带来更多的突破和创新。
有机化学基础知识点整理手性分子的定义与分类

有机化学基础知识点整理手性分子的定义与分类手性分子的定义与分类手性分子是指具有非对称碳原子或其他不对称中心的分子。
在有机化学中,手性分子是一类非常重要的分子,它们的不对称性决定了它们在化学反应中特殊的性质和行为。
本文将对手性分子的定义和分类进行整理,以帮助读者更好地理解有机化学中的手性分子。
一、手性分子的定义手性分子是指在空间中无法与其镜像重合的分子。
手性分子具有两个互为镜像的异构体,称为对映异构体,即“左手”和“右手”。
这种对称性的缺失使得手性分子的物理性质和化学反应与非手性分子截然不同。
手性分子的不对称性通常来自于碳原子上的取代基或其他中心原子上的取代基的配置不同。
在有机化学中,碳原子上的取代基可以有四种不同的取代方式,即氢、烷基、卤素或其他取代基。
二、手性分子的分类手性分子可以根据其不对称中心的数量进行分类。
根据不对称中心的数量,手性分子可以分为单手性分子和多手性分子。
1. 单手性分子单手性分子是指只有一个不对称中心的手性分子。
在这种分子中,只存在两个对映异构体,即一对“左手”和“右手”。
典型的例子是乙醇分子(C2H5OH),它在空间中有一个不对称碳原子,因此存在两种对映异构体。
2. 多手性分子多手性分子是指具有两个或多个不对称中心的手性分子。
在这种分子中,存在更多的对映异构体。
多手性分子的对映异构体数量可以通过2的n次方计算,其中n是不对称中心的数量。
例如,丙二醇(C3H8O2)是一种多手性分子,它有两个不对称碳原子,因此存在4种对映异构体。
这些对映异构体可以用R和S来表示,以帮助区分它们的构型。
总结:手性分子是具有非对称碳原子或其他不对称中心的分子。
手性分子的不对称性决定了它们特殊的性质和行为。
根据不对称中心的数量,手性分子可以分为单手性分子和多手性分子。
对映异构体的存在使得手性分子的化学反应和物理性质与非手性分子有所不同。
理解手性分子的定义和分类对于研究有机化学以及相关领域的学生和科研人员非常重要。
有机化学基础知识点手性分子和手性中心
有机化学基础知识点手性分子和手性中心手性分子和手性中心是有机化学中重要的基础知识点。
在分子中存在手性中心的化合物称为手性分子,它们具有非对称的空间结构,在化学性质和生物活性上表现出与其镜像异构体不同的特性。
本文将介绍手性分子和手性中心的概念、性质及其在化学、药学领域中的重要应用。
一、手性分子的概念和性质手性分子是指分子结构中存在手性中心的有机化合物。
手性中心是指一个原子与四个不同的基团连接而形成的碳原子或其他原子。
根据手性中心的不对称性质,手性分子的镜像异构体称为对映异构体或镜像异构体。
手性分子的对映异构体之间在理论上是完全一样的,但在物理性质、化学性质、生物活性等方面却存在明显的差异。
手性分子的不对称性导致其旋光性质,即能使平面偏振光改变振动方向。
对映异构体的旋光性相等但方向相反,可以通过测定旋光度来区分和鉴定手性分子。
二、手性分子的分类和表示方法手性分子可以分为R体和S体两种类型,它们是通过Cahn-Ingold-Prelog规则进行分类的。
当四个连接在手性中心上的基团按照优先级由高到低顺序排列时,如果顺时针方向排列则为R体,逆时针方向排列则为S体。
表示手性分子时一般使用立体式投影图或楔形/横杠式表示,以准确展示手性中心的立体构型。
三、手性分子的化学性质手性分子的化学性质常常与它们的对映异构体有明显的差异。
例如,L-和D-丙氨酸是两种对映异构体,具有完全相同的化学成分,但在生物活性、酶的反应速率、光学活性度等方面存在差异。
这是由于生物体内的酶对手性分子的选择性较强,可以与特定的对映异构体发生特定的反应。
四、手性分子的应用领域手性分子在化学合成、医药研究等领域有广泛的应用。
在有机合成中,手性催化剂可以选择性地催化手性底物的反应,从而有效合成目标手性化合物。
在药学领域,由于手性分子的对映异构体在生物活性方面的差异,合成和使用手性药物成为一种重要的手段。
通过选择性制备特定手性的药物,可以提高治疗效果,减少副作用。
手性分子的概念
手性分子的概念把手性分子作为一种新概念来关注,虽然已经有一段时间了,但手性分子还是相当有意义的一个概念,它不仅有着丰富的应用前景,而且在理论上也具有十分重要的地位。
手性分子指的是一种具有不对称结构的分子,它可以是有机分子,也可以是无机分子。
由于它们的结构不对称,它们在物理和化学上的性质也将会不对称,从而对生命的过程有着重要的影响。
可以说,手性分子是生命的基础,它可以改变生物体的物理和化学性质,从而控制许多生命过程,如果没有手性分子,我们没有办法掌握生命的奥秘,就不可能有任何生物存在。
那么,什么是手性分子?它是一类具有异构结构的分子,也就是说,一个分子的结构可以由两个或多个结构不同的部分组成,这些部分是相互竞争和互补的,它们的反应路线也是不同的,可以产生不同的效果。
手性分子的存在是因为它的结构不对称,它可以具有两种不同的反应路线,称为aldiabatic和diabatic。
aldiabatic反应路线指的是分子在不变形的情况下,能够被一个外部力场改变它们的内部结构,从而产生新的反应,而diabatic反应路线则指的是分子结构可以被外界力场改变,但这种改变是可逆的。
手性分子有其独特性,它们可以把生物体们被一般的有机分子所没有的差异化,从而为生物体提供了更多的变化能力,这也就是为什么它们在生命过程中如此重要的原因。
此外,手性分子也能用于工业制造,例如陶瓷、新材料等,因为它们本身的特性,可以赋予材料一种新的性质,例如磁性、耐高温性等,从而为工业制造提供新的技术。
综上所述,手性分子是一种相当重要的分子,可以影响生物体生理和化学性质,也可用于工业制造,是一种有着广泛应用前景的概念。
未来可期,随着手性分子的研究及应用的深入,将为科学研究和社会发展带来更多福祉。
手性名词解释
手性名词解释
手性是指物质分子在反洗过程中,结果产生的立体形态,也可以被称为立体化学“ chirality”。
根据物质的反洗属性,手性分子可以分为正手性(dextro-)和反手性(laevo-)两种。
跟普通的分子不一样,经过反洗之后,手性分子可以分辨不同的右旋、左旋形式,右旋与左旋之间会有化学特性上的差异。
手性分子的产生
手性分子一般是由极性分子组成的,比如有碳原子、氢原子和氧原子,它们彼此构成了一种具有空间分布的结构。
手性分子的形成有几种情况,其中最重要的一种是通过自动分析和反洗的反应,当原料分子参与了这样的反应,就可以生成一种新的手性分子。
另外,也有一些合成有机物质可以作为原料分子,它们也可以经过反洗反应而形成手性分子。
手性物质的应用
手性分子的应用比较广泛,它们可以应用在药物、农药、染料、香精香料领域中。
1、药物领域:手性分子可以用来制造一些特异性的药物,包括镇静剂、抗组胺药物以及抗病毒药。
2、农药领域:手性分子也可以用作植物抗虫剂,以提高植物的抗虫能力。
3、染料领域:手性分子可以用于制造一些特异性的染料,它们可以用来染色棉、毛织物或者粘合剂,以保护染色衣料或织物的颜色
不会变色。
4、香精香料:手性的分子也可以用作香精香料,它们可以增强食品或者饮料的口感,以满足消费者的口味偏好。
总结
从上面可以看出,手性分子在化学反应中起着重要的作用,它们可以用来制造一些特异性的物质,并在药物、农药、染料、香精香料领域中都有广泛的应用,以帮助人类更好的利用物质的空间结构。
未来,手性分子的应用将会有更多的发展,会成为更多化学研究的重要组成部分。
手性分子的判断方法
手性分子的判断方法手性分子是指旋光性质不可重叠镜像异构体,即左旋与右旋镜像异构体。
手性分子在化学和生物学领域中起着重要的作用。
判断一些分子是否是手性分子,通常可以通过以下三种方法进行。
1.对称性分析法2.手性圆二色谱法3.X射线晶体学分析法接下来,我们将详细说明这三种方法。
1.对称性分析法:对称性分析法是一种简单且直观的方法,用于判断分子是否具有手性。
具体步骤如下:(1)确定分子是否具有对称面,即分子可以对称折叠。
如果分子有平面对称面,那么它是一个非手性分子。
(2)确定分子是否具有中心对称。
中心对称分子是指具有旋转轴并且轴上的每一点都与该轴上的一个等距离的点对称。
如果分子具有中心对称,则为非手性分子。
(3)如果分子不具有对称面或中心对称,则可能是手性分子。
需要进一步进行实验确认。
2.手性圆二色谱法:手性圆二色谱法是一种通过测量手性分子的光学活性来确定其手性性质的方法。
它利用分子的吸收螺旋度、光旋和偏振度来进行分析。
具体步骤如下:(1)用手性圆二色仪测量样品在可见光区域的吸光度。
(2)比较左旋和右旋样品的吸光度。
如果两者相等,则该分子是非手性的。
(3)如果左旋和右旋样品的吸光度不相等,则该分子是手性的。
3.X射线晶体学分析法:X射线晶体学是一种用于确定有机化合物和无机化合物的分子结构的方法。
它可以提供有关分子的空间排列和立体构型的信息。
具体步骤如下:(1)生长手性晶体。
在晶体生长过程中,手性分子会形成手性晶体,而非手性分子不会。
(2)通过X射线衍射确定晶体结构。
X射线通过晶体时会产生衍射,通过分析衍射图样可以确定晶体的三维结构。
(3)通过晶体结构确定分子手性。
在分析晶体结构的过程中,可以观察到分子的手性特征,从而确定分子的手性性质。
总结起来,对称性分析法是一种简单而常用的方法,而手性圆二色谱法和X射线晶体学分析法则是用来对手性分子进行更准确的判断和确认的方法。
这些方法在判断分子手性性质和研究手性分子在化学和生物学中的作用方面具有重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
*
H HOH 2C
*
H H
H H
H
CH 2OH
H
COOH
HOOC
H
环丙烷二羧酸
HOOC
COOH
内消旋体
H
H
HOOC
H
H
COOH
H
COOH
HOOC
H
八、不含手性碳的手性分子 1、丙二烯型化合物
H3C H C=C=C
CH3 H
2、连苯型化合物
Cl Cl
Cl Cl
HOOC
COOH
HOOC COOH
九、外消旋体的拆分
注: 1)不能任意调换两基团的位置,
2)将投影式在纸面内平移或转动180°时,分子 构型保持不变;
3)离开纸面翻转180°或在纸面内旋转90°的奇 数倍,构型反转。
四、构型的标记
1)D-L标记法——相对构型标记
CHO H OH CH2OH HO CHO H CH2OH
D-(+)- 甘油醛
L-(-)- 甘油醛
溶解度 相对密度 g(100g水)-1 (20℃)
pKa1
2.93
2.93 3.11 2.96
pKa2
4.32
4.32 4.80 4.24
(2R,3R) 170 2S,3S Meso-酸 170 140
139
139 125 20.6
1.760
1.760 1.667 1.680
(±)-酸 206
讨论: 内消旋体与外消旋体的异同:
COOH OH OH COOH
* CHCOOH OH
COOH HO HO H H COOH
(2R,3R)-
(2S,3S)-
(2S,3R)
象这种分子中含有两个或两个以上手性碳,却不是手性分 子,因而也没有旋光性的化合物,称为内消旋体。
表3-9 酒石酸的物理性质
酒石酸
熔点℃
[α]D25℃
+12°
-12° 无 无
一、手性分子和对映异构
COOH COOH
H OH CH3
H CH3 OH
手性:一个物体若与其镜像不能重合,称这个物体具 有手性;也叫手征性 不能与自身镜像重合的分子称为手性分子。 一个分子是否具有手性与其对称性有关: 1)对称面 若有一个平面把分子分成两半,这两半是实物与镜 像的关系,则此平面是分子的对称面。用σ表示。
[α]D25℃
-31.3°(乙酸乙酯) +31.3°(乙酸乙酯) -9.4°(水) +9.4°(水)
熔点(℃)
173 173 外消旋体146 167 167 外消旋体153
2,3-二羟基丁二酸(酒石酸):
COOH H HO OH H COOH HO H COOH H OH COOH H H
* HOOCCH OH
练习: 1、用R-S标记法给下列化合物命名
COOH 1) C CH3 Cl CH2OCH3 4) Cl H CH3 H COOH 2) NH2 C H 5) HO CH3 C2H5 H CH3 Cl 3) H C CH3 Br
答案:1)R-2-氯丙酸,2)S-2-氨基丙酸,3)S-1-氯-1-溴乙烷。 4)R-1-甲氧基-2-氯丙烷, 5)S-2-羟基丁烷
* HOOCCH Cl
* CHCOOH OH
Cl
COOH
(Ⅰ) 2R,3RCOOH HO H H Cl COOH
(Ⅱ)2S,3SCOOH H Cl OH H COOH
(Ⅲ)2R,3S-
(Ⅳ) 2S,3R-
表3-8 氯代苹果酸的物理性质
异构体
Ⅰ Ⅱ Ⅲ Ⅳ
构型
(2R,3R)(2S,3S)(2R,3S)(2S,3R)-
1)二者都无旋光性; 2)内消旋体是纯的非手性物质,而外消旋体 是一对对映体的等量混合物; 3)内消旋体不可拆分,而外消旋体可拆分。
七、环状化合物的对映异构 常常同时有顺反异构和对映异构 1)判断顺反异构,2)判断手性;3)讨论对映异构 如:2-羟甲基环丙烷-1-羧酸
HOH 2C COOH
HOOC CH 2OH
OH * * HN O OH * CHCl2
氯 霉 素
(R)-form, 有 效 异 构 体 (S)-form, 无 效 异 构 体 O OH * OH H N N H * OH Ethambutol (S)-form, 治 疗 结 核 病 (R)-form, 致 盲
手性分子
以三维空间研究物质的结构和性质的化学称为 立体化学。
HO H C CH3
C c a
Rb
COOH
C d c
a
OH.>COOH>CH3>H
R-乳酸(R-2-羟基丙酸)
S-
在菲舍尔投影式
a d c b
d a
如果:a > b > c > d
a a c d b
c b R-
b d
c
S-
S-
R-
顺时针:Sd在横键上 逆时针:R-
d在竖键上
逆时针:S-
顺时针:R-
Cl Cl
C Cl H H Cl
C H H
2)对称中心
若分子中有一点,从分子中的任一原子或基团出发,向 该点引一直线,若在距该点等距离处,有一相同的原子 或基团,这点是对称中心,用i表示。
Cl H H CH3
i
CH3 H H Cl
凡是分子中具有对称面或对称中心的分子一般是 非手性分子;反之分子具有手性。
COOH
COOH
HO CH 3
H
H
CH 3
OH
L-(+)-乳酸
D-(-)-乳酸
注:D、L与左右旋无关,D、L表示相对构型; 而左、右旋通过旋光仪测定结果。
2) R-S标记法——绝对构型标记法:
2) R-S标记法——绝对构型标记法
b
若a>b>c>d, d在离视线最远处; d 若a>b>c为“顺”——R型 若a>b>c为“逆”——S型
构型表示法的互换
H Cl H3 C H Br CH 3 H CH 3 Cl CH 3 H Br H Cl CH 3 H Br CH 3 Cl H Br H H Cl CH 3 CH 3 CH 3 CH 3 Br H
五、含一个手性碳原子化合物的对映异构
1、手性碳:常用“*”表示
* CH3CHCOOH
六、含多个手性碳原子化合物的对映异构体
A(S) B(R)
A(R) B(S)
A(R) B(R)
A(S) B(S)
对映体非对映体 对映体
分子中含有n个手性碳的化合物,最多有 2n 个对映异构 体,有2n-1对对映异构体。
2-羟基-3-氯丁二酸(氯代苹果酸)
COOH HO Cl H H COOH H H COOH OH
在许多情况下,化合物的一对对映体在生物体内的药理活性、 代谢过程、代谢速率及毒性等存在显著的差异。
H2N PhH2C
H COOH
H HOOC
NH2 CH2Ph
(S)-Phenylalanine Bitter taste
“苦”
(R)-Phenylalanine Sweet taste
“甜”
O N NH O O Thalidomide (R)-form, 镇 静 剂 (S)-form, 严 重 致 畸 O NHMe * Cl Ketamine (S)-form, 麻 醉 剂 (R)-form, 致 幻 剂 Penicillamine (S)-form, 治 疗 关 节 炎 (R)-form, 突 变 剂 HS * NH2 O O 2N
尼克尔 棱 镜
普通光线
平面偏振光
2)旋光性
介质
能使偏振光发生偏转的性质,称为旋光性;具有这 种性质的物质,称为旋光性物质(光活性物质); 反之 为非光活性物质。 使偏振光振动方向旋转的角度称为旋光度,用α表示。 使偏振光振动方向向左旋称为左旋体,用“-”表示; 向右旋的称为右旋体,用 “+”表示。
注:
①凡是手性分子,都有旋光性; 非手性分子无旋光性 ②一对对映体对偏振光的作用正好相反,一个使偏 振光左旋,一个使之右旋,旋光度数值相等。
3)旋光性的测量 用旋光仪进行测量。
A B C D
A' B' D'
A
乳酸
α
目镜(亮)
A'
旋光性物质
起偏镜
盛液管
检
l C
α旋光仪中读到的旋光度; l 盛液管的长度;(dm) C 溶液的浓度;(g/ml)
(1)机械拆分法 (2)微生物拆分法 (4)诱导结晶拆分法
(3)选择吸附拆分法
(5)化学拆分法
小结:
1、理解手性、旋光性、对映异构的概念 2、熟练掌握构型的标记方法 3、熟练掌握构型式的透视式和菲舍尔投影式之间的 相互转化。
OH
含有一个手性碳原子的化合物,一定是手性分子。 有一对对映体,其中一个是左旋,一个是右旋。 如乳酸: [α]D15 = + 3.8°, [α]D15 = -3.8°
外消旋体:等量的左、右旋体的混合物 注意:①外消旋体没有旋光性; ②外消旋体与其左、右旋体的物理性质不同; ③一般的物理方法不能分离外消旋体。
比旋光度与入射光的波长、温度有关, 如葡萄糖: 25 D 52.5
三、构型的表示方法 1)球棒模型
COOH
H OH CH3
COOH C OH
2)透视式(或伞形式)
H
透视式
CH3
“楔前虚后实平面”
3)菲舍尔(Fischer)投影式
COOH HO CH3 H
