6附件2 校准品
CFDA:体外诊断试剂抽验工作方案

CFDA:体外诊断试剂抽验工作方案第一篇:CFDA:体外诊断试剂抽验工作方案CFDA:体外诊断试剂抽验工作方案食药监械监便函〔2015〕37号附件.doc体外诊断试剂抽验工作方案为查找体外诊断试剂产品监管隐患,全面了解质量安全状况,切实加强相关产品监管,根据《食品药品监管总局办公厅关于印发体外诊断试剂质量评估和综合治理工作方案的通知》(食药监办械监〔2015〕55号)要求,特制定本方案。
一、抽验方式和品种本次抽验工作包括监督抽验和风险监测,共涉及16种体外诊断试剂产品和2种原材料(见附件1)。
(一)监督抽验1.对丙氨酸氨基转移酶测定试剂等10种产品(附件1中1—10)同时开展国家级监督抽验(以下简称国抽)和省级监督抽验(以下简称省抽)。
其中,总局选取上述品种的部分生产企业和进口产品国内代理商开展国抽(见附件2),各省对本行政区域内上述各品种的其他生产企业开展省抽。
2.对总蛋白测定试剂等6种产品(附件1中11—16)开展省抽。
各省对本行政区域内上述品种生产企业开展监督抽验(见附件2、3)。
(二)风险监测对体外诊断试剂生产环节、使用环节以及国内外同类产品和近效期产品开展质量风险监测。
1.生产环节质量风险监测:对部分省(市)体外诊断试剂生产用水和还原型辅酶I两种原材料(附件1中17—18)进行风险监测。
其中,北京市局在本行政区域内体外诊断试剂生产企业抽取生产用纯化水和还原型辅酶I各20批次,浙江省局在本行政区域内体外诊断试剂生产企业抽取生产用纯化水20批次(见附件4)。
北京市医疗器械检验所和浙江省医疗器械检验院承担样品的检验工作(见附件5)。
抽样同时,上述两省(市)局还应开展相关调研工作(见附件6、7)。
2.使用环节质量风险监测:对部分省(市)的总蛋白测定试剂等6种产品(附件1中11—16)在使用环节的质量进行风险监测(见附件3)。
其中,天津、河北、黑龙江、辽宁、江西、福建、云南、重庆、广西、海南等省(区、市)局负责上述产品在使用环节的抽样工作(见附件2)。
体外诊断试剂校准品(物)质控品(物)研究技术指导原则

体外诊断试剂校准品(物)质控品(物)研究技术指导原则本研究技术指导原则基于国家食品药品监督管理局《体外诊断试剂注册管理办法(试行)》、《医疗器械标准管理方法》的相关规定。
参考国际标准化组织(ISO)、美国食品药品监督管理局(FDA)、临床化学国际联合会(IFCC)等有关体外诊断试剂方面的指南,对编写的格式及各项内容的要求进行了详细的说明。
其目的是为体外诊断试剂校准品、质控品单独注册申报进行原则性的指导,同时,也为注册管理部门审核体外诊断试剂校准品、质控品提供参考。
一、范围应明确陈述本标准规范的对象和所涉及的方面,指明使用的界限。
二、规范性引用文件应包括引导语和规范性引用文件的一览表。
一览表中引用文件的排列顺序为:国家标准、行业标准、国际标准及规范性文件等。
例如:下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T1.1-2000标准化工作导则第1部分:标准的结构和编写规则GB/T191-2000包装储运图示标志ISO17511体外诊断医疗器械生物源性样品中量的测量校准品和质控物质赋值的计量学溯源性ISO18153体外诊断医疗器械生物源性样品中量的测量校准品和控制物质中酶催化浓度赋值的计量学溯源性三、分类和组成及其它(一)组成成份(二)标示值应注明校准品赋值及不确定度、质控品的赋值及允许范围,非定值质控品没有指定的参考范围,可以通过在标贴上标示目标浓度(如:低、高、中)表示。
(三)规格应注明规格。
(四)用途应详细注明校准品、质控品的预期用途。
(五)稳定性(六)校准品溯源性,校准品、定值质控品互换性、赋值统计学处理校准品应有溯源性要求。
计量学溯源链的说明应始于校准品产品的值,止于所使用的计量上最高参考标准。
关于体外诊断试剂校准品溯源和质控品赋值的溯源性说明

天津市体外诊断试剂校准品和质控品技术审查要点1范围本文规定了对建立或确认测量正确度为目的的校准品和质控品赋值的计量学溯源性进行确认的方法,校准品和质控品由生产企业提供,作为体外诊断试剂的一部分或与其一起使用。
适用于体外诊断试剂校准品和质控品的技术审查。
2规范性引用文件下列文件中的条款通过本说明的引用而成为本说明的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本说明,然而,鼓励根据本说明达成协议的各方研究是否可以使用这些文件的最新版本。
凡是注日期的引用文件,其最新版本适用于本说明。
GB/T 21415 - 2008/ISO 17511: 2003 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源GB/T 19702 - 2005/ISO 15193: 2002 体外诊断医疗器械生物源性样品中量的测量参考测量程序的说明GB/T 19703 - 2005/ISO 15194: 2002 体外诊断医疗器械生物源性样品中量的测量参考物质的说明3术语与定义下列术语与定义适用于本说明3.1计量学溯源性 metrological traceability通过一条具有规定不确定度的不间断的比较链,使测量标准的值能够与规定的参考标准,通常与国家标准或国际标准联系起来的特性。
3.2国际标准品具有最高的计量学特性,其值不必参考相同量的其他标准,被指定或普遍承认的测量标准。
3.3国家标准品用国际标准品标定的,或我国自行研制的(尚无国际标准品者)用于微生物(或其产物)的定性鉴定或疾病诊断的生物试剂、生物材料或特异性抗血清。
3.4企业标准品通过与相同量的国际(国家)标准品和/或进口(国产)试剂比对而定值的测量标准。
3.5浓储液使用国家标准品和/或企业标准品赋值,作为企业标准品和或校准品配制过程中的母液。
3.6校准品 Calibritaor具有在校准函数中用作独立变量值的参考物质。
载脂蛋白A1、B校准品产品技术要求华宇亿康

载脂蛋白A1、B校准品适用范围:本校准品与本公司生产的载脂蛋白A1、B测定试剂盒(免疫比浊法)配套使用,用于载脂蛋白A1、B检测系统的校准。
1.1 产品型号/规格冻干粉型(复溶体积):6×1mL;1×1mL。
1.2 主要组成成分本校准品以人血清为基质,并添加了特定项目的生物源性物质和化学成分,具体内容见下表。
表1 载脂蛋白A1、B校准品主要组成成分注:校准品具有批特异性,具体浓度见值单。
2.1 外观和性状2.1.1 外包装完整无破损;中文包装标签应清晰、准确、牢固。
2.1.2 本校准品应为白色至浅黄色冻干粉;复溶后应为浅黄色或黄色透明液体,无浑浊,无未溶解物。
2.2 水分含量水分含量应不大于5%。
2.3 量值溯源依据GB/T 21415有关规定建立溯源性,量值溯源见表1,赋值过程见附录。
2.4 赋值结果及其不确定度的表示方式赋值结果±扩展不确定度。
2.5 正确度︱≤1。
各项目量值传递的正确度应符合︳En2.6 均匀性2.6.1 瓶内均匀性各项目的瓶内均匀性变异系数(CV)应不大于10%。
瓶内2.6.2 瓶间均匀性)应不大于10%。
各项目的瓶间均匀性变异系数(CV瓶间2.7 稳定性2.7.1 复溶稳定性复溶后的校准品密封保存于2 ℃~8 ℃、避光环境中,可稳定3天;复溶后的校准品密封保存于不高于-18℃、避光环境中,可稳定10天。
在稳定期内赋值结果的变化趋势不显著。
2.7.2 效期稳定性校准品保存于2 ℃~8 ℃,有效期为24个月。
在有效期内赋值结果的变化趋势不显著。
体外诊断试剂校准品(物)、质控品(物)研究技术指导原则57 校准品word版本

体外诊断试剂校准品(物)、质控品(物)研究技术指导原则体外诊断试剂校准品(物)(包括真实度控制品)、质控品(物)(简称校准品、质控品)是实现体外诊断试剂临床检测及监督检验结果准确一致的主要工具,也是保证量值有效传递的计量实物标准。
校准品、质控品研究技术资料应包括产品技术要求、试验方法等重要信息,是指导注册申请人(简称申请人)单独申请注册校准品、质控品的重要技术性文件之一。
本研究技术指导原则基于国家食品药品监督管理局《体外诊断试剂注册管理办法(试行)》、《医疗器械标准管理方法》的相关规定。
参考国际标准化组织(ISO)、美国食品药品监督管理局(FDA)、临床化学国际联合会(IFCC)等有关体外诊断试剂方面的指南,对编写的格式及各项内容的要求进行了详细的说明。
其目的是为体外诊断试剂校准品、质控品单独注册申报进行原则性的指导,同时,也为注册管理部门审核体外诊断试剂校准品、质控品提供参考。
由于校准品、质控品种类多、范围广、临床使用重要性强且使用目的差别大,因此,申请人应根据产品特点及临床使用目的编写技术资料,以便于关注者获取准确的信息。
申请人应该提供校准品、质控品产品标准和技术资料,技术资料的要求参见《体外诊断试剂注册管理办法(试行)》。
产品标准格式和具体内容如下(不限于):一、范围应明确陈述本标准规范的对象和所涉及的方面,指明使用的界限。
二、规范性引用文件应包括引导语和规范性引用文件的一览表。
一览表中引用文件的排列顺序为:国家标准、行业标准、国际标准及规范性文件等。
例如:下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1.1-2000 标准化工作导则第1部分:标准的结构和编写规则GB/T 191-2000包装储运图示标志YY 0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号ISO 17511 体外诊断医疗器械生物源性样品中量的测量校准品和质控物质赋值的计量学溯源性ISO 18153 体外诊断医疗器械生物源性样品中量的测量校准品和控制物质中酶催化浓度赋值的计量学溯源性三、分类和组成及其它(一)组成成份应说明主要组成成份及其生物学来源。
常规生化复合校准品常规生化复合校准品
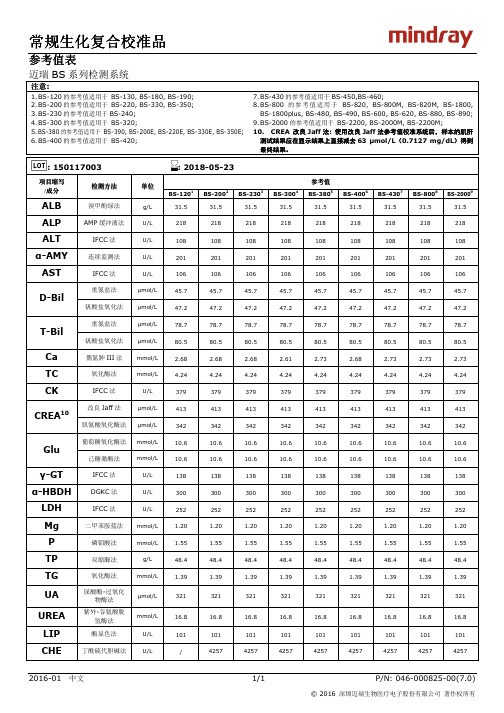
最终结果。
: 150117003
: 2018-05-23
项目缩写 /成分
ALB ALP ALT α-AMY AST
检测方法
溴甲酚绿法 AMP 缓冲液法
IFCC 法 连续监测法
IFCC 法
单位
g/L U/L U/L U/L U/L
16.8 101 4257
10.6 10.6 138 300 252 1.20 1.55 48.4 1.39 321
16.8 101 4257
10.6 10.6 138 300 252 1.20 1.55 48.4 1.39 321
16.8 101 4257
2016-01 中文
1/1
P/N: 046-000825-00(7.0)
丁酰硫代胆碱法
U/L
/
10.6 10.6 138 300 252 1.20 1.55 48.4 1.39 321
16.8 101 4257
10.6 10.6 138 300 252 1.20 1.55 48.4 1.39 321
16.8 101 4257
10.6 10.6 138 300 252 1.20 1.55 48.4 1.39 321
342
78.7 80.5 2.68 4.24 379 413 342
78.7 80.5 2.68 4.24 379 413 342
78.7 80.5 2.61 4.24 379 413 342
78.7 80.5 2.73 4.24 379 413 342
78.7 80.5 2.68 4.24 379 413 342
C反应蛋白校准品产品技术要求shijiwode

C反应蛋白校准品
适用范围:与本公司生产的试剂盒配套使用,用于C反应蛋白项目检测系统的校准。
1.1包装规格
0.5mL×1;0.5mL×5;1mL×1;1mL×5;10mL×1;10mL×5。
1.2主要组成成分
液体,单水平,PBS缓冲液(0.01M,pH7.4),C反应蛋白目标浓度为106mg/L。
校准品靶值批特异,详见校准品瓶签。
2.1 外观
无色澄清液体。
外包装完整无破损。
2.2 装量
不低于标示装量。
2.3 瓶内均一性
瓶内变异系数CV≤10%。
2.4准确度
用产品校准品定标后,测试ERM-DA474/IFCC,测定结果的相对偏差应不超过±15%。
2.5 稳定性
2.5.1效期稳定性
原包装校准品在2℃~8℃密闭贮存,有效期为12个月。
在有效期满后2个月内,校准品性能指标应符合2.1、2.3、2.4的要求。
2.5.2校准品开瓶稳定性
开瓶后校准品在2℃~8℃条件下密闭贮存,可稳定30天。
在有效期满后2天内,测试结果的相对偏差不超过±10%。
2.6校准品溯源性
按照GB/T21415及有关规定建立溯源性,提供校准品的来源、赋值过程及测量不确定度等内容,溯源至ERM-DA474/IFCC。
高低密度脂蛋白胆固醇校准品产品技术要求北检

高/低密度脂蛋白胆固醇校准品
适用范围:本产品用于本公司高密度脂蛋白胆固醇测定试剂盒和低密度脂蛋白胆固醇测定试剂盒的系统校准。
1.1 规格
具体产品规格见下表:
1.2 组成成分
高密度脂蛋白胆固醇(1.0~1.8)mmol/L 低密度脂蛋白胆固醇(3.1~4.2)mmol/L 本校准品以血清为基质
校准品有批特异性,具体靶值见靶值表。
2.1 外观
2.1.1 外包装完整无破损;
2.1.2 浅黄色冻干粉,复溶后为浅黄色溶液,无不溶物。
2.2 准确度
测试有证参考物质(CRM)或其他公认的参考物质3次,相对偏差应不超过±10%。
2.3 重复性
用试剂测定1瓶校准品,重复测试10次,CV≤5%。
2.4 瓶间差
用试剂测定同一批号的10瓶校准品各1次,并测定上述10瓶中的1瓶,重复测定10次,CV≤5%。
2.5 含水量
随机抽取效期内同一批号的冻干粉3瓶,含水量≤5%。
2.6 稳定性
2.6.1 效期稳定性
原包装校准品2~8℃避光储存,有效期12个月。
效期后1个月内产品应符合2.2要求。
2.6.2 复溶稳定性
a)校准品复溶后,2~8℃避光密闭储存,可以稳定3天,在满3天时检测,结果应符合2.2要求。
b)校准品复溶后,-20℃避光密闭储存,可以稳定15天,在满15天时检测,结果应符合2.2要求。
2.7 校准品溯源性
按照GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求提供校准品的来源、赋值过程以及测量不确定度,该校准品溯源至本公司企业校准品,企业校准品溯源至参考物质。
