western转膜条件
20kd 转膜条件

20KD 转膜条件转膜(Western blotting)是一种用于检测特定蛋白质在凝胶电泳后是否存在于样品中的技术。
"20kD"指的是分子量约为20千道尔顿(kDa)的目标蛋白。
转膜条件需要根据实验的具体需求和所使用的膜材料来调整,以下是一些通用的转膜条件:1. 转膜时间:通常情况下,转膜时间取决于蛋白的大小和转移效率。
对于小分子量的蛋白(如20kD),转膜时间可能需要较短,比如1小时左右,以避免过度转膜导致大分子蛋白的丢失。
2. 转移电压:电压的选择通常基于实验的规模(如小规模或大型凝胶)和转膜系统。
对于小规模凝胶,常用的电压是80-100V;而对于大型凝胶,可能需要更高的电压,例如200-300V,以缩短转膜时间。
3. 转移缓冲液:最常用的转移缓冲液是含有甲醇的Tris-甘氨酸缓冲液(TGB),甲醇有助于紧密结合蛋白和膜,并提高转膜效率。
缓冲液的pH值通常为8.3。
4. 转膜膜材料:对于小分子量的蛋白质,通常推荐使用聚偏氟乙烯(PVDF)膜,因为它具有较高的亲蛋白性和较强的结合能力。
5. 转膜系统:根据实验室的设备和资源,可以使用湿式转膜系统或半干式转膜系统。
湿式转膜系统通常提供更均匀的转移效果,适合于对转膜质量要求较高的实验。
6. 转膜后处理:转膜完成后,需要使用封闭液(如5%脱脂牛奶或BSA)封闭膜上未被蛋白质占据的部位,以减少非特异性结合。
7. 检测方法:根据目标蛋白的性质选择合适的检测方法,如化学发光、荧光或酶标记等。
需要注意的是,上述条件仅供参考,实际操作中应根据实验目的和所用材料的具体特性进行优化。
例如,某些情况下可能需要在较低的电压下延长转膜时间,或者在转移缓冲液中加入SDS以提高小分子蛋白的转移效率。
此外,转膜效率也受到样品量、凝胶浓度、膜的孔径大小等因素的影响。
因此,建议进行预实验以确定最佳的转膜条件。
western转膜

Western 转膜方法及转膜仪使用说明实验前准备:转移缓冲液: 甘氨酸(MW75.07)2.9gTris(MW121.14)5.8gSDS 0.37g甲醇200ml蒸馏水至1000ml先用蒸馏水溶解甘氨酸、Tris和SDS,然后再加入甲醇,最后补足液体。
如果先加入甲醇,溶解甘氨酸、Tris和SDS等比较困难(可以配制成2×转移缓冲液进行保存,稀释后使用)。
缓冲液可室温保存,但最好保存在4度冰箱,可重复使用3~5次(最多使用5次左右,不然影响转移效率)。
TBS缓冲液: 1 mol/L Tris·HCl(pH7.5)10mlNaCl 8.8g蒸馏水至1000ml(可以配制成10×TBS缓冲液进行保存,稀释10倍使用)TBST缓冲液: 20%Tween20 1.65mlTBS 700ml混匀后即可使用,最好现用现配。
封闭液:BSA 0.5gTBST 100ml最好现用现配。
操作步骤:(一)SDS-PAGE电泳样品准备:取出上样样品至1.5ml的EP管中,加入5×SDS 上样缓冲液至终浓度为1×。
加足够的电泳液后开始准备上样。
(电泳液至少要漫过内测的小玻璃板。
)用微量进样器贴壁吸取样品,将样品吸出不要吸进气泡。
将加样器针头插至加样孔中缓慢加入样品。
(加样太快可使样品冲出加样孔,若有气泡也可能使样品溢出。
加入下一个样品时,进样器需在外槽电泳缓冲液中洗涤数次,以免交叉污染)(二)电泳浓缩胶时用80V跑1h左右,到分离胶以后用120跑,总时间3h左右)。
电泳至溴酚兰刚跑出即可终止电泳,进行转膜(如果目的条带比较大的话,最好使用可视的蛋白marker)。
(三)转膜(1)转一张膜需准备滤纸和1张PVDF膜。
切滤纸和膜时一定要戴手套,因为手上的蛋白会污染膜。
将切好的PVDF膜置于水上浸10min才可使用。
(用镊子捏住膜的一边轻轻置于有超纯水的平皿里,要使膜浮于水上,只有下层才与水接触。
western转膜条件

western转膜条件蛋白来源:RAW264.7 总蛋白蛋白名称(可保密):一些转录因子蛋白分子量:40~70 KDWB用膜类型、孔径:0.45 NC转膜方式(恒压、恒流):湿转恒流400 mA转膜时间:60~90 minPS.其实吧,以我的经验来看,除非目的蛋白特别小,或者特别大,不然转膜时间真的不是那么重要,曾经因为失误,转了15 min就拆下来了,但从丽春红染色来看,跟平常实验也没有太大的区别。
蛋白来源:内皮细胞总蛋白蛋白名称(可保密):occludin & AKT蛋白分子量:65 KD & 56 KDWB用膜类型、孔径:0.45 PVDF转膜方式(恒压、恒流):湿转恒压100 V转膜时间:60~70 min设备名字是“Bio-Rad min i”。
蛋白来源:乳鼠心肌细胞和成年鼠心肌组织总蛋白和核蛋白蛋白名称(可保密):保密蛋白分子量:65 KD & 55 KDWB用膜类型、孔径:PVDF(预先用甲醇处理)转膜方式(恒压、恒流):半干转恒压12 V转膜时间:30-40 min设备:“Bio-Rad mini”建议:最开始做过湿转(过夜的那种),太费事费时,效果也不如半干转。
蛋白来源:293T细胞蛋白名称(可保密):蛋白分子量:95 KD & 35 KDWB用膜类型、孔径:PVDF转膜方式(恒压、恒流):湿转恒压90 V-110 V,控制电流不要超过300 mA。
转膜时间:70 min蛋白来源:肿瘤手术标本蛋白名称(可保密):转录因子蛋白分子量:33 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):350 mA 恒流转膜时间:150 min转膜设备:湿转Bio-Rad说明:相同条件曾用于数个30-70 KDa的蛋白,都能成功转上,不过没有试缩短时间效果如何;实验时没为转膜条件苦恼,倒是电泳时胶的浓度及时间根据不同分子量而有区别。
蛋白来源:成纤维细胞蛋白名称(可保密):smad3蛋白分子量:54 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):350 mA 恒流转膜时间:150 min转膜设备:湿转Bio-Rad蛋白来源:胰腺癌细胞蛋白名称(可保密):蛋白分子量:16 KDa and 42 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):120 V 恒压转膜时间:90 min转膜设备:湿转Bio-Rad蛋白来源:大鼠血管平滑肌细胞蛋白名称(可保密):保密蛋白分子量:72 KD,42 KD 和22 KDWB用膜类型、孔径:一般的PVDF膜转膜方式(恒压、恒流):湿转,恒流一张膜0.26 A,两张膜0.3 A。
wb转膜条件公式

wb转膜条件公式(原创实用版)目录1.WB 转膜的定义和目的2.WB 转膜的常用方法3.WB 转膜的条件公式4.WB 转膜的注意事项5.总结正文一、WB 转膜的定义和目的WB(Western Blot)转膜,又称为免疫印迹转膜,是一种将蛋白质从聚丙烯酰胺凝胶(PAGE)转移到固相支持物上的技术。
其主要目的是为了将电泳分离得到的蛋白质样品,转移到固相载体上,以便于进行后续的免疫学检测和分析。
二、WB 转膜的常用方法WB 转膜常用的方法有以下几种:1.湿式转膜:湿式转膜是最常用的 WB 转膜方法,其主要原理是利用电场和分子渗透作用,将蛋白质从凝胶中转移到固相载体上。
2.干式转膜:干式转膜则是通过暴露于干燥的气氛中,使得凝胶中的蛋白质与固相载体上的抗体结合,然后再进行洗涤和检测。
3.半干式转膜:半干式转膜则是湿式转膜和干式转膜的结合,一部分采用湿式转膜,一部分采用干式转膜。
三、WB 转膜的条件公式在进行 WB 转膜时,需要控制的条件包括:1.转膜缓冲液:转膜缓冲液的 pH 值、离子强度和蛋白酶抑制剂的浓度等,都会影响到蛋白质的转膜效果。
2.转膜时间:转膜时间过长或过短,都会影响到蛋白质的转膜效果。
3.转膜温度:转膜温度一般控制在 12-18℃,温度过高或过低都会影响到蛋白质的转膜效果。
4.固相载体:固相载体的选择和处理,也会影响到蛋白质的转膜效果。
四、WB 转膜的注意事项在进行 WB 转膜时,需要注意以下几点:1.保持实验操作的无菌性,以防止细菌污染。
2.选择合适的转膜时间和温度,避免过度转膜或转膜不足。
3.选择合适的固相载体,并正确处理和封闭。
4.使用高质量的转膜缓冲液,避免缓冲液中蛋白酶的干扰。
五、总结WB 转膜是蛋白质研究中常用的技术,其操作需要注意控制转膜缓冲液、转膜时间、转膜温度和固相载体等条件。
wb转膜条件公式

wb转膜条件公式(实用版)目录1.WB 转膜的概念2.WB 转膜的步骤3.WB 转膜条件公式的含义4.WB 转膜条件公式的计算方法5.WB 转膜的注意事项正文一、WB 转膜的概念WB(Western Blot)转膜,又称为 Western Blot 转印,是一种将蛋白质从聚丙烯酰胺凝胶(PAGE)转移到硝酸纤维素膜(NC 膜)上的实验技术。
通过 WB 转膜,可以进一步对蛋白质进行检测和分析。
二、WB 转膜的步骤WB 转膜主要分为以下几个步骤:1.制备蛋白质样品:首先需要从生物组织或细胞中提取蛋白质,并进行电泳分离。
2.制备转膜液:转膜液的主要成分是缓冲液和甲醇,可以根据需要添加其他试剂,如 Tween-20 等。
3.转膜:将电泳分离后的聚丙烯酰胺凝胶放入转膜液中,连接电源进行转膜。
4.固定和封闭:转膜完成后,将 NC 膜放入固定液中固定,然后用封闭液封闭。
5.抗体孵育:加入特异性抗体,进行孵育。
6.检测:加入二抗,进行化学发光或放射性检测。
三、WB 转膜条件公式的含义WB 转膜条件公式是指在 WB 转膜过程中,用于计算转膜时间和电流的公式。
其目的是为了使蛋白质从聚丙烯酰胺凝胶转移到硝酸纤维素膜上,并在转移过程中保持蛋白质的生物活性。
四、WB 转膜条件公式的计算方法WB 转膜条件公式的计算方法主要取决于以下几个因素:1.转膜时间:转膜时间通常根据聚丙烯酰胺凝胶的厚度和电泳分离的分子量范围来确定。
一般转膜时间为 1-2 小时。
2.电流:电流大小取决于聚丙烯酰胺凝胶的电荷量和转膜液的电阻。
通常情况下,电流为 1-2mA/cm。
3.转膜液的 pH 值:转膜液的 pH 值对蛋白质的电荷有影响,因此需要控制在适宜范围内,一般为 6.5-8.5。
4.甲醇浓度:甲醇浓度对蛋白质的溶解度有影响,一般为 20%-50%。
五、WB 转膜的注意事项1.在转膜过程中,要保持恒定的温度和湿度。
2.避免在转膜过程中剧烈震动或长时间中断电流。
western 转膜及常见问题汇总
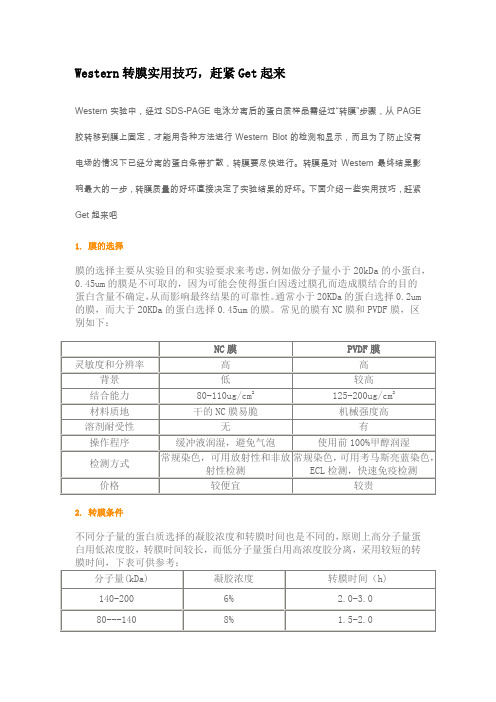
Western转膜实用技巧,赶紧Get起来Western实验中,经过SDS-PAGE电泳分离后的蛋白质样品需经过“转膜”步骤,从PAGE 胶转移到膜上固定,才能用各种方法进行Western Blot的检测和显示,而且为了防止没有电场的情况下已经分离的蛋白条带扩散,转膜要尽快进行。
转膜是对Western最终结果影响最大的一步,转膜质量的好坏直接决定了实验结果的好坏。
下面介绍一些实用技巧,赶紧Get起来吧1. 膜的选择膜的选择主要从实验目的和实验要求来考虑,例如做分子量小于20kDa的小蛋白,0.45um的膜是不可取的,因为可能会使得蛋白因透过膜孔而造成膜结合的目的蛋白含量不确定,从而影响最终结果的可靠性。
通常小于20KDa的蛋白选择0.2um 的膜,而大于20KDa的蛋白选择0.45um的膜。
常见的膜有NC膜和PVDF膜,区别如下:2. 转膜条件不同分子量的蛋白质选择的凝胶浓度和转膜时间也是不同的,原则上高分子量蛋白用低浓度胶,转膜时间较长,而低分子量蛋白用高浓度胶分离,采用较短的转3. 转膜操作注意事项(1)避免直接接触膜,全程戴手套并使用镊子,手指上的油脂与蛋白会封闭转膜效率并易产生背景污斑;(2) PVDF膜具有疏水性,使用之前需用甲醇浸泡;(3)排列三明治时,尽量用干净的玻璃棒或试管赶走胶和膜之间的气泡,避免转膜不均匀;(4)确认裁剪的膜和滤纸与凝胶尺寸相同,否则会导致电流不能通过膜,从而转膜无效;(5)鸡来源的抗体与PVDF和尼龙膜有较强的结合能力,从而产生较高背景,故如果选择鸡来源的抗体,最好使用**纤维素膜(NC膜)4. 转膜后丽春红染色为检测转膜是否成功,可以用丽春红进行染色,将膜放入TBST洗一次,然后置于丽春红染色工作液中,室温下摇动染色5分钟,大量的水洗膜,直至水变清无色,蛋白条带清晰。
Western Blot 常见问题汇总分析。
wb转膜条件公式
wb转膜条件公式【最新版】目录1.概述2.wb 转膜条件公式的含义3.wb 转膜条件公式的计算方法4.wb 转膜条件公式的应用5.总结正文1.概述wb 转膜条件公式,是一种用于蛋白质印迹法(Western Blotting,简称 WB)实验中转膜过程的条件计算公式。
在 WB 实验中,将电泳分离后的蛋白质样品通过转膜过程,使蛋白质从凝胶转移到膜上,以便进行后续的检测和分析。
转膜条件的优化有助于提高蛋白质的检测灵敏度和特异性。
2.wb 转膜条件公式的含义wb 转膜条件公式主要包括以下三个参数:- 转膜时间(T):转膜过程中蛋白质从凝胶转移到膜上的时间。
- 转膜电压(V):在转膜过程中施加的电压。
- 磷酸缓冲液(pH):转膜过程中使用的缓冲液的 pH 值。
3.wb 转膜条件公式的计算方法wb 转膜条件公式的计算方法主要取决于实验目的和实验条件。
通常情况下,可以根据以下步骤进行计算:- 首先,根据实验目的确定所需的转膜时间。
转膜时间过长可能导致非特异性蛋白迁移,过短则可能使目标蛋白无法完全转移。
- 其次,根据实验条件和目标蛋白的大小确定合适的转膜电压。
通常情况下,转膜电压与目标蛋白的分子量成正比,即分子量越大,所需电压越高。
- 最后,根据实验条件和转膜过程中蛋白质的稳定性确定合适的磷酸缓冲液 pH 值。
4.wb 转膜条件公式的应用在实际应用中,根据实验目的和实验条件调整转膜条件公式中的参数,以获得最佳的转膜效果。
在实验过程中,可以通过观察转膜后的膜上蛋白质条带进行优化。
5.总结wb 转膜条件公式是蛋白质印迹法实验中转膜过程的重要参考,合理的转膜条件可以提高蛋白质检测的灵敏度和特异性。
wb转膜原理
WB转膜原理一、什么是WB转膜在分子生物学研究中,Western blotting(WB)是一种常用的蛋白质检测方法。
它通过将蛋白质分离、转移到膜上并用特异性抗体进行检测,能够准确地检测目标蛋白质的存在和表达水平。
WB转膜是WB技术中的一个重要步骤,它将已经分离得到的蛋白质转移到固体支持物上,常用的支持物包括聚丙烯酰胺凝胶、聚乙烯二醇脲醛膜等。
WB转膜的目的是为了将蛋白质从凝胶中转移到膜上,以便后续的抗体检测。
二、WB转膜的原理WB转膜的原理是利用电场作用将蛋白质从凝胶中转移到膜上。
在转膜过程中,电场会使得蛋白质向阳极(阳极移动),因此要将膜放置在阳极一侧,凝胶放置在阴极一侧。
具体的WB转膜原理可以分为以下几个步骤:1. 准备工作首先,需要将蛋白质样品经过SDS-PAGE(聚丙烯酰胺凝胶电泳)进行分离,得到蛋白质的条带。
2. 选择合适的膜和缓冲液根据蛋白质的大小和特性,选择合适的膜和缓冲液。
常用的膜有聚乙烯二醇脲醛膜、聚偏氟乙烯膜等,常用的缓冲液有传输缓冲液(Tris-glycine buffer)等。
3. 建立电场将薄膜强制充湿于转印缓冲液中,然后将其与蛋白质凝胶层叠加在一起。
在薄膜上放置一个合适大小的吸水纸,再将层叠的凝胶和薄膜叠放在一个转印装置中,加上电源连接转印装置。
4. 转膜过程打开电源,通电进行转膜。
在转膜过程中,蛋白质会受到电场的作用,向阳极(薄膜)方向移动,逐渐从凝胶中转移到薄膜上。
5. 后续处理转膜完成后,将薄膜取出,可进行一些后续处理,如用Ponceau S染色检测转膜效果、去除Ponceau S染料、进行蛋白质的染色检测等。
三、注意事项和常见问题在进行WB转膜时,需要注意以下几点:1. 转膜条件的选择转膜条件包括转膜时间、电压和电流等。
不同的蛋白质样品可能需要不同的转膜条件,因此需要进行优化。
一般来说,转膜时间较长,电压较低,可以得到较好的转膜效果。
2. 防止蛋白质传输不完全蛋白质转移到薄膜上的效率可能受到多种因素的影响,如蛋白质的大小、电场的强度和转膜时间等。
western转膜条件
western转膜条件蛋白来源:RAW264.7 总蛋白蛋白名称(可保密):一些转录因子蛋白分子量:40~70 KDWB用膜类型、孔径:0.45 NC转膜方式(恒压、恒流):湿转恒流400 mA转膜时间:60~90 minPS.其实吧,以我的经验来看,除非目的蛋白特别小,或者特别大,不然转膜时间真的不是那么重要,曾经因为失误,转了15 min就拆下来了,但从丽春红染色来看,跟平常实验也没有太大的区别。
蛋白来源:内皮细胞总蛋白蛋白名称(可保密):occludin & AKT蛋白分子量:65 KD & 56 KDWB用膜类型、孔径:0.45 PVDF转膜方式(恒压、恒流):湿转恒压 100 V转膜时间:60~70 min设备名字是“Bio-Rad mini”。
蛋白来源:乳鼠心肌细胞和成年鼠心肌组织总蛋白和核蛋白蛋白名称(可保密):保密蛋白分子量:65 KD & 55 KDWB用膜类型、孔径:PVDF(预先用甲醇处理)转膜方式(恒压、恒流):半干转恒压 12 V转膜时间:30-40 min设备:“Bio-Rad mini”建议:最开始做过湿转(过夜的那种),太费事费时,效果也不如半干转。
蛋白来源:293T细胞蛋白名称(可保密):蛋白分子量:95 KD & 35 KDWB用膜类型、孔径:PVDF转膜方式(恒压、恒流):湿转恒压 90 V-110 V,控制电流不要超过300 mA。
转膜时间:70 min蛋白来源:肿瘤手术标本蛋白名称(可保密):转录因子蛋白分子量:33 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):350 mA 恒流转膜时间:150 min转膜设备:湿转 Bio-Rad说明:相同条件曾用于数个30-70 KDa的蛋白,都能成功转上,不过没有试缩短时间效果如何;实验时没为转膜条件苦恼,倒是电泳时胶的浓度及时间根据不同分子量而有区别。
蛋白来源:成纤维细胞蛋白名称(可保密):smad3蛋白分子量:54 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):350 mA 恒流转膜时间:150 min转膜设备:湿转 Bio-Rad蛋白来源:胰腺癌细胞蛋白名称(可保密):蛋白分子量:16 KDa and 42 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):120 V 恒压转膜时间:90 min转膜设备:湿转 Bio-Rad蛋白来源:大鼠血管平滑肌细胞蛋白名称(可保密):保密蛋白分子量:72 KD,42 KD 和22 KDWB用膜类型、孔径:一般的PVDF膜转膜方式(恒压、恒流):湿转,恒流一张膜0.26 A,两张膜0.3 A。
wb转膜条件公式
wb转膜条件公式摘要:一、前言二、WB转膜条件的公式介绍1.WB转膜条件的含义2.公式推导过程3.公式中各参数的意义三、WB转膜条件公式的应用1.预测蛋白质分子量2.分析蛋白质翻译后修饰3.在实验设计中的应用四、WB转膜条件公式的局限性1.蛋白质结构的复杂性2.实际操作中可能存在的误差五、结论正文:一、前言Western Blot(WB)技术是生物化学和分子生物学中常用的一种实验方法,用于检测蛋白质的表达和翻译后修饰。
在WB实验中,转膜条件对实验结果具有重要影响。
本文将介绍一种WB转膜条件公式,帮助理解和优化实验条件。
二、WB转膜条件公式介绍1.WB转膜条件的含义WB转膜条件是指在实验过程中,蛋白质从凝胶电泳系统转移到固相支持物(例如聚偏氟乙烯膜)的条件。
这些条件包括电流、电压、时间等参数。
2.公式推导过程WB转膜条件公式是基于电流、电压和时间的关系推导出来的。
在实际操作中,通过改变电流、电压或时间来优化实验条件。
3.公式中各参数的意义公式中的参数包括电流(I)、电压(V)和时间(t)。
电流表示通过凝胶的电流强度,单位为安培(A);电压表示凝胶和固相支持物之间的电势差,单位为伏特(V);时间表示转膜过程所需的时间,单位为秒(s)。
三、WB转膜条件公式的应用1.预测蛋白质分子量通过WB转膜条件公式,可以预测蛋白质在转膜过程中的迁移率,从而预测其分子量。
这对于蛋白质的分离和鉴定具有重要意义。
2.分析蛋白质翻译后修饰WB转膜条件公式可以帮助研究者分析蛋白质翻译后修饰(如磷酸化、糖基化等)对其迁移率的影响。
这有助于深入了解蛋白质的功能和调控机制。
3.在实验设计中的应用在WB实验设计中,可以通过调整电流、电压和时间等参数来优化实验条件,从而获得更可靠的实验结果。
四、WB转膜条件公式的局限性1.蛋白质结构的复杂性WB转膜条件公式基于蛋白质的电荷和分子量进行预测,但忽略了蛋白质结构的复杂性。
因此,在实际应用中可能存在一定的误差。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
western 转膜条件蛋白来源:RAW264.7 总蛋白蛋白名称(可保密):一些转录因子蛋白分子量:40~70 KDWB用膜类型、孔径:0.45 NC转膜方式(恒压、恒流):湿转恒流400 mA 转膜时间:60~90 minPS.其实吧,以我的经验来看,除非目的蛋白特别小,或者特别大,不然转膜时间真的不是那么重要,曾经因为失误,转了15 min 就拆下来了,但从丽春红染色来看,跟平常实验也没有太大的区别。
蛋白来源:内皮细胞总蛋白蛋白名称(可保密):occludin & AKT 蛋白分子量:65 KD & 56 KDWB用膜类型、孔径:0.45 PVDF转膜方式(恒压、恒流):湿转恒压100 V转膜时间:60~70 min设备名字是“ Bio-Rad mini ”。
蛋白来源:乳鼠心肌细胞和成年鼠心肌组织总蛋白和核蛋白蛋白名称(可保密):保密蛋白分子量:65 KD & 55 KDWB用膜类型、孔径:PVDF(预先用甲醇处理)转膜方式(恒压、恒流):半干转恒压12 V 转膜时间:30-40 min 设备:“ Bio-Rad mini ” 建议:最开始做过湿转(过夜的那种),太费事费时,效果也不如半干转。
蛋白来源:293T 细胞蛋白名称(可保密):蛋白分子量:95 KD & 35 KDWB用膜类型、孔径:PVDF转膜方式(恒压、恒流):湿转恒压90 V-110 V ,控制电流不要超过300 mA。
转膜时间:70 min蛋白来源:肿瘤手术标本蛋白名称(可保密):转录因子蛋白分子量:33 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):350 mA 恒流转膜时间:150 min转膜设备:湿转Bio-Rad说明:相同条件曾用于数个30-70 KDa的蛋白,都能成功转上,不过没有试缩短时间效果如何;实验时没为转膜条件苦恼,倒是电泳时胶的浓度及时间根据不同分子量而有区别。
蛋白来源:成纤维细胞蛋白名称(可保密):smad3蛋白分子量:54 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):350 mA 恒流转膜时间:150 min转膜设备:湿转Bio-Rad蛋白来源:胰腺癌细胞蛋白名称(可保密):蛋白分子量:16 KDa and 42 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):120 V 恒压转膜时间:90 min转膜设备:湿转Bio-Rad蛋白来源:大鼠血管平滑肌细胞蛋白名称(可保密):保密蛋白分子量:72 KD,42 KD 和22 KDWB用膜类型、孔径:一般的PVDF膜转膜方式(恒压、恒流):湿转,恒流一张膜0.26 A,两张膜0.3 A。
转膜时间:90 min设备:“ Bio-Rad mini ”建议:转膜缓冲液最多用3次,最好现用现配,我们用的没有加SDS转的时候最好能用冰块一类的东西降一下温,这样转的效果要好一些,转的时候一定要把三明治每层之间的气泡除去,同时使滤纸大于膜,膜大于胶,以免烧坏电极。
蛋白来源:大鼠PBMC 蛋白名称(可保密):保密蛋白分子量:55 KDWB用膜类型、孔径:0.22的PVDF膜转膜方式(恒流):湿转转膜时间:60-90 min设备:“ Bio-Rad mini ”建议:转膜液用过两三次之后转膜效果就很差了其它按照常规就好了其实0.22 的膜一般不怕转过头以我们的经验,转膜时间、电压其实也有很大范围的调整,并不是非要固定于哪一个最合适,曾经做过一张膜转,17 KD的和170 KD的,按照170 KD的条件,17 KD的转膜也很好的。
蛋白来源:人非小细胞肺癌细胞系蛋白名称(可保密):保密蛋白分子量:大于250 kDWB用膜类型、孔径:millipore PVDF 膜0.45 um转膜方式(恒压、恒流):湿转,恒流0.3A。
转膜时间:180mi n设备:“ Bio-Rad ”建议:电转保持电压在70 V以上,保持低温,如果电压低过70就需要换缓冲液了。
蛋白来源:白血病细胞蛋白名称(可保密):保密蛋白分子量:28 KDWB用膜类型、孔径:0.45的NC膜转膜方式(恒流):湿转,90 min,0.25 A设备:“ Bio-Rad ”建议:海绵厚度要合适,一次转磨用的海绵太薄,导致三明治没夹紧,转膜后拿出来一看,marker都变得七扭八歪。
但是有前辈说垫的海绵太厚可能将胶压断,没经历过,不知道是不是会有这种情况。
蛋白来源:肿瘤细胞蛋白名称(可保密):磷酸化蛋白蛋白分子量:10-200 KDaWB用膜类型、孔径:millipore PVDF 膜0.45 um转膜方式(恒压、恒流):120 v恒压转膜时间:120 min转膜设备:湿转Bio-Rad建议:转膜缓冲液只用2次,基本都转上,5%BSA寸闭,减少背景。
蛋白来源:胰腺B细胞蛋白名称(可保密):******蛋白分子量:90-130 KDaWB用膜类型、孔径:PVDF膜转膜方式(恒压、恒流):250 mA恒流转膜时间:150 min转膜设备:湿转蛋白来源:原核表达蛋白名称(可保密):保密蛋白分子量:38 KDWB用膜类型、孔径:0.45 NC转膜方式(恒压、恒流):湿转恒压:100 V转膜时间:120 min蛋白来源:心脏蛋白名称(可保密):蛋白分子量:220 kDa , 130 kDa , 70 kDa , 41kDaWB用膜类型、孔径:PVDF转膜方式(恒压、恒流):恒压转膜时间:70 v120 min ,180 min,5-6 h转膜设备:伯乐湿转建议改进方向(可选):40 kDa 一下,70 v ,60-90 min 足够,40-70 kDa 90-120 min 即可。
70-120 kDa ,70 v,120-180 min 足够,120-180 kDa ,180-240 min ,180 kDa 以上建议6 h。
蛋白来源:卵巢癌细胞膜蛋白蛋白名称(可保密):蛋白分子量:53 KDWB用膜类型、孔径:PVDF膜0.45 um转膜方式(恒压、恒流):恒压转膜时间:80 V 100 min转膜设备:湿转Bio-Rad蛋白来源:人宫颈癌HELA细胞总蛋白蛋白名称(可保密):B -acti n蛋白分子量:42WB用膜类型、孔径:PVDF膜0.45 um转膜方式(恒压、恒流):恒压转膜时间:50 4 h转膜设备:湿转Bio-Rad蛋白来源:脑组织蛋白名称(可保密):蛋白分子量:16 KD、27 KD、32 KD、42 KDWB用膜类型、孔径:PVDF 0.22 um转膜方式(恒压、恒流):半干转恒流1 mA/cm 2或2 mA/cm2 转膜时间:不定转膜设备:北京六一仪器建议:我共做了六个蛋白,所以总在想节约时间的方式。
在 预试时我会观察电压数与转膜效率的关系,所以我不会按时间来定何时转完,而是按电 压来定。
通过染胶来确定电压数与转移蛋白分子量上限的关系。
不用多浪费时间。
并且六一的半干转膜仪随着使用次数的增多, 转膜效率(尤其是使用后期)的关系并不稳定,单纯依靠时 蛋白来源:CHO cell 蛋白名称(可保密):酶原 蛋白分子量:40 KDWB 用膜类型、孔径:0.22 的 PVDFM ( Biorad )转膜方式(恒压):100 V ,湿转,转膜时间:60 min 。
设备:Tanon (上海天能) 建议:1. 转膜液现用现配,用完倒掉。
2.转膜时间,电压可以适当调整。
分子量大或者小一些的蛋白,采用此条件一样转膜效 率很高。
蛋白来源:Hepg2蛋白名称(可保密):EGFR 蛋白分子量:170kdWB 用膜类型、孔径:pvdf 0.45 转膜方式(恒压、恒流): 24V转膜时间:2个半小时 转膜设备:伯乐半干转蛋白来源:肝癌细胞 蛋白名称:HIF-1 a 蛋白分子量:120 kDWB 用膜类型、孔径:NC 膜转膜方式(恒压):80伏,湿转 转膜时间:150分钟 设备:"Bio-Rad mini ”建 议:湿转,转膜液特别重要,否则会导致电压或者电流不稳影响转膜条带。
转膜均现配 先用,不重复利用。
转膜时间一般是 150分钟,80伏恒压。
经李春红染 色,靠近蛋白胶的一侧膜上蛋白染色深, 膜另外一面染色浅, 说明蛋白未转过。
该湿转条件自己做过的蛋白分子量范围:170-36 kD 。
蛋白来源:心肌细胞总和膜 蛋白名称(可保密):蛋白分子量:128 KD , 100, 60, 55, 43 KDWB 用膜类型、孔径:NC1 0.2 um转膜方式(恒压、恒流):恒压 转膜时间: 70 V 200 min 转膜设备:湿转 Bio-Rad建议:转膜液最好现配现现用, 或配成母液,最好不重复使用,70 V 电压下,电流约154 mA 甲醇可以加到这样有的5分钟就转完了, 效率也会下降,所以时间和 间有时会有问题。
150 ml 。
对大分子量如200 KD 转膜时间延长6-8 h 。
蛋白来源:肺脏蛋白名称(可保密):ICAM-1 蛋白分子量:85~110 KDWB用膜类型、孔径:0.22NC转膜方式(恒压、恒流):湿转恒流300 mA 转膜时间:120 min设备名字Bio-Rad mini一抗用的santa cruz 1 mL 包装的。
比例调整到1:800 做出很好的条带。
效价会一直降低的。
去年做的这个指标,今年夏天做就不行了。
蛋白来源:成纤维细胞蛋白名称(可保密):蛋白分子量:16 KDaWB用膜类型、孔径:0.2 um PVDF膜转膜方式(恒压、恒流):0.2 A 恒流转膜时间:65 min转膜设备:湿转Bio-Rad蛋白来源:成纤维细胞蛋白名称(可保密):蛋白分子量:28 KDaWB用膜类型、孔径:0.2 umPVDF膜转膜方式(恒压、恒流):0.25 A 恒流转膜时间:60 min转膜设备:湿转Bio-Rad蛋白来源:人肿瘤细胞蛋白名称(可保密):保密蛋白分子量:80 KDWB用膜类型、孔径:0.45 um PVDF膜转膜方式(恒压、恒流):半干转移系统恒流,勿超过0.85 mA/cm 2,同时转多张膜电流需累加(串联)转膜时间:60-90 min设备:Bio-Rad其实有些东西并不是非常严格的,要转移的目的蛋白分子量小,那么转移的时间就短一些,反之,则长一点;蛋白量充足,可以多转一会,蛋白量较少,则要少转一下,免得蛋白穿膜而过到了滤纸上而前功尽弃。
蛋白来源:人和鼠肝癌细胞总蛋白、胞浆、胞核蛋白蛋白名称(可保密):*** 蛋白分子量:17--116 kdWB用膜类型、孔径:PVDF膜0.45 um转膜方式(恒压、恒流):恒流200 mA转膜时间:3 h转膜设备:湿转北京六一24D mini蛋白来源:CO COS7 293T 蛋白名称(可保密):保密蛋白分子量:80 72 56 52 48 25 18KDWB用膜类型、孔径:0.45 um PVDF膜转膜方式(恒压、恒流):湿转90 V 电流约为230--280 mA 之间。
