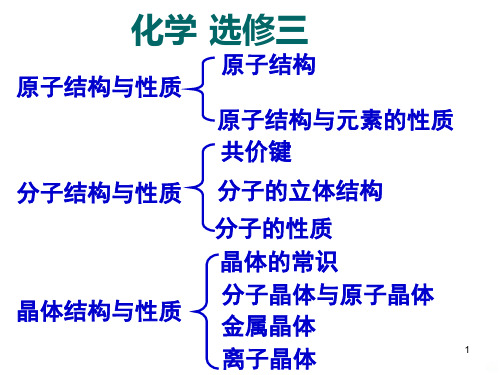
高中化学鲁科版选修3课件:本章整合1教学课件
合集下载
2020最新鲁科版高二化学选修3物质结构与性质全册教学课件

2020最新鲁科版高二化学选修3 物质结构与性质全册教学课件目
录
0002页 0072页 0121页 0484页 0847页 1571页 1611页 1651页 1702页
第1章 原子结构 第2节 原子结构与元素周期表 全章复习与测试 第1节 共价键模型 第3节 离子键、配位键与金属键 全章复习与测试 第1节 认识晶体 第3节 原子晶体与分子晶体 全章复习与测试
2020最新鲁科版高二化学选修3物 质结构与性质全册教学课件
第3节 原子结构与元素性质
2020最新鲁科版高Hale Waihona Puke 化学选修3物 质结构与性质全册教学课件
第1章 原子结构
2020最新鲁科版高二化学选修3物 质结构与性质全册教学课件
第1节 原子结构模型
2020最新鲁科版高二化学选修3物 质结构与性质全册教学课件
第2节 原子结构与元素周期表
录
0002页 0072页 0121页 0484页 0847页 1571页 1611页 1651页 1702页
第1章 原子结构 第2节 原子结构与元素周期表 全章复习与测试 第1节 共价键模型 第3节 离子键、配位键与金属键 全章复习与测试 第1节 认识晶体 第3节 原子晶体与分子晶体 全章复习与测试
2020最新鲁科版高二化学选修3物 质结构与性质全册教学课件
第3节 原子结构与元素性质
2020最新鲁科版高Hale Waihona Puke 化学选修3物 质结构与性质全册教学课件
第1章 原子结构
2020最新鲁科版高二化学选修3物 质结构与性质全册教学课件
第1节 原子结构模型
2020最新鲁科版高二化学选修3物 质结构与性质全册教学课件
第2节 原子结构与元素周期表
鲁科版高中化学选修3(物质结构与性质)课件【完整版】

若C为阳离子Cn+,有2c-n=18(n取偶数):n=2时,c= 10,为Ne,舍去;n=4时,c=11,为Na,无Na4+,舍去; n=6时,c=12,为Mg,无Mg6+,舍去。故C为O元素,由 ④知A、C、D必为相邻周期元素。C为O,则A为Al,D为 Na,B为S。
【答案】 (1)Al S O Na (2)Al3+:1s22s22p6 S2-:1s22s22p63s23p6 O2-:1s22s22p6 Na+:1s22s22p6 (3)r(S2-)>r(O2-)>r(Na+)>r(Al3+) (4)Na>Al (5)< (6)Na<Al<S<O
第一电离能
电负性
增强 减弱 增强
减弱
增强 大体增大
变大
减弱 增强 减弱
增强
减弱 减小 变小
A、B、C、D为原子序数小于18的四种元素: ①A原子的电子层数等于最外层电子数; ②A与B处于同一周期,B与D可形成离子化合物D2B, 该化合物的水溶液显碱性; ③C的离子核内质子数与核外电子数之和为18; ④A、C、D三种元素的离子具有相同的电子层排布。 推断A~D各为何种元素,并用其元素符号填空: (1)A______,B______,C______,D______。
(5)B、C的电负性大小关系为B________C。 (6)A、B、C、D四种元素的第一电离能由大到小关系 为____________。 【解析】 A、B、C、D均为短周期元素成D2B离子化合物Li2O、Na2O、Na2S,它们的水溶 液都为碱性。由③可知若C为阴离子Cn-,则设核电荷数为 c,有2c+n=18(n取偶数):n=2时,c=8,C为O;n=4 时,c=7为N,无N4-离子,舍去;n不可能大于5。
3.洪特规则 原子核外电子在能量相同的各个原子轨道上排布时, 应尽可能分占不同的原子轨道,且自旋方向平行(即自旋方 向相同)。例如:
高中化学鲁科版选修三课件:第1章 第1节 原子结构模型(25张PPT)

3.玻尔原子结构模型的基本观点
运动 原子中的电子在具有确定半径的圆周轨道上绕原__子__核__运 轨迹 动,并且不辐射能量 能量 在不同轨道上运动的电子具有_不__同__的能量,而且能量 分布 是_量__子__化_的。轨道能量依n(电子层数)值(1,2,3,…)的
增大而_升__高_ 对氢原子而言,电子处于n=1的轨道时能量最低,称为 电子 _基__态_;能量高于基态的状态称为_激__发__态__。电子在能量 跃迁 不同的轨道之间跃迁时,辐射或吸收的能量以光的形式 表现出来并被记录下来,就形成了_光__谱_
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不 能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2022/4/132022/4/132022/4/132022/4/13
1.判断正误(正确的打“√”,错误的打“×”)。
立核外电子分层排布模型→20 世纪 20 年代产生了量子力学模型。
量子力学对原子核外电子运动状态的描述
1.原子轨道
(1)电子层(n) 分层标准
电子离核的远近
n 的取值 1 2 3 4 5 6 7
符号 能量
K LM N O P Q 由低 到 高 ―――→
离核
由 近到远 ―――→
(2)能级 在同一电子层中,电子所具有的能量可能 不同 ,所以同一
5.填空。 (1)用符号填写电子层所含能级种类: K 层:_1_s;L 层:_2_s、__2_p_;M 层:3_s_、__3_p_、__3_d_;N 层:_4_s_、__4_p_、__4_d_、__4_f。 (2)用数字填写能级所含原子轨道数目: s:__1__;p:__3__;d:__5__;f:__7__。 (3)比较下列原子轨道的能量高低(填“<”“=”或“>”)。 ①4s_>___3s_>___2s__>__1s; ②3px__=__3py__=__3pz; ③4f__>__4d__>__4p__>__4s; ④1s_<___2p_<___3d__<__4f。
鲁科版高中化学选择性必修第3册 第3章 本章整合

。
(3)根据信息b,以及反应④的产物和C中含有三个甲基可知C的结构简式为
。
(4)根据信息c可知反应⑤为羰基的加成反应。 (5)根据反应条件可知反应⑥为加氢反应,从产物的结构分析可知D中的碳 碳三键经与氢气加成后产生碳碳双键。 (6)根据碳原子的不饱和程度,结合题目条件可知,分子中应含有碳碳双键 和酮羰基,则符合的结构有(编号为碳碳双键位置):
的结构简式 思维程序二: 有机化合物相对分子质量-已知基团的式量=剩余部分的式量→剩余部分 的化学式
5.解题思路
本课结束
(1)A的化学名称为 。
(2)B的结构简式为
。
(3)反应物C含有三个甲基,其结构简式为
。
(4)反应⑤的反应类型为
。
(5)反应⑥的化学方程式为 。
(6)化合物C的同分异构体中能同时满足以下三个条件的有
考虑立体异构体,填字母)。
个(不
(ⅰ)含有两个甲基;(ⅱ)含有酮羰基(但不含C==C==O);(ⅲ)不含有环状结构。
为。(3)CFra bibliotek结构简式为,F的结构简式为
。
(4)Br2 和
的反应与 Br2 和苯酚的反应类似,以
和
为原料合成 优合成路线(其他试剂任选)。
,写出能获得更多目标产物的较
答案 (1)CH3COOH+CH3CH2OH
(或增大乙酸或乙醇的用量) (2)取代反应 羰基、酰胺基
CH3COOC2H5+H2O 及时蒸出产物
其中含有手性碳原子的化合物的结构简式为
。
方法规律 1.有机推断六大“题眼” (1)有机化合物的化学性质和物理性质。 (2)有机反应的条件。 (3)有机反应的数据。 (4)有机化合物的结构。 (5)有机化合物的通式。 (6)所给的反应信息。
(3)根据信息b,以及反应④的产物和C中含有三个甲基可知C的结构简式为
。
(4)根据信息c可知反应⑤为羰基的加成反应。 (5)根据反应条件可知反应⑥为加氢反应,从产物的结构分析可知D中的碳 碳三键经与氢气加成后产生碳碳双键。 (6)根据碳原子的不饱和程度,结合题目条件可知,分子中应含有碳碳双键 和酮羰基,则符合的结构有(编号为碳碳双键位置):
的结构简式 思维程序二: 有机化合物相对分子质量-已知基团的式量=剩余部分的式量→剩余部分 的化学式
5.解题思路
本课结束
(1)A的化学名称为 。
(2)B的结构简式为
。
(3)反应物C含有三个甲基,其结构简式为
。
(4)反应⑤的反应类型为
。
(5)反应⑥的化学方程式为 。
(6)化合物C的同分异构体中能同时满足以下三个条件的有
考虑立体异构体,填字母)。
个(不
(ⅰ)含有两个甲基;(ⅱ)含有酮羰基(但不含C==C==O);(ⅲ)不含有环状结构。
为。(3)CFra bibliotek结构简式为,F的结构简式为
。
(4)Br2 和
的反应与 Br2 和苯酚的反应类似,以
和
为原料合成 优合成路线(其他试剂任选)。
,写出能获得更多目标产物的较
答案 (1)CH3COOH+CH3CH2OH
(或增大乙酸或乙醇的用量) (2)取代反应 羰基、酰胺基
CH3COOC2H5+H2O 及时蒸出产物
其中含有手性碳原子的化合物的结构简式为
。
方法规律 1.有机推断六大“题眼” (1)有机化合物的化学性质和物理性质。 (2)有机反应的条件。 (3)有机反应的数据。 (4)有机化合物的结构。 (5)有机化合物的通式。 (6)所给的反应信息。
高中化学选修三全套共张PPT课件
①电子云
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
鲁科版高中化学选修3 原子结构 本章整合 名师优质课件(18张)

本章整合
-1-
本章整合
氢原子光谱:线状光谱 玻尔原子结构模型:电子所处的轨道能量是量子化的 原子结构模型 量子力学对原子核外 电子运动状态的描述 原子轨道:表示原子中单个电子的空间运动状态 原子轨道的图形描述:s 球形、p 哑铃形
知识网络
专题归纳
电子云:表示电子在核外空间单位体积内出现概率大小的图形 排布顺序:������1s < ������2s < ������2p < ������3s < ������3p < ������4s < ������3d < …… 特殊:全充满(p6 或d10 )、半充满(p3 或d6 )、全空(p0 或d0 )
-7-
(4)当 x=1 时,y= 。 (5)当 y=4 时,核电荷数为 答案:(1)2 (2)1~2 0~6
(3)6 (4)0
本章整合
专题1 专题2 专题3
知识网络
专题归纳
元素周期表与元素周期律
1.元素周期表 周期表有 7 个横行,表示 7 个周期;18 个纵行,表示 16 个族。从左到右, 各主、副族元素的排列顺序已在元素的分区示意图中反映出来。通常把周 期表的各副族元素和第Ⅷ族元素叫过渡元素。 除零族外,周期表共有三大部 分:主族元素,在表中左右两端。过渡元素,在表的中部。镧系、锕系在表的 底部。如图是元素周期表轮廓图。
应用 原子结构 与元素性质 电负性 应用
定义:元素的原子在化合物中吸引电子能力的标度 变化规律 同周期:自左向右,元素的电负性递增 同主族:自上而下,元素的电负性递减 判断化合物中元素化合价的正负 判断化学键的类型 元素周期律的实质:元素性质的周期性取决于元素原子核外电子排布的周期性
判断元素是金属元素还是非金属元素以及元素活泼性
-1-
本章整合
氢原子光谱:线状光谱 玻尔原子结构模型:电子所处的轨道能量是量子化的 原子结构模型 量子力学对原子核外 电子运动状态的描述 原子轨道:表示原子中单个电子的空间运动状态 原子轨道的图形描述:s 球形、p 哑铃形
知识网络
专题归纳
电子云:表示电子在核外空间单位体积内出现概率大小的图形 排布顺序:������1s < ������2s < ������2p < ������3s < ������3p < ������4s < ������3d < …… 特殊:全充满(p6 或d10 )、半充满(p3 或d6 )、全空(p0 或d0 )
-7-
(4)当 x=1 时,y= 。 (5)当 y=4 时,核电荷数为 答案:(1)2 (2)1~2 0~6
(3)6 (4)0
本章整合
专题1 专题2 专题3
知识网络
专题归纳
元素周期表与元素周期律
1.元素周期表 周期表有 7 个横行,表示 7 个周期;18 个纵行,表示 16 个族。从左到右, 各主、副族元素的排列顺序已在元素的分区示意图中反映出来。通常把周 期表的各副族元素和第Ⅷ族元素叫过渡元素。 除零族外,周期表共有三大部 分:主族元素,在表中左右两端。过渡元素,在表的中部。镧系、锕系在表的 底部。如图是元素周期表轮廓图。
应用 原子结构 与元素性质 电负性 应用
定义:元素的原子在化合物中吸引电子能力的标度 变化规律 同周期:自左向右,元素的电负性递增 同主族:自上而下,元素的电负性递减 判断化合物中元素化合价的正负 判断化学键的类型 元素周期律的实质:元素性质的周期性取决于元素原子核外电子排布的周期性
判断元素是金属元素还是非金属元素以及元素活泼性
高中化学 第1章 第3节 第1课时 电离能及其变化规律课件 鲁科版选修3

2.金属活动性顺序与相应的电离能的大小顺序不一致的原因 金属活动性按 K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)Cu、 Hg、Ag、Pt、Au 的顺序减弱,该顺序表示自左向右,在水溶液中金属单 质中的原子失去电子越来越困难。电离能是指金属原子在气态时失去电子 成为气态阳离子的能力,它是金属原子在气态时活泼性的量度。
(3)图中第一电离能最小的元素在周期表中的位置是第________周期 ________族。
[解析] (1)由图可以看出,同周期的ⅠA 族元素的第一电离能最小, 而ⅢA 族元素的第一电离能小于ⅡA 族元素的第一电离能,故 Na<Al<Mg。(2)从图中可看出同主族元素第一电离能从上到下逐渐减小。 (3)根据第一电离能的递变规律可以看出,图中所给元素中 Rb 的第一电离 能最小,其位置为第 5 周期ⅠA 族。
②元素的逐级电离能逐渐增大并且会发生一个突变即突然增大多倍, 这是由于电子是分层排布的,主族元素几乎不能失去内层电子的缘故。如 Na 原子的 I1、I2、I3 的值分别是(单位为 kJ·mol-1)496、4 562、6 912,在 I1 和 I2 之间发生突变。
【典例 1】 第一电离能 I1 是指气态原子 X(g)处于基态时,失去一个 电子成为气态阳离子 X+(g)所需的能量。下图是部分元素原子的第一电离 能 I1 随原子序数变化的曲线图(其中 12 号至 17 号元素的有关数据缺失)。
第1章 原子结构
第3节 原子结构与元素性质 第1课时 电离能及其变化规律
目标与素养:1.理解电离能的概念及第一电离能的周期性变化规律。 (宏观辨识与微观探析)2.能运用电离能解释元素的性质及第一电离能与原 子半径、核外电子排布周期性变化的关系。(科学探究)
高考化学总复习 第一章 原子结构课件 鲁科版选修3

第十二页,共37页。
2.核外电子排布与族的划分 族的划分与原子的价电子排布和价电子数目密切相关。一般来 说,同族元素的价电子数目相同。主族元素的价电子全部在最外层 的 ns 或 np 轨道上。尽管同族元素的电子层数从上到下逐渐增加, 但价电子排布完全相同,并且主族元素所在族的序数等于该元素原 子的价电子数。
第二十四页,共37页。
【解析】 (1)A 元素基态原子次外层有两个电子,故次外层为
K 层,A 元素有两个电子层,由题意可写出其轨道排布式
为:
,则该元素核外有 6 个电子,为碳元素,其
元素符号为 C。 (2)B-、C+的电子层结构都与 Ar 相同,即核外都有 18 个电子,
则 B 为 17 号元素 Cl,C 为 19 号元素 K。 (3)D 元素原子失去 2 个 4s 电子和 1 个 3d 电子后变成+3 价离子,
第二页,共37页。
1.电子层、能级及其最多容纳电子数的关系
电子层(n) 1 2
3
4
…
符号 K L
M
N
…
能级(l) 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f …
最多容纳 2 2 6 2 6 10 2 6 10 14 …
电子数 2 8
18
32
2n2
第三页,共37页。
2.原子轨道及四个量子数 (1)量子力学对原子核外电子运动状态的描述 ①四个量子数
同周期相邻的ⅢA 和ⅥA 元素,如第一电离能 Mg>Al,P>S。
第二十页,共37页。
3.下列各组元素性质的递变情况错误的是( ) A.Na、Mg、Al 原子最外层电子数依次增多 B.P、S、Cl 元素最高正价依次升高 C.N、O、F 电负性依次减小 D.Na、K、Rb 第一电离能逐渐减小 解析:同周期元素从左到右,原子的最外层电子数依次增多, 元素最高正价依次升高,电负性依次增大,故 A、B 正确,C 错误; 同主族元素从上到下,第一电离能逐渐减小,故 D 正确。 答案:C
2.核外电子排布与族的划分 族的划分与原子的价电子排布和价电子数目密切相关。一般来 说,同族元素的价电子数目相同。主族元素的价电子全部在最外层 的 ns 或 np 轨道上。尽管同族元素的电子层数从上到下逐渐增加, 但价电子排布完全相同,并且主族元素所在族的序数等于该元素原 子的价电子数。
第二十四页,共37页。
【解析】 (1)A 元素基态原子次外层有两个电子,故次外层为
K 层,A 元素有两个电子层,由题意可写出其轨道排布式
为:
,则该元素核外有 6 个电子,为碳元素,其
元素符号为 C。 (2)B-、C+的电子层结构都与 Ar 相同,即核外都有 18 个电子,
则 B 为 17 号元素 Cl,C 为 19 号元素 K。 (3)D 元素原子失去 2 个 4s 电子和 1 个 3d 电子后变成+3 价离子,
第二页,共37页。
1.电子层、能级及其最多容纳电子数的关系
电子层(n) 1 2
3
4
…
符号 K L
M
N
…
能级(l) 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f …
最多容纳 2 2 6 2 6 10 2 6 10 14 …
电子数 2 8
18
32
2n2
第三页,共37页。
2.原子轨道及四个量子数 (1)量子力学对原子核外电子运动状态的描述 ①四个量子数
同周期相邻的ⅢA 和ⅥA 元素,如第一电离能 Mg>Al,P>S。
第二十页,共37页。
3.下列各组元素性质的递变情况错误的是( ) A.Na、Mg、Al 原子最外层电子数依次增多 B.P、S、Cl 元素最高正价依次升高 C.N、O、F 电负性依次减小 D.Na、K、Rb 第一电离能逐渐减小 解析:同周期元素从左到右,原子的最外层电子数依次增多, 元素最高正价依次升高,电负性依次增大,故 A、B 正确,C 错误; 同主族元素从上到下,第一电离能逐渐减小,故 D 正确。 答案:C
