05 第五章 卤代烃
合集下载
第五章 卤代烃
CH3CH2CH Br 2-溴丁烷 CH3 CH3CH2CCH3 Br
CH3
KOH/乙醇
CH3CH
CHCH3 + CH3CH2CH
CH2
2-丁烯(81%)
1-丁烯(19%)
NaOC2H5 C2H5OH
CH3CH
C(CH3)2 + CH3CH2C CH3
CH2
2-甲基-2-溴丁烷
2-甲基-2-丁烯(70%) 2-甲基-1-丁烯(30%)
共轭效应
共轭体系: 单双键交替出现的体系。
C=C–C=C–C=C - 共轭 C=C–C p - 共轭 + C=C–C
定义:在共轭体系中,由于原子间的一种相互影响而使体系 内的电 子( 或p电子)分布发生变化的一种电子效应。 给电子共轭效应用+C表示
X C C C C
吸电子共轭效应用-C表示
C2H5O C2H5OH
C H3 C H3 C C H C H3 C H3O C2H5
(S N2)
(SN1)
C2H 5O C2H5OH
C H3 C H3 C C H C H3 重排 C H3
+
CH3 CH3 C CH CH3 CH3
+
C2H5O C H3
C2H5O C2H5OH
C H3 C C H C H3 C H3
第五章
卤代烃
1、 碳卤键的特点
成键轨道
Csp3
等性杂化
Xsp 3
极性共价键, 成键电子对偏 向X.
不等性杂化
2、键长
C—H 110 C—F C—C 139 154 C—Cl 176 C—Br C— I 194 214 (pm)
第五章.卤代烃

9%
(6个σ-π)
(2个σ-π)
CH3 CH3CH2-C-CH3
OH-/ 醇
CH3 CH3-CH=C-CH3 +
CH3 CH3CH2-C =CH2
Br
71% (9个σ-π)
29% (5个σ-π)
经验规律:消除结果为生成的双键碳上连有的烃基
最多的产物为主——扎依采夫规则
卤代烷的消除反应,多数情况下常常与取代反应同时进行
HO + H3C Br H2O CH3OH + Br
H HO + H C Br
H
HH
δ-
δ-
HO C Br
H
H
H HO C + Br
H
反应速率:υ = k [CH3-Br] [OH-] 二级反应
大风中的雨伞
构型反转
H3C
Cl
H3C
H
H
H + OH
H
+ Cl OH
图 5-3 双分子亲核取代反应机理
亲核试剂的进攻与离去基团的离去同时发生
LiAlH4 + 4H2O
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤代烷。
NaBH4
RX
RH
氢碘酸作还原剂也可将卤代烷还原为烷烃。
HI
RX
RH
5.1.3 亲核取代反应历程
δR δX + Nu 反应物 亲核试剂
R Nu + X 产 物 离去基团
亲核取代反应机理 SN1(单分子亲核取代 ) SN2(双分子亲核取代)
影响亲核取代反应活性的因素
1)、反应物烃基的结构
(6个σ-π)
(2个σ-π)
CH3 CH3CH2-C-CH3
OH-/ 醇
CH3 CH3-CH=C-CH3 +
CH3 CH3CH2-C =CH2
Br
71% (9个σ-π)
29% (5个σ-π)
经验规律:消除结果为生成的双键碳上连有的烃基
最多的产物为主——扎依采夫规则
卤代烷的消除反应,多数情况下常常与取代反应同时进行
HO + H3C Br H2O CH3OH + Br
H HO + H C Br
H
HH
δ-
δ-
HO C Br
H
H
H HO C + Br
H
反应速率:υ = k [CH3-Br] [OH-] 二级反应
大风中的雨伞
构型反转
H3C
Cl
H3C
H
H
H + OH
H
+ Cl OH
图 5-3 双分子亲核取代反应机理
亲核试剂的进攻与离去基团的离去同时发生
LiAlH4 + 4H2O
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤代烷。
NaBH4
RX
RH
氢碘酸作还原剂也可将卤代烷还原为烷烃。
HI
RX
RH
5.1.3 亲核取代反应历程
δR δX + Nu 反应物 亲核试剂
R Nu + X 产 物 离去基团
亲核取代反应机理 SN1(单分子亲核取代 ) SN2(双分子亲核取代)
影响亲核取代反应活性的因素
1)、反应物烃基的结构
有机化学 第五章 卤代烃

O
O
O
两种机理的比较: a.中间状态: SN2-过渡态,构型翻转;
SN1-碳正离子,外消旋化。 b.卤代烃的反响活性顺序:
c. 离去基碱性越强,越难离去: -OH, -OR, -NH2一般不 直接离去,而以共轭酸的形式离去〔H2O, ROH, NH3〕。
3. 亲核取代反响的实例
(1) 被-OH取代:卤代烃与 NaOH 或 KOH 的水溶液共 热,X被-OH 取代,产物为醇。这个反响也叫水解。
(苄基碳正离子)
HH
Nu H
C
H
H
Br H
CH2=CHCH2Br SN2 过 渡 态
* 乙烯型卤化物与芳香型卤化物很难发生亲核取代反响。
以下每一对化合物,哪一个更易进行SN1反响?
CH3
a. CH3CH2CH2CHCH3 CH3CH2CCH3
(B)
(A) Br
Br (B)
b.
CH
Br (A)
CH2Br
(A)
(B)
以下每一对化合物,哪一个更易进行SN2反响?
Cl
a. CH3CH2CH2CCH3
CH3 CH3 (A)
CH3CH2CH2CHCH3 Cl
(B)
(B)
b. CH3CCHCH3 CH3CH2CHCHCH3
(B)
H3C I
(A)
H3C I (B)
2〕离去基团——卤原子的影响
* X-离去倾向:I- > Br- > Cl- > F-
一、 亲核取代反响
中心碳原子
RCH2–A + Nu:
RCH2–Nu + A:
底物 〔进入基团〕
产物 离去基团
第五章 卤代烃

烃 Br
按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
大学有机化学第五章卤代烃PPT课件

思考题
思考题3:卤代烃的应用 举例说明卤代烃在日常生活和工业生产中的应用。
THANKS
感谢观看
02
卤代烃的结构与性质
结构
卤素取代烃基
卤代烃是烃分子中的氢原子被卤素取 代后的化合物,一般用R-X表示,其 中R是烃基,X是卤素原子。
碳卤键
碳卤键是卤代烃分子中碳原子和卤素 原子之间的共价键,键能较高,稳定 性好。
物理性质
状态
随着分子中碳原子数的增加,卤代烃由气态逐渐变为液态,最后变为固态。
溶解性
氧化还原反应
卤代烃可被氧化成酮、醇或醛,也可被还原成烃或醚。
04
卤代烃的应用与实例பைடு நூலகம்
应用领域
药物合成
卤代烃在药物合成中常作为重要的中间 体,用于合成多种药物,如抗生素、抗
癌药物等。
工业溶剂
卤代烃如四氯化碳、氯仿等常作为工 业溶剂,用于清洗、稀释和萃取等。
农业化学品
卤代烃在农业中用作杀虫剂、除草剂 和植物生长调节剂等,如2,4-D等。
分为饱和卤代烃、不饱和卤代烃和芳 香族卤代烃。
卤代烃的命名
选择主链
选择最长的碳链作为主链,并标明其碳原子 数。
编号
从靠近卤素原子的碳原子开始编号,并标明 其他取代基的位置。
取代基
按照次序规则,列出其他取代基的名称和位 置。
系统命名法
采用国际通用的IUPAC系统命名法,遵循“ 取代基在前,数字在后”的原则。
大学有机化学第五章卤代 烃ppt课件
• 卤代烃的分类与命名 • 卤代烃的结构与性质 • 卤代烃的合成与反应机理 • 卤代烃的应用与实例 • 习题与思考题
01
卤代烃的分类与命名
卤代烃的分类
《有机化学》05 卤代烃

2RLi + CuI 无水乙醚 R2CuLi + Li I
二烷基铜锂
用途:制备复杂结构的烷烃(科里豪斯反应)
R2CuLi + R′X
R R′+ RCu + LiX
R可是1°、2°、3 ° R′X最好是1° 也可是不活泼的卤代烃如 RCH=CHX
§1.4 亲核取代反应历程
1.单分子反应历程(SN1)— 叔卤代烷水解
外消旋体
OH
+ H2O OH- (SN1历 程)
+
CH3
CH3
CH3 OH
2.双分子反应历程(SN2)— 伯卤代烷水解
一步完成(新键的形成和旧键的断裂同步进行), 无中间体生成,经过一个不稳定的“过渡态”。
RCH2Br + OH -
H
HO + H C B r H
RCH2OH + Br-
H
δ
δ
HO…C …B r
两步反应(SN1反应是分两步完成) 第一步:
第二步:
反应的第一步是卤代烃电离生成活性中间体碳正离 子,碳正离子再与碱进行第二步反应生成产物。故 SN1反应中有活性中间体——碳正离子生成。
水也可作为亲核试剂作用
水解反应速率取决于第一步,仅与反应物卤代烷 的浓度有关,而与亲核试剂的浓度无关,所以称为 单分子亲核取代反应(SN1反应)。
Nu C + L -
如:
CH3
Cl + H2O
OH- (SN2历 程)
CH3 OH
3. SN1与 SN2反应的竞争
小
SN1
大
CH3X RCH2X R2CHX R3CX
大
小
有机化学课件--第五章 卤代烃

第一部分
一.
卤代烷(本章重点)
卤代烷类型和命名
R X ( X = F, Cl, Br, I)
1. 卤代烷通式:
R Cl , R Br ,
R
I
R F
性质接近 通常总称卤代烷
性质特殊 氟代烷
2. 卤代烷的类型
一卤代
二卤代
R
多卤代
R RCH2 X R CH X R
C R
X
伯(一级)卤代烷
仲(二级)卤代烷
H3CH2C
C H
H3CH2C
HC H
CH2
1, 2H 迁移
迁移动力:生成更稳定的正碳离子
其它形式的碳正离子的重排
CH3 H3CH2C C H CH2
~H
H3CH2C
CH3 C CH2 H
1, 2H 迁移
CH3 H3 C C CH3 CHCH3
~ CH3
CH3 H3 C C CHCH3 CH3
CH3 H3C Br
o
空间位阻效应 电子效应
R OH + Br
CH3
>
H3C
CH2
Br
>
H3C
CH Br
>
H3C
C CH3
Br
相对 速率 100
7.99
0.22
~0
Acetone(丙酮) R Br + NaI
SN1 机理:单分子取代,二步机理 反应速率 = k[RX] 手性底物反应发生消旋化
5. 碳正离子(Carbocation, Carbonium ion)
碳正离子:一类碳上只带有六个电子的活泼中间体
第5章-卤代烃幻灯片课件

C H 2 C H 2 C l
三、不同类型卤代烃的鉴别
2.乙烯型卤代烯烃(不活泼)
氯原子 不活泼
0.172nm 0.177nm
0.138nm 0.134nm
氯原子的未共用电子 对所处的p轨道与双键 中的π轨道相互交盖, 形成p-π共轭体系。氯 原子上的电子云往碳 原子方向偏转,发生 了键长的平均化
Br Cl
3-甲基-1-氯丁烷
2-氯-3-溴丁烷
二、命名
(二)系统命名法
2.不饱和卤烃
(1)包含不饱和键和卤原子在内的最长碳链 为主链。
(2)编号:使不饱和键的位号最小。
CH2=CH-CH2-Cl
3-氯-1-丙烯
CH2=CH-CH2-CH2
Br
4-溴-1-丁烯
二、命名
(二)系统命名法
3.芳香卤烃
性质。 3.熟悉卤代烃的分类。 4.熟悉不饱和卤代烃的取代反应活性。 5.了解卤代烃的亲核取代反应机理和消
除反应机理。
第一节 卤代烃的分类和命名
一、分类
(一)一卤代烃、二卤代烃和多卤代烃 (二)脂肪卤代烃和芳香卤代烃 (三)伯卤代烃、仲卤代烃和叔卤代烃
二、命名
(一)普通命名 (二)系统命名
(溴甲烷的碱性水解)
离去基团
Sp2杂 化
Sp3杂 化
Sp3杂 化
亲核试剂在离 去基和碳原子 间价健的背面
进攻
过渡态
二、化学性质
双分子亲核取代反应特点:
(1)反应速率与卤代烷及亲核试 剂的浓度有关;
(2)原共价键的断裂与新共价键 的形成同时进行,反应一步完成。
(3)决定反应速率的一步没有活 性中间体碳正离子。
三、不同类型卤代烃的鉴别
三、不同类型卤代烃的鉴别
2.乙烯型卤代烯烃(不活泼)
氯原子 不活泼
0.172nm 0.177nm
0.138nm 0.134nm
氯原子的未共用电子 对所处的p轨道与双键 中的π轨道相互交盖, 形成p-π共轭体系。氯 原子上的电子云往碳 原子方向偏转,发生 了键长的平均化
Br Cl
3-甲基-1-氯丁烷
2-氯-3-溴丁烷
二、命名
(二)系统命名法
2.不饱和卤烃
(1)包含不饱和键和卤原子在内的最长碳链 为主链。
(2)编号:使不饱和键的位号最小。
CH2=CH-CH2-Cl
3-氯-1-丙烯
CH2=CH-CH2-CH2
Br
4-溴-1-丁烯
二、命名
(二)系统命名法
3.芳香卤烃
性质。 3.熟悉卤代烃的分类。 4.熟悉不饱和卤代烃的取代反应活性。 5.了解卤代烃的亲核取代反应机理和消
除反应机理。
第一节 卤代烃的分类和命名
一、分类
(一)一卤代烃、二卤代烃和多卤代烃 (二)脂肪卤代烃和芳香卤代烃 (三)伯卤代烃、仲卤代烃和叔卤代烃
二、命名
(一)普通命名 (二)系统命名
(溴甲烷的碱性水解)
离去基团
Sp2杂 化
Sp3杂 化
Sp3杂 化
亲核试剂在离 去基和碳原子 间价健的背面
进攻
过渡态
二、化学性质
双分子亲核取代反应特点:
(1)反应速率与卤代烷及亲核试 剂的浓度有关;
(2)原共价键的断裂与新共价键 的形成同时进行,反应一步完成。
(3)决定反应速率的一步没有活 性中间体碳正离子。
三、不同类型卤代烃的鉴别
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CH2CH2CHCH3 Br
Mg BuOBu
CH3CH2CH2CHCH3 MgBr
Grignard试剂与水、醇、胺等含活泼氢的化合 物反应生成烃类
CH3CH2CH2CHCH3 MgBr
H2O H2SO4
CH3CH2CH2CH2CH3
Organic Chem
2.有机锂化合物
一卤代烷和金属锂反应生成有机锂化合物
Organic Chem
β- 消除:
C X CH
NaOH / 乙醇
C C
扎依采夫规则(Zaitsev) β- 消除反应中主要产物为双键上烃基取代最多 的烯烃。
(脱去的是含氢较少的β-碳原子上的氢)
Organic Chem
(三)还原反应
一卤代烷可以用氢化铝锂或硼氢化钠还原成烷烃。
RX + LiAlH4 RH
Organic Chem
不同的卤代烃消去反应的速度不同,叔卤代烷最容 易,仲卤代烷次之,伯卤代烷最难。
Br H3C CH2 CH CH3 Br H3C CH2 C CH3 CH3
H3CHC CHCH3 +H3CH2CHC CH2 81% 19% CH3 + H3CH2CC CH2 H3CHC C CH3 H3C 71% 29%
仲丁基氯
(CH3)3CCl
叔丁基氯
Organic Chem
二. 一卤代烷的结构和化学性质
δ + δ-
-C-X
极性共价键
SP3-P
C-X键能比C-H键能小
Organic Chem
化学性质: (一)取代反应
R
亲核试剂 Nu
CH2 X
-
R
CH2 Nu + X 离去基团
底物
反应是由带负电荷(或孤对电子)的试剂进攻 带正电荷的C原子引起的——亲核取代(SN)
构型翻转 构型翻转:
构型保持
产物和反应物的构型相反(Walden翻转)
Organic Chem
反应过程的能量变化:
Organic Chem
(2)单分子亲核取代反应(SN1)
实验证明:叔卤代烷的水解是按照SN1反应历程进行的。
(CH3)3CBr + OH-
H2O
(CH3)3COH + Br-
反应速度仅取决于底物的浓度,与[OH-]无关,在动力 学上称为一级反应
ROH + XROR' + XRCN + XRI + XRSH + XRNH2 + XROH + XRONO2 + AgX R'O R + X-
Organic Chem
卤代烃的亲核取代生成多类重要产物,用途最广的 有机反应之一. 反应活性:
RI > RBr > RCl > RF
CH2=CHX Ph-X
C4 H9Cl + 2Li Cl(Br) -10 C 石油醚或苯 C4 H9Li + LiCl Li + 2Li + LiX
一卤代烷与金属锂反应活性顺序: RI > RBr > RCl > RF 一般多用RBr 和 RCl
Organic Chem
3.二烷基铜锂.
烷基锂在四氢呋喃溶液中和碘化亚铜反应生成二 烷基铜锂,
C
CH3
C2H5OCH3
CH3 CH2 CH3 C CH2CH3
C
CH3
C2H5OH
C2H5 OH
CH3 CH3 CH3 CH2
C
CH3
OC2 H5
CH3
C
CH2CH3
OC2 H5
Organic Chem
SN1反应特点 1、两步完成 2、反应速度只 与RX有关
SN2反应特点: 1、一步完成 2、反应速度和RX、 亲核 试剂有关系
Organic Chem
C. 亲核试剂的影响 试剂的亲核性越强越有利于SN2反应。 CH3CH2Br + CH3CH2ONa
C2H5OH
C2H5OC2H5+NaBr
在乙醇溶液中回流时间仅为几分钟,但没有乙醇钠, 在纯乙醇溶液中回流4昼夜仅有50%反应。
一般常见亲核试剂的亲核性见表5.4。
Organic Chem
RX + H2O
C4H9Br + NaHSO4
Organic Chem
AlH3 + RCH3 + LiX
Organic Chem
(四)有机金属化合物
1. 有机镁化合物 Gringnard试剂: 由卤代烃和金属镁在无水乙醚中制 备的有机镁化合物(RMgX)。
RX + Mg
实际为混合物:
无水乙醚
RMgX
RMgX
R2Mg + MgX2
Organic Chem
一卤代烷生成Grignard试剂的反应活性顺序 RI > RBr > RCl > RF 例:
RX被还原的难易:RI (易) > RBr > RCl (难)
一卤代烷在还原反应中的活性次序:
伯卤代烷 > 仲卤代烷 >叔卤代烷
Organic Chem
反应机理
LiAlH4 + H2O LiAlH4
H3AlH + CH2 R
LiOH + Al(OH)3 + H2 Li+ + -AlH4
X + Li+
δNu δX
Nu- +
C
X
C
过渡态
Nu
Nu C X
C
Organic Chem
立体化学
n-C6H13 H CH3
HOn-C6H13 H CH3
C
Br
HO
C
n-C6H13 H CH3
C
OH
(R)-2-溴辛烷 []D=-34.6o
(S)-2-辛醇 []D=+9.9o
(R)-2-辛醇 []D=+9.9o
D. 溶剂极性的影响 溶剂的极性增加对SN1历程有利,对SN2历程不利。
R X δ+ R δX R X
ROH + X-
RX + OH-
过渡态电荷集中 HO R X
过渡态电荷分散
SN1
例:
(CH3)3CBr + Sol-OH
(CH3)3C O
Sol + HBr
Sol-OH
C2H5OH
80%C2H5OH 50%C2H5OH 20%H2O 50%H2O
2RLi + CuI
R2CuLi + LiI
二烷基铜锂与卤代烷反应可生成烷烃。
R2CuLi + R'X R R' + RCu + LiX
卤代烷与二烷基铜锂起反应的活性大小次序:
CH3X > RCH2X > R2CHX RI>RBr > RCl > RF
Organic Chem
三.亲核取代反应的机理
叔卤代烷主要进行SN1反应,伯卤代烷主要进行 SN2反应,仲卤代烷两种历程均可,由反应条件决定
Organic Chem
B. 离去基团的影响 例: 80%乙醇 (CH3)3CX + H2O X: F 相对速度: 10-5 Cl 1
(CH3)3COH + HX
Br 39
I 99
对SN反应:离去基团碱性越弱,越易离去。 碱性:指和质子结合能力的强弱。 碱性顺序:I- > Br- > Cl- > F离去难易顺序:I- > Br- > Cl- > F-
(b). 对SN1反应的影响 SN1的速控步骤:
RX R+ + X-
碳正离子越稳定, SN1速度越快。
(CH3)3C 相对速度 100 Br (CH3)2CHBr 45 EtBr 1.7 CH3 1.0 Br
结论:
3º RX > 2º RX > 1º RX
Organic Chem
小结:普通卤代烃的SN反应 对SN1反应:3º RX > 2º RX > 1º RX 对SN2反应:1º RX > 2º RX > 3º RX
(CH3)3CI
仲卤代烷
叔卤代烷
2.命名: 系统命名法: 作为 烷烃的卤代衍生物命名 例:
Br CH3 Cl CH3
H3C CH CH2 CH CH3
2-甲基-4-溴戊烷
H3C CH CH CH2 CH3
3-甲基-2-氯戊烷
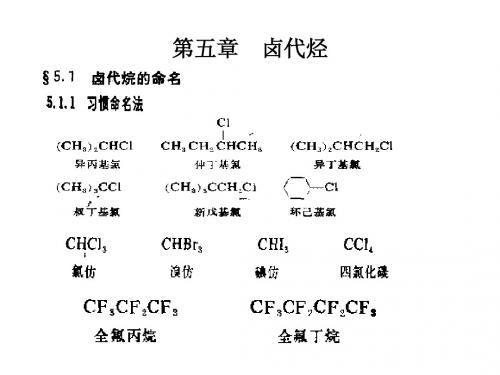
习惯命名: (CH3)2CHCl
异丙基氯
根据卤素原子所连烃基命名
CH3CH2CH(Cl)CH3
极性小有利
易离去有利
试剂的亲核性
无关
亲核能力强有利
Organic Chem
四.一卤代烷的制法
1. 烷烃的卤化
CH3 + Cl2
hv
Cl CH3
2. 烯烃的加成
CH3 CH CH2
HX
CH3 CH CH3 X
Organic Chem
3. 由醇制备
ROH + HX
C4H9OH + NaBr + H2SO4
R: CH3 相对速度: 150
Organic Chem
β-取代基的影响:
无水乙醇 RCH2Br + C2H5O55C ROC2H5
R: 相对速度:
CH3 100
C2H5 28
(CH3)2CH 3
(CH3)3C 0.00042
结论:
。 。 。 CH3X > 1 RX > 2 RX > 3 RX
Mg BuOBu
CH3CH2CH2CHCH3 MgBr
Grignard试剂与水、醇、胺等含活泼氢的化合 物反应生成烃类
CH3CH2CH2CHCH3 MgBr
H2O H2SO4
CH3CH2CH2CH2CH3
Organic Chem
2.有机锂化合物
一卤代烷和金属锂反应生成有机锂化合物
Organic Chem
β- 消除:
C X CH
NaOH / 乙醇
C C
扎依采夫规则(Zaitsev) β- 消除反应中主要产物为双键上烃基取代最多 的烯烃。
(脱去的是含氢较少的β-碳原子上的氢)
Organic Chem
(三)还原反应
一卤代烷可以用氢化铝锂或硼氢化钠还原成烷烃。
RX + LiAlH4 RH
Organic Chem
不同的卤代烃消去反应的速度不同,叔卤代烷最容 易,仲卤代烷次之,伯卤代烷最难。
Br H3C CH2 CH CH3 Br H3C CH2 C CH3 CH3
H3CHC CHCH3 +H3CH2CHC CH2 81% 19% CH3 + H3CH2CC CH2 H3CHC C CH3 H3C 71% 29%
仲丁基氯
(CH3)3CCl
叔丁基氯
Organic Chem
二. 一卤代烷的结构和化学性质
δ + δ-
-C-X
极性共价键
SP3-P
C-X键能比C-H键能小
Organic Chem
化学性质: (一)取代反应
R
亲核试剂 Nu
CH2 X
-
R
CH2 Nu + X 离去基团
底物
反应是由带负电荷(或孤对电子)的试剂进攻 带正电荷的C原子引起的——亲核取代(SN)
构型翻转 构型翻转:
构型保持
产物和反应物的构型相反(Walden翻转)
Organic Chem
反应过程的能量变化:
Organic Chem
(2)单分子亲核取代反应(SN1)
实验证明:叔卤代烷的水解是按照SN1反应历程进行的。
(CH3)3CBr + OH-
H2O
(CH3)3COH + Br-
反应速度仅取决于底物的浓度,与[OH-]无关,在动力 学上称为一级反应
ROH + XROR' + XRCN + XRI + XRSH + XRNH2 + XROH + XRONO2 + AgX R'O R + X-
Organic Chem
卤代烃的亲核取代生成多类重要产物,用途最广的 有机反应之一. 反应活性:
RI > RBr > RCl > RF
CH2=CHX Ph-X
C4 H9Cl + 2Li Cl(Br) -10 C 石油醚或苯 C4 H9Li + LiCl Li + 2Li + LiX
一卤代烷与金属锂反应活性顺序: RI > RBr > RCl > RF 一般多用RBr 和 RCl
Organic Chem
3.二烷基铜锂.
烷基锂在四氢呋喃溶液中和碘化亚铜反应生成二 烷基铜锂,
C
CH3
C2H5OCH3
CH3 CH2 CH3 C CH2CH3
C
CH3
C2H5OH
C2H5 OH
CH3 CH3 CH3 CH2
C
CH3
OC2 H5
CH3
C
CH2CH3
OC2 H5
Organic Chem
SN1反应特点 1、两步完成 2、反应速度只 与RX有关
SN2反应特点: 1、一步完成 2、反应速度和RX、 亲核 试剂有关系
Organic Chem
C. 亲核试剂的影响 试剂的亲核性越强越有利于SN2反应。 CH3CH2Br + CH3CH2ONa
C2H5OH
C2H5OC2H5+NaBr
在乙醇溶液中回流时间仅为几分钟,但没有乙醇钠, 在纯乙醇溶液中回流4昼夜仅有50%反应。
一般常见亲核试剂的亲核性见表5.4。
Organic Chem
RX + H2O
C4H9Br + NaHSO4
Organic Chem
AlH3 + RCH3 + LiX
Organic Chem
(四)有机金属化合物
1. 有机镁化合物 Gringnard试剂: 由卤代烃和金属镁在无水乙醚中制 备的有机镁化合物(RMgX)。
RX + Mg
实际为混合物:
无水乙醚
RMgX
RMgX
R2Mg + MgX2
Organic Chem
一卤代烷生成Grignard试剂的反应活性顺序 RI > RBr > RCl > RF 例:
RX被还原的难易:RI (易) > RBr > RCl (难)
一卤代烷在还原反应中的活性次序:
伯卤代烷 > 仲卤代烷 >叔卤代烷
Organic Chem
反应机理
LiAlH4 + H2O LiAlH4
H3AlH + CH2 R
LiOH + Al(OH)3 + H2 Li+ + -AlH4
X + Li+
δNu δX
Nu- +
C
X
C
过渡态
Nu
Nu C X
C
Organic Chem
立体化学
n-C6H13 H CH3
HOn-C6H13 H CH3
C
Br
HO
C
n-C6H13 H CH3
C
OH
(R)-2-溴辛烷 []D=-34.6o
(S)-2-辛醇 []D=+9.9o
(R)-2-辛醇 []D=+9.9o
D. 溶剂极性的影响 溶剂的极性增加对SN1历程有利,对SN2历程不利。
R X δ+ R δX R X
ROH + X-
RX + OH-
过渡态电荷集中 HO R X
过渡态电荷分散
SN1
例:
(CH3)3CBr + Sol-OH
(CH3)3C O
Sol + HBr
Sol-OH
C2H5OH
80%C2H5OH 50%C2H5OH 20%H2O 50%H2O
2RLi + CuI
R2CuLi + LiI
二烷基铜锂与卤代烷反应可生成烷烃。
R2CuLi + R'X R R' + RCu + LiX
卤代烷与二烷基铜锂起反应的活性大小次序:
CH3X > RCH2X > R2CHX RI>RBr > RCl > RF
Organic Chem
三.亲核取代反应的机理
叔卤代烷主要进行SN1反应,伯卤代烷主要进行 SN2反应,仲卤代烷两种历程均可,由反应条件决定
Organic Chem
B. 离去基团的影响 例: 80%乙醇 (CH3)3CX + H2O X: F 相对速度: 10-5 Cl 1
(CH3)3COH + HX
Br 39
I 99
对SN反应:离去基团碱性越弱,越易离去。 碱性:指和质子结合能力的强弱。 碱性顺序:I- > Br- > Cl- > F离去难易顺序:I- > Br- > Cl- > F-
(b). 对SN1反应的影响 SN1的速控步骤:
RX R+ + X-
碳正离子越稳定, SN1速度越快。
(CH3)3C 相对速度 100 Br (CH3)2CHBr 45 EtBr 1.7 CH3 1.0 Br
结论:
3º RX > 2º RX > 1º RX
Organic Chem
小结:普通卤代烃的SN反应 对SN1反应:3º RX > 2º RX > 1º RX 对SN2反应:1º RX > 2º RX > 3º RX
(CH3)3CI
仲卤代烷
叔卤代烷
2.命名: 系统命名法: 作为 烷烃的卤代衍生物命名 例:
Br CH3 Cl CH3
H3C CH CH2 CH CH3
2-甲基-4-溴戊烷
H3C CH CH CH2 CH3
3-甲基-2-氯戊烷
习惯命名: (CH3)2CHCl
异丙基氯
根据卤素原子所连烃基命名
CH3CH2CH(Cl)CH3
极性小有利
易离去有利
试剂的亲核性
无关
亲核能力强有利
Organic Chem
四.一卤代烷的制法
1. 烷烃的卤化
CH3 + Cl2
hv
Cl CH3
2. 烯烃的加成
CH3 CH CH2
HX
CH3 CH CH3 X
Organic Chem
3. 由醇制备
ROH + HX
C4H9OH + NaBr + H2SO4
R: CH3 相对速度: 150
Organic Chem
β-取代基的影响:
无水乙醇 RCH2Br + C2H5O55C ROC2H5
R: 相对速度:
CH3 100
C2H5 28
(CH3)2CH 3
(CH3)3C 0.00042
结论:
。 。 。 CH3X > 1 RX > 2 RX > 3 RX
