第五章 卤代烃
合集下载
第五章 卤代烃
CH3CH2CH Br 2-溴丁烷 CH3 CH3CH2CCH3 Br
CH3
KOH/乙醇
CH3CH
CHCH3 + CH3CH2CH
CH2
2-丁烯(81%)
1-丁烯(19%)
NaOC2H5 C2H5OH
CH3CH
C(CH3)2 + CH3CH2C CH3
CH2
2-甲基-2-溴丁烷
2-甲基-2-丁烯(70%) 2-甲基-1-丁烯(30%)
共轭效应
共轭体系: 单双键交替出现的体系。
C=C–C=C–C=C - 共轭 C=C–C p - 共轭 + C=C–C
定义:在共轭体系中,由于原子间的一种相互影响而使体系 内的电 子( 或p电子)分布发生变化的一种电子效应。 给电子共轭效应用+C表示
X C C C C
吸电子共轭效应用-C表示
C2H5O C2H5OH
C H3 C H3 C C H C H3 C H3O C2H5
(S N2)
(SN1)
C2H 5O C2H5OH
C H3 C H3 C C H C H3 重排 C H3
+
CH3 CH3 C CH CH3 CH3
+
C2H5O C H3
C2H5O C2H5OH
C H3 C C H C H3 C H3
第五章
卤代烃
1、 碳卤键的特点
成键轨道
Csp3
等性杂化
Xsp 3
极性共价键, 成键电子对偏 向X.
不等性杂化
2、键长
C—H 110 C—F C—C 139 154 C—Cl 176 C—Br C— I 194 214 (pm)
第五章.卤代烃

9%
(6个σ-π)
(2个σ-π)
CH3 CH3CH2-C-CH3
OH-/ 醇
CH3 CH3-CH=C-CH3 +
CH3 CH3CH2-C =CH2
Br
71% (9个σ-π)
29% (5个σ-π)
经验规律:消除结果为生成的双键碳上连有的烃基
最多的产物为主——扎依采夫规则
卤代烷的消除反应,多数情况下常常与取代反应同时进行
HO + H3C Br H2O CH3OH + Br
H HO + H C Br
H
HH
δ-
δ-
HO C Br
H
H
H HO C + Br
H
反应速率:υ = k [CH3-Br] [OH-] 二级反应
大风中的雨伞
构型反转
H3C
Cl
H3C
H
H
H + OH
H
+ Cl OH
图 5-3 双分子亲核取代反应机理
亲核试剂的进攻与离去基团的离去同时发生
LiAlH4 + 4H2O
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤代烷。
NaBH4
RX
RH
氢碘酸作还原剂也可将卤代烷还原为烷烃。
HI
RX
RH
5.1.3 亲核取代反应历程
δR δX + Nu 反应物 亲核试剂
R Nu + X 产 物 离去基团
亲核取代反应机理 SN1(单分子亲核取代 ) SN2(双分子亲核取代)
影响亲核取代反应活性的因素
1)、反应物烃基的结构
(6个σ-π)
(2个σ-π)
CH3 CH3CH2-C-CH3
OH-/ 醇
CH3 CH3-CH=C-CH3 +
CH3 CH3CH2-C =CH2
Br
71% (9个σ-π)
29% (5个σ-π)
经验规律:消除结果为生成的双键碳上连有的烃基
最多的产物为主——扎依采夫规则
卤代烷的消除反应,多数情况下常常与取代反应同时进行
HO + H3C Br H2O CH3OH + Br
H HO + H C Br
H
HH
δ-
δ-
HO C Br
H
H
H HO C + Br
H
反应速率:υ = k [CH3-Br] [OH-] 二级反应
大风中的雨伞
构型反转
H3C
Cl
H3C
H
H
H + OH
H
+ Cl OH
图 5-3 双分子亲核取代反应机理
亲核试剂的进攻与离去基团的离去同时发生
LiAlH4 + 4H2O
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤代烷。
NaBH4
RX
RH
氢碘酸作还原剂也可将卤代烷还原为烷烃。
HI
RX
RH
5.1.3 亲核取代反应历程
δR δX + Nu 反应物 亲核试剂
R Nu + X 产 物 离去基团
亲核取代反应机理 SN1(单分子亲核取代 ) SN2(双分子亲核取代)
影响亲核取代反应活性的因素
1)、反应物烃基的结构
第五章 卤代烃

烃 Br
按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
大学有机化学第五章卤代烃PPT课件

思考题
思考题3:卤代烃的应用 举例说明卤代烃在日常生活和工业生产中的应用。
THANKS
感谢观看
02
卤代烃的结构与性质
结构
卤素取代烃基
卤代烃是烃分子中的氢原子被卤素取 代后的化合物,一般用R-X表示,其 中R是烃基,X是卤素原子。
碳卤键
碳卤键是卤代烃分子中碳原子和卤素 原子之间的共价键,键能较高,稳定 性好。
物理性质
状态
随着分子中碳原子数的增加,卤代烃由气态逐渐变为液态,最后变为固态。
溶解性
氧化还原反应
卤代烃可被氧化成酮、醇或醛,也可被还原成烃或醚。
04
卤代烃的应用与实例பைடு நூலகம்
应用领域
药物合成
卤代烃在药物合成中常作为重要的中间 体,用于合成多种药物,如抗生素、抗
癌药物等。
工业溶剂
卤代烃如四氯化碳、氯仿等常作为工 业溶剂,用于清洗、稀释和萃取等。
农业化学品
卤代烃在农业中用作杀虫剂、除草剂 和植物生长调节剂等,如2,4-D等。
分为饱和卤代烃、不饱和卤代烃和芳 香族卤代烃。
卤代烃的命名
选择主链
选择最长的碳链作为主链,并标明其碳原子 数。
编号
从靠近卤素原子的碳原子开始编号,并标明 其他取代基的位置。
取代基
按照次序规则,列出其他取代基的名称和位 置。
系统命名法
采用国际通用的IUPAC系统命名法,遵循“ 取代基在前,数字在后”的原则。
大学有机化学第五章卤代 烃ppt课件
• 卤代烃的分类与命名 • 卤代烃的结构与性质 • 卤代烃的合成与反应机理 • 卤代烃的应用与实例 • 习题与思考题
01
卤代烃的分类与命名
卤代烃的分类
《有机化学》05 卤代烃

2RLi + CuI 无水乙醚 R2CuLi + Li I
二烷基铜锂
用途:制备复杂结构的烷烃(科里豪斯反应)
R2CuLi + R′X
R R′+ RCu + LiX
R可是1°、2°、3 ° R′X最好是1° 也可是不活泼的卤代烃如 RCH=CHX
§1.4 亲核取代反应历程
1.单分子反应历程(SN1)— 叔卤代烷水解
外消旋体
OH
+ H2O OH- (SN1历 程)
+
CH3
CH3
CH3 OH
2.双分子反应历程(SN2)— 伯卤代烷水解
一步完成(新键的形成和旧键的断裂同步进行), 无中间体生成,经过一个不稳定的“过渡态”。
RCH2Br + OH -
H
HO + H C B r H
RCH2OH + Br-
H
δ
δ
HO…C …B r
两步反应(SN1反应是分两步完成) 第一步:
第二步:
反应的第一步是卤代烃电离生成活性中间体碳正离 子,碳正离子再与碱进行第二步反应生成产物。故 SN1反应中有活性中间体——碳正离子生成。
水也可作为亲核试剂作用
水解反应速率取决于第一步,仅与反应物卤代烷 的浓度有关,而与亲核试剂的浓度无关,所以称为 单分子亲核取代反应(SN1反应)。
Nu C + L -
如:
CH3
Cl + H2O
OH- (SN2历 程)
CH3 OH
3. SN1与 SN2反应的竞争
小
SN1
大
CH3X RCH2X R2CHX R3CX
大
小
第五章 卤代烃

R
CH CH2 + NaX + H2O
不同卤代烷烃脱卤化氢的难易次序:三级卤代烷>二级卤代烷> 一级卤代烷 当消除反应能向两个方向进行可以得到两种不同产物时,主要 产物是双键碳上连接烃基最多的烯烃,即遵循Zaitsev rule.
C H3C H2C HC H 3 Br
KOH/乙醇
C H3C H=C HC H + C H3C H2C H=C H 2 3 19% 81%
上述取代反应广泛用于有机合成。
RX + NaOH
RX + NaCN
H2O
醇
ROH + NaX
RCN + NaX
CH2CN
AlCl3
CH2Br + NaC N
+ NaC N
+ (C H )2CHBr 3
CH(CH3)2
+ HBr
CH 3
C
CNa + (CH 3)2CHCH 2I CH 3 C C CH 2CH(CH 3)2
若使用硼氢化钠或硼氢化钾,也可以使一卤代烷还原成烷烃。 但还原能力比氢化铝锂小,能在水或醇溶液中使用。
CH3(CH2)6CH2X +NaBH4
X = Cl Br I
二甘醇二甲醚
CH3(CH2)6CH3
25% 77% 100%
250C 24h 450C 1h 450C 1h
Zn +HCl RX + Na + NH3(l)
H2 Pd
RH RH RH
5.4亲核取代反应的机理
5.4.1双分子亲核取代反应机理(SN2)
O H + CH3Br
有机化学课件--第五章 卤代烃

第一部分
一.
卤代烷(本章重点)
卤代烷类型和命名
R X ( X = F, Cl, Br, I)
1. 卤代烷通式:
R Cl , R Br ,
R
I
R F
性质接近 通常总称卤代烷
性质特殊 氟代烷
2. 卤代烷的类型
一卤代
二卤代
R
多卤代
R RCH2 X R CH X R
C R
X
伯(一级)卤代烷
仲(二级)卤代烷
H3CH2C
C H
H3CH2C
HC H
CH2
1, 2H 迁移
迁移动力:生成更稳定的正碳离子
其它形式的碳正离子的重排
CH3 H3CH2C C H CH2
~H
H3CH2C
CH3 C CH2 H
1, 2H 迁移
CH3 H3 C C CH3 CHCH3
~ CH3
CH3 H3 C C CHCH3 CH3
CH3 H3C Br
o
空间位阻效应 电子效应
R OH + Br
CH3
>
H3C
CH2
Br
>
H3C
CH Br
>
H3C
C CH3
Br
相对 速率 100
7.99
0.22
~0
Acetone(丙酮) R Br + NaI
SN1 机理:单分子取代,二步机理 反应速率 = k[RX] 手性底物反应发生消旋化
5. 碳正离子(Carbocation, Carbonium ion)
碳正离子:一类碳上只带有六个电子的活泼中间体
第5章-卤代烃幻灯片课件

C H 2 C H 2 C l
三、不同类型卤代烃的鉴别
2.乙烯型卤代烯烃(不活泼)
氯原子 不活泼
0.172nm 0.177nm
0.138nm 0.134nm
氯原子的未共用电子 对所处的p轨道与双键 中的π轨道相互交盖, 形成p-π共轭体系。氯 原子上的电子云往碳 原子方向偏转,发生 了键长的平均化
Br Cl
3-甲基-1-氯丁烷
2-氯-3-溴丁烷
二、命名
(二)系统命名法
2.不饱和卤烃
(1)包含不饱和键和卤原子在内的最长碳链 为主链。
(2)编号:使不饱和键的位号最小。
CH2=CH-CH2-Cl
3-氯-1-丙烯
CH2=CH-CH2-CH2
Br
4-溴-1-丁烯
二、命名
(二)系统命名法
3.芳香卤烃
性质。 3.熟悉卤代烃的分类。 4.熟悉不饱和卤代烃的取代反应活性。 5.了解卤代烃的亲核取代反应机理和消
除反应机理。
第一节 卤代烃的分类和命名
一、分类
(一)一卤代烃、二卤代烃和多卤代烃 (二)脂肪卤代烃和芳香卤代烃 (三)伯卤代烃、仲卤代烃和叔卤代烃
二、命名
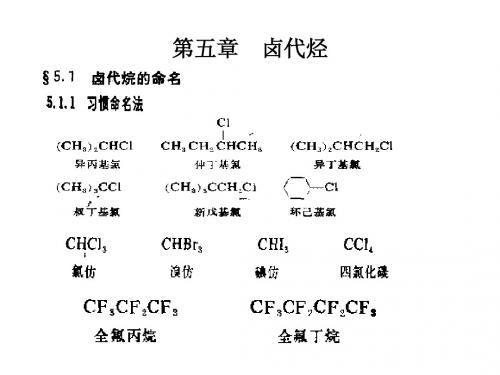
(一)普通命名 (二)系统命名
(溴甲烷的碱性水解)
离去基团
Sp2杂 化
Sp3杂 化
Sp3杂 化
亲核试剂在离 去基和碳原子 间价健的背面
进攻
过渡态
二、化学性质
双分子亲核取代反应特点:
(1)反应速率与卤代烷及亲核试 剂的浓度有关;
(2)原共价键的断裂与新共价键 的形成同时进行,反应一步完成。
(3)决定反应速率的一步没有活 性中间体碳正离子。
三、不同类型卤代烃的鉴别
三、不同类型卤代烃的鉴别
2.乙烯型卤代烯烃(不活泼)
氯原子 不活泼
0.172nm 0.177nm
0.138nm 0.134nm
氯原子的未共用电子 对所处的p轨道与双键 中的π轨道相互交盖, 形成p-π共轭体系。氯 原子上的电子云往碳 原子方向偏转,发生 了键长的平均化
Br Cl
3-甲基-1-氯丁烷
2-氯-3-溴丁烷
二、命名
(二)系统命名法
2.不饱和卤烃
(1)包含不饱和键和卤原子在内的最长碳链 为主链。
(2)编号:使不饱和键的位号最小。
CH2=CH-CH2-Cl
3-氯-1-丙烯
CH2=CH-CH2-CH2
Br
4-溴-1-丁烯
二、命名
(二)系统命名法
3.芳香卤烃
性质。 3.熟悉卤代烃的分类。 4.熟悉不饱和卤代烃的取代反应活性。 5.了解卤代烃的亲核取代反应机理和消
除反应机理。
第一节 卤代烃的分类和命名
一、分类
(一)一卤代烃、二卤代烃和多卤代烃 (二)脂肪卤代烃和芳香卤代烃 (三)伯卤代烃、仲卤代烃和叔卤代烃
二、命名
(一)普通命名 (二)系统命名
(溴甲烷的碱性水解)
离去基团
Sp2杂 化
Sp3杂 化
Sp3杂 化
亲核试剂在离 去基和碳原子 间价健的背面
进攻
过渡态
二、化学性质
双分子亲核取代反应特点:
(1)反应速率与卤代烷及亲核试 剂的浓度有关;
(2)原共价键的断裂与新共价键 的形成同时进行,反应一步完成。
(3)决定反应速率的一步没有活 性中间体碳正离子。
三、不同类型卤代烃的鉴别
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CH2CHCH3 KOH/EtOH Br
CH3CH
CHCH3 + CH3CH2CH
CH2
81%
19%
CH3 CH3CH2CCH3 KOH/EtOH Br CH3CH
CH3
CH3 CH2
CCH3 + CH3CH2C
2-甲基 丁烯 甲基-2-丁烯 甲基 71%
2-甲基 丁烯 甲基-1-丁烯 甲基 29%
二、命名 (1)简单卤代烃:烃基后加卤素。 (1)简单卤代烃:烃基后加卤素。或称“卤(代)某烷”。 简单卤代烃 某烷” CH3Cl 甲基氯 氯(代)甲烷 CH3CH2Br 乙基溴 溴(代)乙烷 CH2=CH-Cl 乙烯基氯 CH2=CHCH2-Cl 溴代环己烷 烯丙基氯
CH3 CH CH3
Cl
Br
扎依采夫规则: 扎依采夫规则:
消除反应的主要产物是双键上烃基最多的烯烃。
(从产物烯烃的稳定性判断) 从产物烯烃的稳定性判断)
d. 消除反应常与取代反应同时进行,即互为竞争反应。 消除反应常与取代反应同时进行,即互为竞争反应。
消除
R CH2 CH2 Br
KOH/EtOH 取代
R CH CH2 R CH2 CH2 OEt
异丙基氯 氯代异丙烷
系统命名法: (2) 系统命名法:卤素作为取代基
H3C Br CH3CHCHCH3
1 2 3 4
3-溴-2-甲基丁烷 2-溴-3-甲基丁烷
H3C Br CH3CH2CHCHCH3
5 4 3 2 1
2-溴-3-甲基戊烷
Br CH3 CH CH CH CH3 5 2 3 1 4
4-溴-2-戊烯
反应速度 (SN2, SN1 ): RI > RBr > RCl > RF : 强离去基团趋向于S 历程;弱离去基团趋向于S 历程。 强离去基团趋向于 N1 历程;弱离去基团趋向于 N2 历程。
+ CH2 CH CH2
CH2 CH Cl
P-π共轭体系
5-4 亲核取代反应历程和消除反应历程
一、饱和碳原子上的亲核取代反应历程 在研究卤代烷的水解动力学时, 在研究卤代烷的水解动力学时 发现伯卤代烷和叔卤代烷遵循 不同的动力学方程: 不同的动力学方程
CH3
Br +
OH-
CH3
OH + Br-
v = k [CH3Br] [ OH-]
Br + OHR3C OH + Br-
而
R3C
v = k [R3CBr]
1、双分子亲核取代反应机理(SN2): 、双分子亲核取代反应机理
OH + CH3
-
Br
慢
[ HO-CH3-Br ]
CH3
OH + Br-
v = k [CH3Br] [ OH-]
2、 单分子亲核取代反应机理 N1): 、 单分子亲核取代反应机理(S
(CH3CH2)2O
2CH3CH2OH + 2Ag2Br
2. 氰解 与NaCN作用 作用
R-X + NaCN -
C2H5OH △
R-CN + NaX -
腈
CH3CH2Br + NaCN
C2H5OH △
CH3CH2CN + NaBr
C2H5OH H3C H3C CH CN + NaBr CH Br + NaCN H3C H3C △ 2-甲基丙腈 此为增长碳链的方法之一。 此为增长碳链的方法之一。
β CH H α KOH/EtOH CH2 X
R
RCH
CH2 + HX
a. 卤代烷的β碳原子必须有氢原子, 才能发生消除反应; 卤代烷的β碳原子必须有氢原子 才能发生消除反应; b. 此为在分子中引入 此为在分子中引入C=C双键的方法之一; 双键的方法之一; 双键的方法之一 c. 反应活性:叔卤代烷>仲卤代烷>伯卤代烷 反应活性:叔卤代烷>仲卤代烷> 对于仲、叔卤代烷进行消除反应时,有两种可能的产物 对于仲、叔卤代烷进行消除反应时,有两种可能的产物:
5-3 化学性质
一、亲核取代反应
δ+ δ− C X
X的电负性越大,则键的极性越强。 的电负性越大,则键的极性越强。 的电负性越大 C-Cl > C-Br > C-I
但发生亲核取代反应的活性次序却为: 但发生亲核取代反应的活性次序却为:C-I > C-Br > C-Cl
亲核取代反应通式为: 亲核取代反应通式为
CH3X SN2
RCH2X SN2
R2CHX SN2, SN1 ,
R3CX SN1
卤原子的影响(离去基团的影响) ⑵ 卤原子的影响(离去基团的影响) 卤离子的离去倾向: 卤离子的离去倾向:I > Br > Cl > F 与它们的电负性次序相反,但与 键的键能次序一致。 与它们的电负性次序相反,但与C-X键的键能次序一致。 键的键能次序一致
SN1反应: 反应: 反应
3、影响亲核取代反应的因素 、 ⑴ 烃基结构的影响 R-X + KI 丙酮 R-I + KBr
反应历程进行的反应速度: 按SN2反应历程进行的反应速度: 反应历程进行的反应速度 R= CH3 CH3CH2 (CH3)2CH (CH3)3C 1 0.02 0.001
相对速率: 30
第五章
卤代烃
• 卤代烃的分类和命名 • 物理性质和化学性质 • 亲核取代反应历程 • 消除反应历程 • 重要的卤代烃
5-1 卤代烃的分类和命名
• 卤代烃: R-X 一、分类 卤代烷 卤代烯烃 CH3CH2CH2CH2Br CH2=CHCl 氯乙烯 1-溴丁烷 官能团: -X(F、Cl、Br、I) X Cl、Br、
Br CH3 Br CH3CHCH2CHCHCH3
6 5 4 3 2 1
3,5-二溴-2-甲基己烷
Br CH3 Cl CH2 CH CH CH2 4 3 2 1
4-氟-1-氯-3-溴-2-甲基丁烷
F
5-2
物理性质
• 常温常压下,氯甲烷、氯乙烷和溴甲烷:气体。 其它:液体或固体。 • 沸点:烃基相同的一卤代烷,碘代烷>溴代烷>氯代烷 沸点: • 密度:一氟代烷、一氯代烷密度小于1, 密度: 一溴代烷、一碘代烷和多卤代烷密度大于1。 • 不溶水,溶于大多数有机溶剂。 • 卤代烷在铜丝上燃烧产生绿色火焰,可用来定性鉴定卤原 子。 • 有难闻气味,蒸气有毒(皮肤吸收)。
CH3CH2Br + CH3
COO-Ag+
CH3COOCH2CH3 + AgBr 乙酸乙酯
CH3 CH3 C2H5OH CH3COOCHCH3 CH3CH Br + CH3COO-Na+ △ 乙酸异丙酯
6. 与其它亲核试剂反应 与硫氢化钠反应 R-X -
SH-
R-SH 硫醇
-SH:巯基,氢硫基
CH3CH2Br + SH-
ห้องสมุดไป่ตู้
卤代烃的S 反应速度 反应速度: 卤代烃的 N2反应速度: CH3X >伯卤代烷>仲卤代烷>叔卤代烷 伯卤代烷>仲卤代烷> 原因:空间位阻效应。 原因:空间位阻效应。
历程水解的相对反应速度: 在50℃水中,按SN1历程水解的相对反应速度: ℃水中, 历程水解的相对反应速度 化合物: (CH3)3C-Br 相对速度: 1200000 卤代烃的S 反应速度 反应速度: 卤代烃的 N1反应速度: 叔卤代烷>仲卤代烷>伯卤代烷>CH3X 叔卤代烷>仲卤代烷>伯卤代烷> 碳正离子历程,碳正离子稳定性越大,反应速度越快。 碳正离子历程,碳正离子稳定性越大,反应速度越快。 (CH3)2CH-Br 11.6 CH3CCH2-Br 1.00 CH3-Br 1.05
CH2Cl CH2OH
H2O
但在一般条件下
Cl
H2O
卤代烷的水解反应,常伴随着消除反应。 卤代烷的水解反应,常伴随着消除反应。
R CH2 CH2 Br +OH-
R-CH=CH2 + HBr - =
卤代烷与Ag 在乙醚的悬浮水溶液中水解 可避免消除反应。 在乙醚的悬浮水溶液中水解, 卤代烷与 2O在乙醚的悬浮水溶液中水解,可避免消除反应。 2CH3CH2-Br + Ag2O + H2O
CH3CH=CHCH2Cl 1-氯-2-丁烯
卤代环烷烃
Br
溴代环己烷 溴苯
Br
CH2Br
苯溴甲烷 (苄溴)
卤代芳香烃
一卤代烃 二卤代烃 多卤代烃
CH3Cl 一氯甲烷 CHCl3 三氯甲烷 (氯仿) 氯仿
CH2Cl2 二氯甲烷 F2C=CF2 四氟乙烯
伯(第一)卤代烃 第一) 仲(第二)卤代烃 第二) 叔(第三)卤代烃 第三)
二级反应
R3C
R3C+
Br
+ OH-
慢 快
R3C+ + BrR3C OH
v = k [R3CBr]
一级反应
SN2反应: 反应: 反应
• 亲核试剂从离去基团背后进攻中心碳原子,引起中心碳原子 亲核试剂从离去基团背后进攻中心碳原子, 构型的转化——瓦尔登(Walden)转化。 瓦尔登( 构型的转化 瓦尔登 Walden)转化。 • 取代反应发生构型转化是 N2反应的重要标志。 取代反应发生构型转化是S 反应的重要标志 反应的重要标志。
R
X + Nu亲核试剂
R
Nu + X离去基团
1. 水解
与碱的水溶液作用
R
X
KOH/H2O
R
OH + KX
CH3 CH2 Br + OH-
CH3 CH2 OH + Br-
CH3
