第五章卤代烃
合集下载
第五章 卤代烃
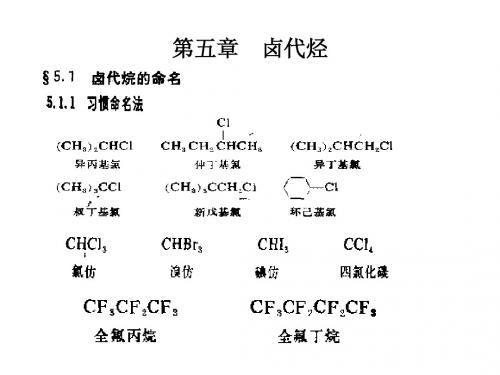
CH3CH2CH Br 2-溴丁烷 CH3 CH3CH2CCH3 Br
CH3
KOH/乙醇
CH3CH
CHCH3 + CH3CH2CH
CH2
2-丁烯(81%)
1-丁烯(19%)
NaOC2H5 C2H5OH
CH3CH
C(CH3)2 + CH3CH2C CH3
CH2
2-甲基-2-溴丁烷
2-甲基-2-丁烯(70%) 2-甲基-1-丁烯(30%)
共轭效应
共轭体系: 单双键交替出现的体系。
C=C–C=C–C=C - 共轭 C=C–C p - 共轭 + C=C–C
定义:在共轭体系中,由于原子间的一种相互影响而使体系 内的电 子( 或p电子)分布发生变化的一种电子效应。 给电子共轭效应用+C表示
X C C C C
吸电子共轭效应用-C表示
C2H5O C2H5OH
C H3 C H3 C C H C H3 C H3O C2H5
(S N2)
(SN1)
C2H 5O C2H5OH
C H3 C H3 C C H C H3 重排 C H3
+
CH3 CH3 C CH CH3 CH3
+
C2H5O C H3
C2H5O C2H5OH
C H3 C C H C H3 C H3
第五章
卤代烃
1、 碳卤键的特点
成键轨道
Csp3
等性杂化
Xsp 3
极性共价键, 成键电子对偏 向X.
不等性杂化
2、键长
C—H 110 C—F C—C 139 154 C—Cl 176 C—Br C— I 194 214 (pm)
第五章.卤代烃

9%
(6个σ-π)
(2个σ-π)
CH3 CH3CH2-C-CH3
OH-/ 醇
CH3 CH3-CH=C-CH3 +
CH3 CH3CH2-C =CH2
Br
71% (9个σ-π)
29% (5个σ-π)
经验规律:消除结果为生成的双键碳上连有的烃基
最多的产物为主——扎依采夫规则
卤代烷的消除反应,多数情况下常常与取代反应同时进行
HO + H3C Br H2O CH3OH + Br
H HO + H C Br
H
HH
δ-
δ-
HO C Br
H
H
H HO C + Br
H
反应速率:υ = k [CH3-Br] [OH-] 二级反应
大风中的雨伞
构型反转
H3C
Cl
H3C
H
H
H + OH
H
+ Cl OH
图 5-3 双分子亲核取代反应机理
亲核试剂的进攻与离去基团的离去同时发生
LiAlH4 + 4H2O
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤代烷。
NaBH4
RX
RH
氢碘酸作还原剂也可将卤代烷还原为烷烃。
HI
RX
RH
5.1.3 亲核取代反应历程
δR δX + Nu 反应物 亲核试剂
R Nu + X 产 物 离去基团
亲核取代反应机理 SN1(单分子亲核取代 ) SN2(双分子亲核取代)
影响亲核取代反应活性的因素
1)、反应物烃基的结构
(6个σ-π)
(2个σ-π)
CH3 CH3CH2-C-CH3
OH-/ 醇
CH3 CH3-CH=C-CH3 +
CH3 CH3CH2-C =CH2
Br
71% (9个σ-π)
29% (5个σ-π)
经验规律:消除结果为生成的双键碳上连有的烃基
最多的产物为主——扎依采夫规则
卤代烷的消除反应,多数情况下常常与取代反应同时进行
HO + H3C Br H2O CH3OH + Br
H HO + H C Br
H
HH
δ-
δ-
HO C Br
H
H
H HO C + Br
H
反应速率:υ = k [CH3-Br] [OH-] 二级反应
大风中的雨伞
构型反转
H3C
Cl
H3C
H
H
H + OH
H
+ Cl OH
图 5-3 双分子亲核取代反应机理
亲核试剂的进攻与离去基团的离去同时发生
LiAlH4 + 4H2O
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤代烷。
NaBH4
RX
RH
氢碘酸作还原剂也可将卤代烷还原为烷烃。
HI
RX
RH
5.1.3 亲核取代反应历程
δR δX + Nu 反应物 亲核试剂
R Nu + X 产 物 离去基团
亲核取代反应机理 SN1(单分子亲核取代 ) SN2(双分子亲核取代)
影响亲核取代反应活性的因素
1)、反应物烃基的结构
第五章 卤代烃

烃 Br
按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
大学有机化学第五章卤代烃PPT课件

思考题
思考题3:卤代烃的应用 举例说明卤代烃在日常生活和工业生产中的应用。
THANKS
感谢观看
02
卤代烃的结构与性质
结构
卤素取代烃基
卤代烃是烃分子中的氢原子被卤素取 代后的化合物,一般用R-X表示,其 中R是烃基,X是卤素原子。
碳卤键
碳卤键是卤代烃分子中碳原子和卤素 原子之间的共价键,键能较高,稳定 性好。
物理性质
状态
随着分子中碳原子数的增加,卤代烃由气态逐渐变为液态,最后变为固态。
溶解性
氧化还原反应
卤代烃可被氧化成酮、醇或醛,也可被还原成烃或醚。
04
卤代烃的应用与实例பைடு நூலகம்
应用领域
药物合成
卤代烃在药物合成中常作为重要的中间 体,用于合成多种药物,如抗生素、抗
癌药物等。
工业溶剂
卤代烃如四氯化碳、氯仿等常作为工 业溶剂,用于清洗、稀释和萃取等。
农业化学品
卤代烃在农业中用作杀虫剂、除草剂 和植物生长调节剂等,如2,4-D等。
分为饱和卤代烃、不饱和卤代烃和芳 香族卤代烃。
卤代烃的命名
选择主链
选择最长的碳链作为主链,并标明其碳原子 数。
编号
从靠近卤素原子的碳原子开始编号,并标明 其他取代基的位置。
取代基
按照次序规则,列出其他取代基的名称和位 置。
系统命名法
采用国际通用的IUPAC系统命名法,遵循“ 取代基在前,数字在后”的原则。
大学有机化学第五章卤代 烃ppt课件
• 卤代烃的分类与命名 • 卤代烃的结构与性质 • 卤代烃的合成与反应机理 • 卤代烃的应用与实例 • 习题与思考题
01
卤代烃的分类与命名
卤代烃的分类
《有机化学》05 卤代烃

2RLi + CuI 无水乙醚 R2CuLi + Li I
二烷基铜锂
用途:制备复杂结构的烷烃(科里豪斯反应)
R2CuLi + R′X
R R′+ RCu + LiX
R可是1°、2°、3 ° R′X最好是1° 也可是不活泼的卤代烃如 RCH=CHX
§1.4 亲核取代反应历程
1.单分子反应历程(SN1)— 叔卤代烷水解
外消旋体
OH
+ H2O OH- (SN1历 程)
+
CH3
CH3
CH3 OH
2.双分子反应历程(SN2)— 伯卤代烷水解
一步完成(新键的形成和旧键的断裂同步进行), 无中间体生成,经过一个不稳定的“过渡态”。
RCH2Br + OH -
H
HO + H C B r H
RCH2OH + Br-
H
δ
δ
HO…C …B r
两步反应(SN1反应是分两步完成) 第一步:
第二步:
反应的第一步是卤代烃电离生成活性中间体碳正离 子,碳正离子再与碱进行第二步反应生成产物。故 SN1反应中有活性中间体——碳正离子生成。
水也可作为亲核试剂作用
水解反应速率取决于第一步,仅与反应物卤代烷 的浓度有关,而与亲核试剂的浓度无关,所以称为 单分子亲核取代反应(SN1反应)。
Nu C + L -
如:
CH3
Cl + H2O
OH- (SN2历 程)
CH3 OH
3. SN1与 SN2反应的竞争
小
SN1
大
CH3X RCH2X R2CHX R3CX
大
小
第五章 卤代烃

R
CH CH2 + NaX + H2O
不同卤代烷烃脱卤化氢的难易次序:三级卤代烷>二级卤代烷> 一级卤代烷 当消除反应能向两个方向进行可以得到两种不同产物时,主要 产物是双键碳上连接烃基最多的烯烃,即遵循Zaitsev rule.
C H3C H2C HC H 3 Br
KOH/乙醇
C H3C H=C HC H + C H3C H2C H=C H 2 3 19% 81%
上述取代反应广泛用于有机合成。
RX + NaOH
RX + NaCN
H2O
醇
ROH + NaX
RCN + NaX
CH2CN
AlCl3
CH2Br + NaC N
+ NaC N
+ (C H )2CHBr 3
CH(CH3)2
+ HBr
CH 3
C
CNa + (CH 3)2CHCH 2I CH 3 C C CH 2CH(CH 3)2
若使用硼氢化钠或硼氢化钾,也可以使一卤代烷还原成烷烃。 但还原能力比氢化铝锂小,能在水或醇溶液中使用。
CH3(CH2)6CH2X +NaBH4
X = Cl Br I
二甘醇二甲醚
CH3(CH2)6CH3
25% 77% 100%
250C 24h 450C 1h 450C 1h
Zn +HCl RX + Na + NH3(l)
H2 Pd
RH RH RH
5.4亲核取代反应的机理
5.4.1双分子亲核取代反应机理(SN2)
O H + CH3Br
有机化学课件--第五章 卤代烃

第一部分
一.
卤代烷(本章重点)
卤代烷类型和命名
R X ( X = F, Cl, Br, I)
1. 卤代烷通式:
R Cl , R Br ,
R
I
R F
性质接近 通常总称卤代烷
性质特殊 氟代烷
2. 卤代烷的类型
一卤代
二卤代
R
多卤代
R RCH2 X R CH X R
C R
X
伯(一级)卤代烷
仲(二级)卤代烷
H3CH2C
C H
H3CH2C
HC H
CH2
1, 2H 迁移
迁移动力:生成更稳定的正碳离子
其它形式的碳正离子的重排
CH3 H3CH2C C H CH2
~H
H3CH2C
CH3 C CH2 H
1, 2H 迁移
CH3 H3 C C CH3 CHCH3
~ CH3
CH3 H3 C C CHCH3 CH3
CH3 H3C Br
o
空间位阻效应 电子效应
R OH + Br
CH3
>
H3C
CH2
Br
>
H3C
CH Br
>
H3C
C CH3
Br
相对 速率 100
7.99
0.22
~0
Acetone(丙酮) R Br + NaI
SN1 机理:单分子取代,二步机理 反应速率 = k[RX] 手性底物反应发生消旋化
5. 碳正离子(Carbocation, Carbonium ion)
碳正离子:一类碳上只带有六个电子的活泼中间体
第五章 卤代烃

CH3CH2CHCH3 KOH/EtOH Br
CH3CH
CHCH3 + CH3CH2CH
CH2
81%
19%
CH3 CH3CH2CCH3 KOH/EtOH Br CH3CH
CH3
CH3 CH2
CCH3 + CH3CH2C
2-甲基 丁烯 甲基-2-丁烯 甲基 71%
2-甲基 丁烯 甲基-1-丁烯 甲基 29%
二、命名 (1)简单卤代烃:烃基后加卤素。 (1)简单卤代烃:烃基后加卤素。或称“卤(代)某烷”。 简单卤代烃 某烷” CH3Cl 甲基氯 氯(代)甲烷 CH3CH2Br 乙基溴 溴(代)乙烷 CH2=CH-Cl 乙烯基氯 CH2=CHCH2-Cl 溴代环己烷 烯丙基氯
CH3 CH CH3
Cl
Br
扎依采夫规则: 扎依采夫规则:
消除反应的主要产物是双键上烃基最多的烯烃。
(从产物烯烃的稳定性判断) 从产物烯烃的稳定性判断)
d. 消除反应常与取代反应同时进行,即互为竞争反应。 消除反应常与取代反应同时进行,即互为竞争反应。
消除
R CH2 CH2 Br
KOH/EtOH 取代
R CH CH2 R CH2 CH2 OEt
异丙基氯 氯代异丙烷
系统命名法: (2) 系统命名法:卤素作为取代基
H3C Br CH3CHCHCH3
1 2 3 4
3-溴-2-甲基丁烷 2-溴-3-甲基丁烷
H3C Br CH3CH2CHCHCH3
5 4 3 2 1
2-溴-3-甲基戊烷
Br CH3 CH CH CH CH3 5 2 3 1 4
4-溴-2-戊烯
反应速度 (SN2, SN1 ): RI > RBr > RCl > RF : 强离去基团趋向于S 历程;弱离去基团趋向于S 历程。 强离去基团趋向于 N1 历程;弱离去基团趋向于 N2 历程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本章难点:
卤代烷的亲核取代反应的反应机理和影响 因素
烃分子中的一个或多个氢原子被卤素取
代而生成的化合物称卤代烃
(halohydrocarbon),简称卤烃。
卤原子(F、 Cl、 Br、 I)是卤代烃的官
能团。
结构通式为:R—X
第一节
卤代烃的分类和命名
一、分类
氟代烃 氯代烃 根据卤素原子不同分为: 溴代烃 碘代烃
攻,所以可以得到构型保持和构型转化的产
物(产物构型外消旋化)。
反应过程
Br -离去
进攻 边 - 从左 OH
OH
从 右 边 进
攻
例:s-3-溴-3-甲基己烷水解
C H2C H2C H3 C C H3 C2H5 Br
空p轨道
C H3C H2C H2 C C H3 C2H5
C H3C H2C H2 HO C C H3 C2H5
fluoride chloride bromide iodide
系统命名法
选含卤原子的最长碳链作为主链,
卤原子作为取代基,按照烷烃或烯烃
的命名法编号,支链和不同取代基按
立体化学中的“次序规则”排列,
“优先”基团后列出 :
第一节
卤代烃的分类和命名
Cl
C H3C C H C HC H 2 3 Cl C H3 4-甲基-2,2-二氯戊烷 2,2-dichloro-4-methylpentane
X
CH2 X
孤立型卤代烯烃 RCH=CH(CH2)nCH2X
n≥1
二、命名 普通命名法
在烃基名称之前(或后)加上卤素的名
称,称为卤(代)某烃或某烃基卤。 CHCl3 C2H5Cl (CH3)3CBr CH2=CHBr
Br
三氯甲烷 氯乙烷 叔丁基溴
氯 仿 乙基氯
溴乙烯(乙烯基溴)
溴 苯
第一节
卤代烃的分类和命名
CH3CHCHCHCH2Cl Cl CH3
2-甲基-4-苯基-1,3-二氯戊烷 1,3-dichloro-2-methyl-4-phenylpentane
第二节 卤代烃的物理性质
1、状态:常温下,氟甲烷、氟乙烷、氯甲烷、 氯乙烷和溴甲烷为气体,其余一卤代烃多为无 色液体,15个碳以上的卤代烷多为固体。多数 卤代烃有难闻的 气味,蒸气有毒。 2、比重:一般比水重。 3、溶解性:难溶于水,易溶于醇、醚、烃等有 机溶剂。卤代烃是常用溶剂。 4、卤代烃在铜丝上灼烧产生绿色火焰,可用于 卤代烃的简单鉴定。
H2O ,
R OH + NaX
醇类 又称为卤代烷的水解反应。
特点:反应可逆,反应速度很慢,常将卤代 烷与强碱水溶液共热进行水解。可用于制备 醇类。
卤代烃反应难易:R—I>R—Br>R—Cl
2. 醇解反应(被烷氧基取代)
卤代烃与醇钠反应生成醚。
R X
+ NaOR`
R O
醚类
R` + NaX
这是合成醚的反应--威廉森(Williamson)合成法 通常采用伯卤代烷,因为醇钠是强碱,容易产 生消除反应,使得仲卤代烷的取代产率通常较
C H2C H2C H3 C C H3 C2H5 OH
R 构型翻转
S 构型保持
SN1反应的另一特征是碳正离子的重排:
CH 3 CH3 C CH CH 3 H2O SN1 CH3 CH 3 C CH 3 CH 3 CH3 C CH 3 CH CH 3 H2O H
+
CH
CH 3
CH 3 Br 重排
OH CH3 C CH 3
反应进展
叔丁基溴水解反应(SN1)的能量曲线
由于反应速率由慢的第一步控制,其速
率只与叔卤代烃的浓度有关,而与亲核
试剂的浓度无关。这种反应历程称为单
分子反应历程(unimolecular
Nucleophilic Substitution), 用 SN1表 示。
SN1反应的难易取决于正碳离子的稳定性。
根据卤原子数的多少可分为: 一卤代烃
多卤代烃
H3C CH2 Cl
Br CH2 CH2 I
饱和卤烃
RCH2X
按烃基的不同分 不饱和卤烃 RCH=CHX 卤代芳烃 Ar-X 根据卤素所连的碳原子不同类型分为:
伯卤烃 RCH2X
仲卤烃 R2CHX
叔卤烃 R3CX
根据卤素与双键的相对位置分
卤代乙烯型 RCH=CHX 卤代烯丙型 RCH=CHCH2X
丁烷参与了反应速率的控制步骤,在动力学
-
上称为一级反应。
第一步:
(R)3C
X
慢
[(R)3C
δ + δ-
X]
(R)3C + X
叔正碳离子
+
_
过渡态A 第二步:
(R)3C +
+
_快 OH
δ+ δ[(R)3C OH] 过渡态B
(R)3C OH
决定速率的过渡态
Ea1
(CH3)3C+
Ea2
E
(CH3)3CBr + OHH (CH3)3CO + H (CH3)3COH + HBr
卤代烃的亲核取代反应可用通式表示:
中心碳原子
+
δ δ R CH2 X
+
Nu
RCH2
产物
Nu + X
-
底物
亲核试剂
离去 基团
反应特点:试剂中带负电荷或含有孤电子 对的部分进攻带部分正电荷的碳,C-X键断 裂,卤素被取代。
亲核取代反应(nucleophilic-substitution): 由亲核试剂首先进攻电子云密度较低的中心碳
据化学动力学和立体化学等许多实验结果
表明,卤代烷的亲核取代反应,通常按两
种反应机理进行:
SN1──单分子亲核取代反应 SN2──双分子亲核取代反应
1、双分子亲核取代反应(SN2)
溴甲烷的碱性水解过程是双分子反应历程。
CH3Br
+
NaOH
H2O
CH3OH
NaBr
v=k[CH3Br][OH-]
由于反应速度不但与卤代烷的浓度有关, 而且与亲核试剂浓度有关,此历程为双分 子反应历程(bimolecular nucleophilic substitution),用SN2表示。
3、 影响亲核取代反应的因素
在一个反应中,SN1和SN2反应是同时进 行的。哪种占优势,受多种因素的影响。 主要影响因素有:
烷基的结构
离去基团的离去倾向
亲核试剂
溶剂的极性等
(1)烷基结构的影响
甲酸 RBr + H2O
SN1相对速率 108
-
ROH + HBr
1.7
(C H3)3C Br > H3)2C HBr >C H C H2Br >C H3Br (C 3 45 1.0
CH3CH2Cl + NaCN 醇 CH3CH2CN H3O CH3CH2COOH
5. 与硝酸根取代
卤烷与硝酸银的醇溶液共热,卤原子被硝酸 根取代生成硝酸酯和卤化银。
RX + AgNO3
Ag+ONO2-
醇
R ONO2 + AgX
硝酸酯
• 因有卤化银沉淀产生,这反应可作为卤代 烃的鉴别反应。 卤烃反应活性:烯丙基卤烃>叔卤烃>仲~>伯~
烯丙基溴 Allyl bromide
CH2 CH CH2Br
Br CH3
CH2Cl
邻溴甲苯 2-bromotoluene
苄基氯(氯化苄) benzyl chloride
卤素英文名称和字头:
Fluorine Chlorine Bromine Iodine
fluoro (-F) chloro(-Cl) bromo(-Br) iodo(-I)
第三节 卤代烃的化学性质
卤代烃的化学性质是由于卤原子的存 在所引起的。
δ++ δ+
R CH CH2 H Xδ
亲核取代反应 消除反应
与金属反应
一、亲核取代反应
1 被羟基(-OH)取代——水解 2 被烃氧基(-OR)取代——醇解 3 被氨基(-NH2)取代——氨解 4 被氰基(-CN)取代——氰解 5 被硝酸根(-ONO2)取代——与 硝酸银的醇溶液作用
-
RBr + I
丙酮 25℃
RI + Br
C H3Br > C H3C H2Br > (C H3)2C HBr > (C H3)3C Br SN2相对速率 150 1 0.01 0.001
态,不是中间体,故反应是一步完成的。
SN2的能量曲线:
H H
HO
H
Br
过渡态
E
CH3Br+ OH CH3OH +Br
反应进展
SN2反应的难易取决于卤代烷的空间位阻的 大小,空间位阻愈小,愈易按SN2反应。
空间位阻大小的顺序:
CH3X <伯卤代烷<仲~<叔~ 不同卤代烷SN2反应的相对速度:
第五章 卤代烃
Halohydrocarbons
本章主要内容
卤代烃的命名;伯、仲、叔卤代烷的结构 卤代烷的亲核取代反应及反应机理和影响 因素 消除反应及机理;消除与取代的竞争 有机金属化合物的生成与应用
本章重点:
卤代烷的亲核取代反应及反应机理和影响 因素 消除反应及机理;消除与取代的竞争 有机金属化合物的生成与应用
原子而引起的取代反应,用SN表示。 亲核试剂(nucleophilic reagent):
