高中生物实验知识:过氧化氢酶活性的测定
过氧化氢酶活力的测定

实验三过氧化氢酶活性的测定一、实验目的:了解过氧化氢酶的作用,掌握碘量法测定过氧化氢酶活性的原理和方法;二、实验原理:过氧化氢酶是一类色素蛋白,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢既是氧化剂又是还原剂。
R(Fe+2)2+H2O2---R(Fe+3OH)2R(Fe+3OH)2+ H2O2 ----R(Fe+2)2+2H2O+O2并合上式:H2O2 ----2H2O+O2据此,可根据消耗H2O2的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量的过氧化氢溶液,经酶促反应后,加入过量的KI溶液生成的I2用标准的Na2S2O3滴定,根据N a2SO3消耗的体积计算H2O2的消耗量。
三、实验材料、仪器和试剂:1、实验材料:小白菜2、仪器:恒温水浴锅、研钵、容量瓶、刻度吸管、100mL三角瓶3、试剂:(1)0.05mol/L H2O2 (2)2mol/LH2SO4(3)0.1mol/L Na2S2O3(4)1%淀粉溶液(5)10%(NH4)6Mo7O24(6)pH7.8的磷酸缓冲液(7)20% KI(8)CaCO3四、实验步骤:(1)酶液提取:称取2.5g白菜叶,加少量CaCO3,2mLpH7.8的缓冲液少量,研成匀浆,移入100ml容量瓶,用上述缓冲液冲洗研钵数次转入容量瓶中定容,静置10分钟,过滤。
取滤液10mL于另一100mL的容量瓶中稀释定容待测(根据酶活高低而定)。
(2)酶促反应:取锥形瓶4个,编好号各加入10ml酶液之后,立即向两个瓶中加入2mol/L H2SO45mL,终止酶活性,作空白对照。
向另外两瓶各加H2O2 5mL,摇匀,在加入H2O2的那一刻起,记录时间,5分钟后迅速向实验瓶中加入2mol/LH2SO45mL,终止酶活性。
向三角瓶中加1mL 20% KI和3滴(NH4)6Mo7O24,摇匀后迅速用标准Na2S2O3溶液进行滴定至淡黄色,加入1mL1%淀粉指试剂,蓝色恰好消失,记录消耗的Na 2S 2O 3的体积V 0,V ;五、结果记录与数据处理:被分解的H 2O 2量(mg )=(空白滴定值-样品滴定值)×Na 2S 2O 3摩尔浓度×17 过氧化氢酶活性(mg.g -1.min -1)=(min))()()(O H 22时间样品重测定取液量总体积量被分解的 g mg 六、 结果分析与问题讨论:实验十还原型V C含量测定一、实验目的学会从生物样品中提取维生素C方法,了解蔬菜中维生素C的含量。
(完整版)实验35过氧化氢酶的活性测定
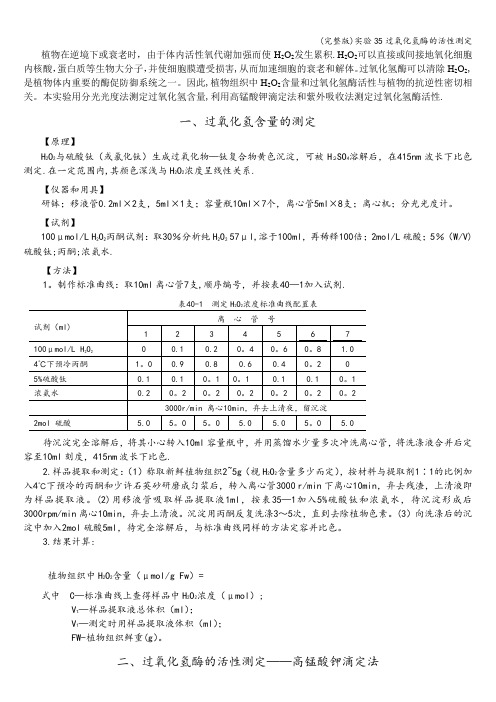
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积.H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性.一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定.在一定范围内,其颜色深浅与H2O2浓度呈线性关系.【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水.【方法】1。
制作标准曲线:取10ml离心管7支,顺序编号,并按表40—1加入试剂.待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色.2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35—1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
3.结果计算:植物组织中H2O2含量(μmol/g Fw)=式中 C—标准曲线上查得样品中H2O2浓度(μmol);V t—样品提取液总体积(ml);V1—测定时用样品提取液体积(ml);FW-植物组织鲜重(g)。
过氧化氢酶活力检测方法

过氧化氢酶活力检测方法过氧化氢酶(catalase)是一种重要的酶类物质,它在生物体内起着催化无毒的氧化还原反应,将过氧化氢(H2O2)分解成水(H2O)和氧气(O2)。
由于其在维持细胞内氢离子浓度、氧化还原平衡和细胞抵抗氧化应激等方面的重要作用,因此过氧化氢酶活性的准确测定和分析显得非常必要。
在实验室中,常用的过氧化氢酶活力检测方法主要有光度法、气体检测法和电化学检测法。
首先是光度法,这是一种常用的测定过氧化氢酶活力的方法。
实验中,可以通过分光光度计测量酶样溶液中过氧化氢的浓度的变化来推测过氧化氢酶的活性。
具体的测定步骤一般为:首先,在酶样溶液中加入过氧化氢;然后,在适宜的温度下进行一段时间的潜伏期;然后,用过氧化氢检测试剂滴定到一定浓度时,观察溶液的颜色变化,并用分光光度计读取吸光度。
根据吸光度的变化可以计算出过氧化氢酶的活性。
第二种方法是气体检测法,这是一种基于检测氧气产生的方法。
实验中,可以将过氧化氢溶液加入酶样溶液中,然后用带有氧气传感器的电极测量氧气的产生速率和浓度。
根据氧气产生速率的变化可以推断过氧化氢酶的活性。
第三种方法是电化学检测法,这是一种基于电流变化的方法。
实验中,可以将过氧化氢溶液加入酶样溶液中,然后通过电极测量氧气的生成速率。
根据电流的变化可以计算出过氧化氢酶的活性。
除了以上的方法,还有其他一些比较新颖的方法用于测定过氧化氢酶活性。
例如,近年来,一些研究人员采用蛋白质组学和质谱分析等技术,通过检测酶样溶液中蛋白质的表达水平和酶活性的相关性,来推断过氧化氢酶的活性水平。
总结起来,测定过氧化氢酶活性的方法有光度法、气体检测法、电化学检测法等。
不同的方法有各自的优缺点,例如,光度法具有操作简单、成本低廉的特点,但可能受其他物质的干扰;气体检测法具有灵敏度高的特点,但需要专门的仪器和高昂的成本;电化学检测法具有快速、灵敏的特点,但需要较高的技术水平和仪器要求。
研究人员可以根据实际需求和条件选择合适的方法来测定过氧化氢酶的活性。
(完整版)实验35过氧化氢酶的活性测定

植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积.H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性.一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定.在一定范围内,其颜色深浅与H2O2浓度呈线性关系.【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水.【方法】1。
制作标准曲线:取10ml离心管7支,顺序编号,并按表40—1加入试剂.待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色.2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35—1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
3.结果计算:植物组织中H2O2含量(μmol/g Fw)=式中 C—标准曲线上查得样品中H2O2浓度(μmol);V t—样品提取液总体积(ml);V1—测定时用样品提取液体积(ml);FW-植物组织鲜重(g)。
高中生物实验知识:过氧化氢酶活性的测定

高中生物实验知识:过氧化氢酶活性的测定过氧化氢酶广泛存在于植物的所有组织中,能将过氧化氢分解为氧和水,可使生物机体免受过氧化氢的毒害作用。
测定过氧化氢酶的方法有测压法、滴定法以及分光光度法等。
用氧电极法测量放氧速度,方法灵敏而快速。
放氧速度与过氧化氢酶活性成正比。
仪器药品氧电极仪记录仪电磁搅拌器超级恒温水浴注射器、微量注射器容量瓶反应杯亚硫酸钠过氧化氢酶50mmol/L磷酸缓冲液,pH7.0(见附表2)。
50mmol/L过氧化氢溶液:取1.4ml30%H2O2用磷酸缓冲液定容至250ml即得。
标准过氧化氢酶溶液:称取过氧化氢酶(Sigma)1.0mg(110U/mg),溶于50mmol/L磷酸缓冲液(pH7.0)11ml中,使酶浓度为10U/ml。
操作步骤1.仪器的标定按实验88步骤进行仪器的标定,以求得记录纸上每小格相当的含氧量。
2.绘制酶活性标准曲线(1)在反应杯中放满过氧化氢磷酸缓冲液,开启电磁搅拌器搅动10分钟,插入电极,吸去溢出在电极外面的溶液,调节移位旋钮,使记录笔位于满刻度的10─20%左右,使记录纸走动,1─2分钟后温度达到平衡,记录笔画出直线。
(2)用微量注射器从电极塞小孔中注入10μ110U/ml过氧化氢酶,立即记录最初90秒钟内的氧释放曲线。
(3)根据上述同样步骤,注入不同浓度的过氧化氢酶10μl(例如浓度为20、30、40、50U/ml等),记录氧释放曲线。
(4)取放氧曲线的直线部分,根据其斜率及走纸速度,计算每分钟氧的释放量。
(5)以过氧化氢酶活性单位为横坐标,每分钟氧的释放量为纵坐标,绘制标准曲线。
3.样品测定(1)在反应怀内注入50mmol/L过氧化氢磷酸缓冲液搅动10分钟,插上电极,待记录为一直线后,注入10μl合适浓度的待测酶液样品,立即记下最初90秒钟内的放氧曲线。
(2)根据样品的放氧曲线,计算得到每分钟的放氧量,在标准曲线上查得酶活性大小。
(3)如果没有标准的过氧化氢酶,不能计算酶活性单位时,也可以用每分钟的放氧量相对地表示酶的活性大小。
过氧化氢酶活性测定(高锰酸钾滴定法)

过氧化氢酶活性测定(高锰酸钾滴定法)过氧化氢酶活性测定(高锰酸钾滴定法)一、原理过氧化氢广泛存在于生物体和土壤中,是由生物呼吸过程和有机物的生物化学氧化反应的结果产生的,这些过氧化氢对生物和土壤具有毒害作用。
与此同时,在生物体和土壤中存有过氧化氢酶,能促进过氧化氢分解为水和氧的反应(H2O2→H2O+O2),从而降低了过氧化氢的毒害作用。
土壤中过氧化氢酶的测定便是根据土壤(含有过氧化氢酶)和过氧化氢作用析出的氧气体积或过氧化氢的消耗量,测定过氧化氢的分解速度,以此代表过氧化氢酶的活性。
测定过氧化氢酶的具体方法比较多,如气量法:根据析出的氧气体积来计算过氧化氢酶的活性;比色法:根据过氧化氢与硫酸铜产生黄色或橙黄色络合物的量来表征过氧化氢酶的活性;滴定法:用高锰酸钾溶液滴定过氧化氢分解反应剩余过氧化氢的量,表示出过氧化氢酶的活性。
本实验重点采用高锰酸钾滴定法。
二、试剂(1)2mol/L H2SO4溶液:量取5.43ml的浓硫酸稀释至500ml,置于冰箱贮存;(2)0.02mol/L高锰酸钾溶液:称取1.7g高锰酸钾,加入400mL 水中,缓缓煮沸15min,冷却后定容至500mL,避光保存,用时用0.1mol/L草酸溶液标定;(3) 0.1mol/L草酸溶液:称取优级纯H2C2O4?2H2O 3.334g,用蒸馏水溶解后,定容至250ml;(4)3%的H2O2水溶液:取30% H2O2溶液25ml,定容至250ml,置于冰箱贮存,用时用0.1mol/L KMnO4溶液标定。
三、操作步骤(1)分别取2~5g土壤样品于具塞三角瓶中(用不加土样的作空白对照),加入0.5mL甲苯,摇匀,于4℃冰箱中放置30min。
(2)取出,立刻加入25mL冰箱贮存的3% H2O2水溶液,充分混匀后,再置于冰箱中放置1h。
(3)取出,迅速加入冰箱贮存的2mol/L H2SO4溶液25mL,摇匀,过滤。
(4)取1mL滤液于三角瓶,加入5mL蒸馏水和5mL 2mol/L H2SO4溶液,用0.02mol/L高锰酸钾溶液滴定。
(完整版)实验35过氧化氢酶的活性测定
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积.H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性.一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定.在一定范围内,其颜色深浅与H2O2浓度呈线性关系.【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水.【方法】1。
制作标准曲线:取10ml离心管7支,顺序编号,并按表40—1加入试剂.待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色.2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35—1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
3.结果计算:植物组织中H2O2含量(μmol/g Fw)=式中 C—标准曲线上查得样品中H2O2浓度(μmol);V t—样品提取液总体积(ml);V1—测定时用样品提取液体积(ml);FW-植物组织鲜重(g)。
过氧化氢酶活性的测定
A 空 10 5 白
B 反 10 应
55 - 1
分 钟
5
51
医学课件ppt
3
5 VA(空白)
=
VB(反应
35
液)
=
8
五、实验结果与计算:
1、被分解的H2O2量(mg) = (空白滴定值-样品滴定值)×Na2S2O3摩尔浓度×17
2、CAT活性(mg.g-1.min-1)= 被分解的H2O2量(mg)×(总体积÷测定取液量) 样品重(g)×时间(min)
H2O2(余)+2KI+H2SO4----→I2+K2SO4+2H2O
I2 +2Na2S2O3 --→2NaI+Na2S4O6(连二硫酸钠)
用硫代硫酸钠分别滴定空白液(可求出总的H2O2量)和反应
液(可求出未分解的H2O2量),再根据二者滴定值之差求出分
解的H2O2量。
医学课件ppt
5
三、实验材料、仪器和试剂:
医学课件ppt
6
四、实验步骤:
1、酶液提取:
称取0.5g三叶草,加少量石英砂,CaCO3,2ml水,研成匀浆, 移入50ml容量瓶,冲洗研钵数次,定容,静置,过滤。
2、酶促反应:
(1)取锥形瓶2个,编号A,B,各加入10ml酶液,之后立即向A瓶 中加入1.8mol/L H2SO45ml,终止酶活性,作空白滴定。
医学课件ppt
9
六、思考题:
1、本实验中影响CAT活性测定的因素有哪些?
医学课件ppt
10
记录两次消耗Na2S2O3的体积医VA学(课空件白p)p,t VB(反应液)。
7
酶活性测定
管 号
酶 液
过氧化氢酶活性的测定
过氧化氢酶活性的测定过氧化氢酶(catalase)是一种重要的酶类,在多种生物体和植物中广泛存在。
其主要作用是将氧化还原反应中产生的过氧化氢(H2O2)转化成水(H2O)和氧气(O2)。
这个反应是非常重要的,因为H2O2是一种有害物质,会破坏细胞内的蛋白质、脂质和DNA等结构。
因此,过氧化氢酶不仅保护生物体内部结构的完整性,还保护它免受外部环境的伤害。
本文将介绍过氧化氢酶活性的测定方法。
实验材料:1. 1.5 mL离心管;2. 10% 过氧化氢溶液;3. 100 mM 磷酸缓冲液(pH 7.0);4. 视网膜素(1 mg/mL)。
实验步骤:1. 将取自动物或植物的新鲜组织(例如肝脏、叶片、果实)切成小块,加入绞肉机中充分研磨,随后用冷水冲洗,挤出汁液,离心5分钟,去除颗粒,收集上清液作为酶提取物;2. 准备一组试管,分别加入0.1 mL酶提取物、0.5 mL100 mM磷酸缓冲液和0.4 mL 10% 过氧化氢溶液,并加入0.1 mL纯水作为对照试验管;3. 在试管中迅速混合,放在37℃恒温水浴中反应15分钟;4. 反应结束后,加入1 mL苯酚酐试剂,盖上盖子,轻轻颠倒,立即读取吸光度A405,并计算过氧化氢酶活性。
计算过氧化氢酶活性的公式为:过氧化氢酶活性(U/mg)= [(对照A405 - 试验A405)/ 对照A405] × 1000/ [反应体系总反应时间(分钟)÷ 酶提取体积(mL)] × 酶提取物的蛋白质浓度(mg/mL)其中,对照是不加入酶提取物的试验管,试验则是加入酶提取物的试验管。
以对照的A405为100%活性,试验管的活性则为相对活性。
过氧化氢酶的活性单位为U/mg,也可以表示为U/g或U/L。
本实验中,苯酚酐试剂可以与酶提取物中产生的H2O2发生氧化反应,形成深蓝色产物,进而测量吸光度,从而计算出过氧化氢酶的活性。
总之,本实验的目的是测定过氧化氢酶的活性,以此来了解生物体内的氧化还原反应是否正常,并研究它在细胞生物学中的作用。
实验九_过氧化氢酶(CAT)活性的测定
实验九_过氧化氢酶(CAT)活性的测定一、实验目的1.了解过氧化氢酶的作用和测定方法。
二、实验原理过氧化氢酶(CAT)是一种广泛存在于生物体内的酶,其主要作用是催化过氧化氢(H2O2)分解为水(H2O)和氧(O2),具有清除细胞内产生的过氧化氢的作用,从而保护细胞免受氧自由基的损伤。
测定过氧化氢酶活性的基本原理是利用过氧化氢酶催化过氧化氢分解的特性,测定其对过氧化氢的催化效率,从而求得过氧化氢酶的活性。
三、实验步骤1.将0.05 mL的0.1 mol/L H2O2加入到0.95 mL反应液中,混匀。
2.分别分装0.1 mL过氧化氢酶标准液A(1 U/mL)、待测样品液和纯水于三个小瓶中。
3.向3个小瓶中加入0.6 mL反应液,混匀后立即读取吸光度值。
4.将三个小瓶依次放入比色皿中,加入等体积的反应液,混匀。
5.在室温下,按照每分钟一次,共计计时5分钟,依次读取吸光度值。
6.根据吸光度值计算过氧化氢酶的活性。
四、实验注意事项1.使用新鲜的过氧化氢酶,避免长时间贮存或受热的过氧化氢酶,因其活性会降低。
2.必须按照比色皿上的顺序加入待测样品、过氧化氢酶标准液和纯水。
3.测定过氧化氢酶活性时,要注意比色皿内的反应物混匀程度和加液顺序。
4.读取吸光度时,要记录时间,使时间相同,以便计算活性值。
五、实验结果处理1.计算反应液的吸光度(OD)值。
2.计算酶活性的计算式为:CAT活性=(sample-Blank)/F/(T2-T1)其中,sample为待测样品的吸光度值;Blank为加入纯水的比色皿的吸光度值;F为稀释系数;T2-T1为反应时间,单位为分钟。
1.活性计算结果应该合理,符合实验要求。
2.实验结果能够表明过氧化氢酶的活性。
七、实验总结本次实验通过测定过氧化氢酶活性的方法,了解了测定过氧化氢酶活性的原理,熟悉了测定过氧化氢酶活性的步骤和操作方法。
同时,也掌握了计算过氧化氢酶活性的方法以及如何进行实验结果分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中生物实验知识:过氧化氢酶活性的测定过氧化氢酶广泛存在于植物的所有组织中,能将过氧化氢分解为氧和水,可使生物机体免受过氧化氢的毒害作用。
测定过氧化氢酶的方法有测压法、滴定法以及分光光度法等。
用氧电极法测量放氧速度,方法灵敏而快速。
放氧速度与过氧化氢酶活性成正比。
仪器药品
氧电极仪记录仪
电磁搅拌器超级恒温水浴
注射器、微量注射器容量瓶
反应杯亚硫酸钠
过氧化氢酶
50mmol/L磷酸缓冲液,pH7.0(见附表2)。
50mmol/L过氧化氢溶液:取1.4ml30%H2O2用磷酸缓冲液定容至250ml即得。
标准过氧化氢酶溶液:称取过氧化氢酶
(Sigma)1.0mg(110U/mg),溶于50mmol/L磷酸缓冲液
(pH7.0)11ml中,使酶浓度为10U/ml。
操作步骤
1.仪器的标定
按实验88步骤进行仪器的标定,以求得记录纸上每小格相当的含氧量。
2.绘制酶活性标准曲线
(1)在反应杯中放满过氧化氢磷酸缓冲液,开启电磁搅拌器搅动10分钟,插入电极,吸去溢出在电极外面的溶液,调节移位旋钮,使记录笔位于满刻度的10─20%左右,使记录纸走动,1─2分钟后温度达到平衡,记录笔画出直线。
(2)用微量注射器从电极塞小孔中注入10μ110U/ml过氧化氢酶,立即记录最初90秒钟内的氧释放曲线。
(3)根据上述同样步骤,注入不同浓度的过氧化氢酶10μl(例如浓度为20、30、40、50U/ml等),记录氧释放曲线。
(4)取放氧曲线的直线部分,根据其斜率及走纸速度,计算每分钟氧的释放量。
(5)以过氧化氢酶活性单位为横坐标,每分钟氧的释放量为纵坐标,绘制标准曲线。
3.样品测定
(1)在反应怀内注入50mmol/L过氧化氢磷酸缓冲液搅动10分钟,插上电极,待记录为一直线后,注入10μl合适浓度的待测酶液样品,立即记下最初90秒钟内的放氧曲线。
(2)根据样品的放氧曲线,计算得到每分钟的放氧量,在标准曲线上查得酶活性大小。
(3)如果没有标准的过氧化氢酶,不能计算酶活性单位时,也可以用每分钟的放氧量相对地表示酶的活性大小。
