(完整版)实验40植物组织中过氧化氢含量及过氧化氢酶活性测定
过氧化氢酶活力的测定实验报告

竭诚为您提供优质文档/双击可除过氧化氢酶活力的测定实验报告篇一:实验35过氧化氢酶的活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使h2o2发生累积。
h2o2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除h2o2,是植物体内重要的酶促防御系统之一。
因此,植物组织中h2o2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】h2o2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被h2so4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与h2o2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/Lh2o2丙酮试剂:取30%分析纯h2o257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(w/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml 刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视h2o2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
植物组织中过氧化氢含量及过氧化氢酶活性测定

的余多
�
e2
) HO+3+eF(R==2O2H+)2+eF(R
� �
e2
�氧子分和水为解分氢化氧过化催能它�铁有含�酶白蛋红血于属�TAC�酶氢化氧过
。剂原还是又剂化氧是既则氢化氧过�用作的子电递传起中程过此在 】理原【
�
。性活的酶氢化氧过出测可即度速化变的率光吸量测据根。低降而间时应反随
法收吸外紫——定测性活的酶氢化氧过、三
。定标新重过经要前用临液溶 2O2H 及液溶 4OnMK 用所 】意注【 。2O2H gm7.1 于当相 4OnMK 的 L/lom1.0 lm1—7.1 � �g�重鲜品样—W
;�lm�量液酶用所应反—1V �数升毫定滴 4OnMK 后应反酶—B
�算计果结.3 待�lm5 酸硫 lom2 入加中淀沉的后涤洗向)3(。素色物植除去到直�次 5�3 涤洗复反酮丙用 。色比并容定法方的样同线曲准标与�后解溶全完
表按�lm1 液取提品样取吸管液移用)2(。液取提品样为即液清上�渣残去弃�nim01 心离下 提与料材按� �定而少多量含 2O2H 视�g5~2 织组物植鲜新取称)1(�定测和取提品样.2
物植�此因。一之统系御防促酶的要重内体物植是�2O2H 除清以可酶氢化氧过。体解和老 接直以可 2O2H。积累生发 2O2H 使而强加谢代氧性活内体于由�时老衰或下境逆在物植 衰的胞细速加而从�害损受遭膜胞细使并�子分大物生等质白蛋�酸核内胞细化氧地接间或
定测性活酶氢化氧过及量含氢化氧过中织组物植 04 验实
� �lm�积体液酶粗用定测—1V � �lm�积体总液取提酶粗—tV �值光吸管品样—2SA ,1SA
植物组织内过氧化物酶(POD)活性的测定

实验七植物组织内过氧化物酶(POD)活性的测定
一、实验目的
掌握植物组织内过氧化物酶活性测定的原理和方法。
二、实验原理
过氧化物酶广泛存在于植物的各个组织器官中。
在有过氧化氢存在的条件下,过氧化物酶可以使愈创木酚氧化,产生茶褐色物质,在470nm处有最大吸收峰,可根据单位时间内A470的变化值,计算POD活性大小。
三、实验材料与设备
1.实验设备与仪器
电子天平、冰冻高速离心机、可见光分光光度计、电动玻璃匀浆剂等。
2.实验材料与试剂
20mM KH2PO4,
100mM PBS:取0.2M Na2HPO4,87.7ml与0.2MNaH2PO4,12.3ml混合。
反应液:取100mM PBS 50ml,加入愈创木酚28μl,搅拌溶解,待溶液冷却后加入30%的H2O219μl,混合均匀保存于冰箱中备用。
四、实验步骤
1.酶液制备
取1.0g植物叶片剪碎,置入玻璃匀浆杯中,加入预冷的20mM KH2PO45ml进行冰浴研磨提取。
匀浆液低温离心8500rpm 15min,上清液为酶粗提液,定容到50ml供测定。
2.酶活性测定
取光程为1cm的玻璃比色杯2只,一只加入反应液3ml,20mMKH2PO41ml作为调零管。
另一只加入反应液3ml,提取的酶液1ml,立即开始计时,在470nm波长处进行比色,开始记录数据,然后每隔一分钟记录一次吸光度值,共测3min。
3.计算
以每分钟A470的化变值0.01为一个相对酶活单位,计算植物组织内过氧化物酶酶活力的大小(单位:U/g鲜重)。
植物生理学-过氧化氢酶的活性的测定
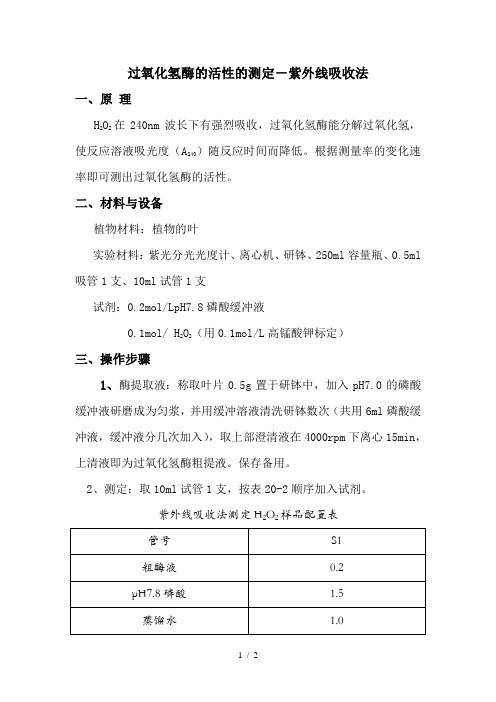
过氧化氢酶的活性的测定-紫外线吸收法一、原理H2O2在240nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低。
根据测量率的变化速率即可测出过氧化氢酶的活性。
二、材料与设备植物材料:植物的叶实验材料:紫光分光光度计、离心机、研钵、250ml容量瓶、0.5ml 吸管1支、10ml试管1支试剂:0.2mol/LpH7.8磷酸缓冲液0.1mol/ H2O2(用0.1mol/L高锰酸钾标定)三、操作步骤1、酶提取液:称取叶片0.5g置于研钵中,加入pH7.0的磷酸缓冲液研磨成为匀浆,并用缓冲溶液清洗研钵数次(共用6ml磷酸缓冲液,缓冲液分几次加入),取上部澄清液在4000rpm下离心15min,上清液即为过氧化氢酶粗提液。
保存备用。
2、测定:取10ml试管1支,按表20-2顺序加入试剂。
紫外线吸收法测定H2O2样品配置表在管中加入0.3ml0.1mol/L的H2O2,加完后立即计时,并迅速倒入石英比色杯中,240nm下测定吸光度,每隔一分钟读数一次,共测三分钟,测完后,按下式计算酶活性。
四、结果计算以1min内减少0.1的酶量为一个酶活单位(u)△A240×V T过氧化氢酶活性(u/gFW/min)=0.1×V×t×FW=0.043×4.6÷0.1÷0.2÷0.3÷3 =10.99五、实验反思1、影响过氧化氢酶活性测定的因素有哪些?过氧化氢酶提取自植物的新鲜叶片中,新叶与旧叶的酶活性存在差异,所以叶片的选择会影响酶活性的测定。
温度的变化也会引起酶活性的测定研磨是否充分,洗涤是否洗干净也会影响。
2、实验测得的吸光度较小(吸光度的起始值较低),酶活性较小,可能是选取的叶片较老,实验中的失误,用滴定管滴定时,滴定的蒸馏水超过了1ml,造成了过氧化氢酶的浓度偏低,用紫外线吸收法测定时造成吸光度值偏低。
过氧化氢酶活力的测定实验报告

过氧化氢酶活力的测定实验报告竭诚为您提供优质文档/双击可除过氧化氢酶活力的测定实验报告篇一:实验35过氧化氢酶的活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使h2o2发生累积。
h2o2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除h2o2,是植物体内重要的酶促防御系统之一。
因此,植物组织中h2o2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】h2o2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被h2so4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与h2o2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/Lh2o2丙酮试剂:取30%分析纯h2o257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(w/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml 刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视h2o2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(完整版)逆境生理指标的测定

逆境生理指标的测定要求:选三个指标一、植物组织中超氧物歧化酶活性的测定催化下列反应: 2 +2H + → H 2O 2 + O 2 反应产物H 2O 2可被过氧化氢酶进一步分解或被过氧化物酶利用。
因此SOD 有保护生物体免受活性氧伤害的能力。
已知此酶活力与植物抗逆性及衰老有密切关系,故成为植物逆境生理学的重要研究对象。
原理本实验依据超氧化物歧化酶抑制氮蓝四唑(NBT )在光下的还原作用来确定酶活性大小。
在有可被氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生 , 可将氮蓝四唑还原为蓝色的化合物,蓝色化合物在560nm 处有最大吸收,而SOD 可清除 从而抑制了蓝色化合物的形成。
因此光还原反应后,反应液蓝色愈深说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
试剂0.05mol/L 磷酸缓冲液(pH7.8);130mmol/L 甲硫氨酸(Met )溶液:称1.9399g Met 用磷酸缓冲液定容至100ml ;750μmol/L 氮蓝四唑溶液:称取0.06133g NBT 用磷酸缓冲液定容至100ml 避光保存; 100μmol/L EDTA-Na 2溶液:取0.03721g EDTA -Na 2用磷酸缓冲液定容至100ml ;20μmol/L 核黄素溶液:取0.00753g 核黄素用磷酸缓冲液定容至1000ml 避光保存(当天配制)。
方法1、酶液提取 取一定部位的植物叶片(视需要定,去叶脉)0.5g 于预冷的研钵中,加1ml 磷酸缓冲液在冰浴下研磨成浆,加缓冲液使终体积为5ml 。
取2~3ml 于10000rpm 下离心10分钟,上清液即为SOD 粗提液。
2、显色反应 取5ml 试管(或指形管,要求透明度好)7支,3支试管为测定管,另4支为对照管,按表1加入各溶液。
混匀后将1支对照管置暗处,其他各管置于4000lx 日光灯下反应20min (要求各管受光情况一致,反应室的温度高时反应时间可以缩短,温度低时反应时间可适当延长(温度范围30~37℃)。
过氧化氢酶活力的测定实验报告doc
过氧化氢酶活力的测定实验报告doc过氧化氢酶活力的测定实验报告篇一:过氧化氢酶活性测定实验29 过氧化氢酶活性测定(高锰酸钾滴定法)过氧化氢酶普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,故常加以测定。
一、原理过氧化氢酶(catalase)属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
可根据H2O2的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的过氧化氢溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的过氧化氢。
即可求出消耗的H2O2的量。
二、材料、仪器设备及试剂(一)材料:小麦叶片(二)仪器设备:1. 研钵;2. 三角瓶;3. 酸式滴定管;4. 恒温水浴;5. 容量瓶。
(三)试剂:1. 10%H2SO4;2. 0.2 mol/L pH7.8磷酸缓冲液;3. 0.1mol/L 高锰酸钾标准液称:取KMnO4(AR)3.1605g,用新煮沸冷却蒸馏水配制成1000ml,再用0.1mol/L 草酸溶液标定;4.0.1mol/L H2O2市售30%H2O2大约等于17.6mol/L,取30%H2O2溶液5.68ml,稀释至1000ml,用标准0.1mol/L KMnO4溶液(在酸性条件下)进行标定;5.0.1mol/L 草酸:称取优级纯H2C2O4.2H2O 12.607g,用蒸馏水溶解后,定容至1000ml。
三、实验步骤(一)酶液提取:取小麦叶片2.5g加入pH7.8的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转至容量瓶中,用同一缓冲液定容,4000rpm离心15min,上清液即为过氧化氢酶的粗提液。
(二)取50ml三角瓶4个(两个测定,另两个为对照),测定瓶加入酶液2.5ml,对照加煮死酶液2.5ml,再加入2.5ml 0.1mol/L H2O2,同时计时,于30℃恒温水浴中保温10min,立即加入10%H2SO42.5ml。
过氧化物酶、过氧化氢酶活性测定方法及试剂配制
过氧化物酶(POD)活性测定【实验原理】过氧化物酶广泛分布于植物的各个组织器官中,在有H202存在条件下,过氧化物酶能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。
【实验试剂】愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L磷酸缓冲液(pH6.0)、反应混合液[100mmol/L 磷酸缓冲液(Ph6.0)50mL,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL,混合均匀保存在冰箱中]【方法步骤】(1)、粗酶液的提取称取小麦叶片0.25g,加20mmol/LKH2PO4 2.5mL,于研钵中研成匀浆,以4000r/min离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)、酶活性的测定取试管3只,于一只中加入反应混合液3mL,KH2PO41mL,作为校零对照,另外三只中加入反应混合液3mL,稀释后的酶液1mL(如表1),立即开启秒表,于分光光度计470nm波长下测量OD值,每隔1min读数一次(4min)。
以每分钟表示酶活性大小,将每分钟OD值增加0.01定义为一个活力单位。
表1 紫外吸收法测定POD酶活性配置表管号S0(对照)S1(实验)S2(实验)反应混合液(ml) 3.0 3.0 3.0KH2PO4 (ml) 1.00.00.0酶液 (ml)0.0 1.0 1.04.结果计算以每分钟吸光度变化值表示酶活性大小,即以ΔA 470 /[min · g (鲜重) ]表示之。
也可以用每min 内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。
POD总活性[u/g(FW)]=FWtV.VA T⨯⨯⨯⨯147001∆式中:POD总活性以酶单位每克鲜重表示。
(完整版)实验35过氧化氢酶的活性测定
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积.H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性.一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定.在一定范围内,其颜色深浅与H2O2浓度呈线性关系.【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水.【方法】1。
制作标准曲线:取10ml离心管7支,顺序编号,并按表40—1加入试剂.待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色.2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35—1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
3.结果计算:植物组织中H2O2含量(μmol/g Fw)=式中 C—标准曲线上查得样品中H2O2浓度(μmol);V t—样品提取液总体积(ml);V1—测定时用样品提取液体积(ml);FW-植物组织鲜重(g)。
过氧化氢酶活性的测定
过氧化氢酶活性的测定过氧化氢酶(catalase)是一种重要的酶类,在多种生物体和植物中广泛存在。
其主要作用是将氧化还原反应中产生的过氧化氢(H2O2)转化成水(H2O)和氧气(O2)。
这个反应是非常重要的,因为H2O2是一种有害物质,会破坏细胞内的蛋白质、脂质和DNA等结构。
因此,过氧化氢酶不仅保护生物体内部结构的完整性,还保护它免受外部环境的伤害。
本文将介绍过氧化氢酶活性的测定方法。
实验材料:1. 1.5 mL离心管;2. 10% 过氧化氢溶液;3. 100 mM 磷酸缓冲液(pH 7.0);4. 视网膜素(1 mg/mL)。
实验步骤:1. 将取自动物或植物的新鲜组织(例如肝脏、叶片、果实)切成小块,加入绞肉机中充分研磨,随后用冷水冲洗,挤出汁液,离心5分钟,去除颗粒,收集上清液作为酶提取物;2. 准备一组试管,分别加入0.1 mL酶提取物、0.5 mL100 mM磷酸缓冲液和0.4 mL 10% 过氧化氢溶液,并加入0.1 mL纯水作为对照试验管;3. 在试管中迅速混合,放在37℃恒温水浴中反应15分钟;4. 反应结束后,加入1 mL苯酚酐试剂,盖上盖子,轻轻颠倒,立即读取吸光度A405,并计算过氧化氢酶活性。
计算过氧化氢酶活性的公式为:过氧化氢酶活性(U/mg)= [(对照A405 - 试验A405)/ 对照A405] × 1000/ [反应体系总反应时间(分钟)÷ 酶提取体积(mL)] × 酶提取物的蛋白质浓度(mg/mL)其中,对照是不加入酶提取物的试验管,试验则是加入酶提取物的试验管。
以对照的A405为100%活性,试验管的活性则为相对活性。
过氧化氢酶的活性单位为U/mg,也可以表示为U/g或U/L。
本实验中,苯酚酐试剂可以与酶提取物中产生的H2O2发生氧化反应,形成深蓝色产物,进而测量吸光度,从而计算出过氧化氢酶的活性。
总之,本实验的目的是测定过氧化氢酶的活性,以此来了解生物体内的氧化还原反应是否正常,并研究它在细胞生物学中的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验40 植物组织中过氧化氢含量及过氧化氢酶活性测定
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定
【原理】
H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
【仪器和用具】
研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】
100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
【方法】
1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min 下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
3.结果计算:
植物组织中H 2O 2含量(μmol/g Fw)=C Vt
FW V ⨯⨯1
式中 C —标准曲线上查得样品中H 2O 2浓度(μmol ); V t —样品提取液总体积(ml ); V 1—测定时用样品提取液体积(ml ); FW —植物组织鲜重(g )。
二、过氧化氢酶的活性测定——高锰酸钾滴定法
【原理】
过氧化氢酶(CA T )属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
22==R(Fe +3+OH -
)
22O 2==R(Fe +2)2+2H 2O+O 2
据此,可根据H 2O 2的消耗量或O 2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的H 2O 2溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的H 2O 2
5H 2O 2+2KMnO 4+4H 2SO 4 5O 2+2KHSO 4+8H 2O+2MnSO 4
即可求出消耗的H 2O 2的量。
【仪器和用具】
研钵;三角瓶50ml ×4;酸式滴定管(10ml );恒温水浴;容量瓶25ml ×1。
【试剂】
10% H 2SO 4;0.2mol/L 磷酸缓冲液pH7.8;
0.1mol/L 高锰酸钾标准液:称取KMnO 4(AR )3.1605g ,用新煮沸冷却蒸馏水配制成1000ml ,用0.1mol/L 草酸溶液标定;
0.1mol/L H 2O 2:市售30% H 2O 2大约等于17.6mol/L ,取30% H 2O 2溶液5.68ml ,稀释至1000ml ,用标准0.1mol/ KMnO 4溶液(在酸性条件下)进行标定;
0.1mol/L 草酸:称取优级纯H 2C 2O 4 ·2H 2O 12.607g ,用蒸馏水溶解后,定容至1L 。
【方法】
1.酶液提取 取小麦叶片
2.5g 加入pH7.8的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml 容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转入容量瓶中,用同一缓冲液定容,4000rpm 离心15min ,上清液即为过氧化氢酶的粗提液。
2.取50ml 三角瓶4个(两个测定两个对照),测定瓶中加入酶液2.5ml ,对照瓶中加入煮死酶液2.5ml ,再加入2.5ml 0.1mol/L H 2O 2,同时计时,于30℃恒温水浴中保温10min ,立即加入10% H 2SO 4 2.5ml 。
3.用0.1mol/L KMn O4标准溶液滴定H 2O 2,至出现粉红色(在30min 内不消失)为终点。
4.结果计算:
-
酶活性用每克鲜重样品1min内分解H2O2的毫克数表示:
酶活(mgH2O2/gFW·min)=().
A B V
FW V t
T
-⨯⨯
⨯⨯
17
1
式中A—对照KMnO4滴定毫升数;
B—酶反应后KMnO4滴定毫升数;
V T—酶液总量(ml);
V1—反应所用酶液量(ml);
W—样品鲜重(g);
1.7—1ml 0.1mol/L的KMnO4相当于1.7mg H2O2。
【注意】
所用KMnO4溶液及H2O2溶液临用前要经过重新标定。
三、过氧化氢酶的活性测定——紫外吸收法
【原理】
H2O2在240nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低。
根据测量吸光率的变化速度即可测出过氧化氢酶的活性。
【仪器与用具】
紫外分光光度计;离心机;研钵;250ml容量瓶1个;0.5ml刻度吸管2支,2ml刻度吸管1支;10ml试管3支;恒温水浴;
【试剂】
0.2mol/L pH7.8磷酸缓冲液(内含1%聚乙烯吡咯烷酮);
0.1mol/L H2O2(用0.1mol/L高锰酸钾标定)。
【方法】
1.酶液提取:称取新鲜小麦叶片或其它植物组织0.5g置研钵中,加入2~3ml 4℃下预冷的pH7.0磷酸缓冲液和少量石英砂研磨成匀浆后,转入25ml容量瓶中,并用缓冲液冲洗研钵数次,合并冲洗液,并定容到刻度。
混合均匀将量瓶置5℃冰箱中静置10min,取上部澄清液在4000rpm下离心15min,上清液即为过氧化氢酶粗提液。
5℃下保存备用。
2.测定:取10ml试管3支,其中2支为样品测定管,1支为空白管,按表40-2顺序加入试剂。
25℃预热后,逐管加入0.3ml 0.1mol/L的H2O2,每加完一管立即记时,并迅速倒入石英比色杯中,240nm下测定吸光度,每隔1min读数1次,共测4min,待3支管全部测定完后,按下式计算酶活性。
3.结果计算:
以1min内A240减少0.1的酶量为1个酶活单位(u)。
过氧化氢酶活性(u/gFW/min)=FW t V .V A T
⨯⨯⨯⨯124010∆
式中 ∆A 240 = A S0-()
A A S S 122+
A S0—加入煮死酶液的对照管吸光值; A S1, A S2—样品管吸光值; Vt —粗酶提取液总体积(ml ); V 1—测定用粗酶液体积(ml ); FW —样品鲜重(g );
0.1—A 240每下降0.1为1个酶活单位(u ); t —加过氧化氢到最后一次读数时间(min )。
【注意事项】
凡在240nm 下有强吸收的物质对本实验有干扰。
【思考题】
1.影响过氧化氢酶活性测定的因素有哪些?
2.过氧化氢酶与哪些生化过程有关?。
