瑞氏-姬姆萨染液使用说明
瑞氏染色操作步骤

瑞氏染色操作步骤瑞氏染色是一种常见的染色技术,用于细胞、组织和生物样本的研究中。
该技术可用于确定细胞形态、染色体数量和形态、染色体变异等。
以下是瑞氏染色的操作步骤:1.样本处理:样本一般采用新鲜的、保存良好的细胞或组织样本。
在处理之前,需要检查样本是否符合要求。
例如,细胞样本应具有充足的数量和活力,组织样本应达到一定的厚度和大小。
此外,需要对样本进行预处理,如固定处理、去除上皮细胞等。
2.制片:制作干片是瑞氏染色的重要步骤。
首先,用无菌的玻片将样本涂抹均匀。
有时还需要使用刮片等工具辅助涂抹。
然后,制片需通过加热、干燥等过程。
这使得细胞或组织与玻片表面相关联,以便在后续染色过程中处理。
3.染色:将制片进行染色是瑞氏染色的核心步骤。
瑞氏染色使用吉姆萨染色(Giemsa stain)或艾因染色(Ehrlich stain)方法。
在吉姆萨染色中,可以使用不同的吉姆萨组合来改变细胞或染色体染色的颜色。
在艾因染色中,使用配制艾因染液进行染色。
两种方法的染色时间和温度也有所不同。
在染色过程中,需要控制好样本的染色时间和温度,以避免染色过度或过轻。
4.显微镜观察:经过染色后,制片需要用显微镜观察。
观察时要准确、认真、耐心、细致。
需要注意的是,显微镜的放大倍数和焦距要调整到合适的位置,以获得清晰的细胞或染色体图像。
5.结果分析:根据显微镜观察得到的图像,可以对样本进行分析和判断。
主要从细胞形态、染色体数量和形态、染色体变异等方面进行评估,并与常模比较,以便对生物样本进行分类、鉴定和研究。
总的来说,瑞氏染色是一种简单、常用的染色技术,适用于细胞、组织和生物样本的研究。
操作过程中需要注意样本处理、制片、染色、显微镜观察和结果分析等关键步骤。
只有仔细、细致地操作,才能获得高质量的实验数据。
瑞氏-姬姆萨染液使用说明

瑞氏-姬姆萨染液编码名称规格单位北京华越洋生物GT79355 瑞氏-姬姆萨染液100ml 瓶瑞氏-姬姆萨染液说明:华越洋瑞氏-姬姆萨染液是一种复合染液,兼有瑞氏和姬姆萨染液二者优点,主要应用于血液和骨髓涂片染色。
各种细胞及细胞的各种成分由于其化学性质不同,对瑞氏-姬姆萨染色液中的酸性染料和碱性染料的亲和力也不同,因此,标本涂片经瑞氏-姬姆萨染色液染色后,相应各类细胞呈现不同的着色,从而达到辨别其形态特征的目的。
姬姆萨染色液对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,着色清晰,色泽纯正,但是对胞核着色偏深,核结构显示较差。
瑞氏染色对细胞核着色程度适中,细胞核结构和色泽清晰艳丽,对核结构的识别较佳,但对胞浆着色较差,故采用瑞氏姬姆萨混合染色,具有染色效果好,对比清晰,操作简便等特点。
瑞氏-姬姆萨染液操作说明:华越洋瑞氏-姬姆萨染液可作为多种组织或细胞的染色使用,不同组织、细胞,不同的用途可以有不同的使用方法。
具体方法请根据自己需求参考既有文献,瑞氏-姬姆萨染液以涂片为例,仅供参考。
1、取涂片、自然干燥。
2、滴加瑞氏-姬姆萨染液2-3 滴覆盖整个标本涂片,染1-2 分钟。
3、滴加等量0.01M磷酸盐缓冲液(pH6.4-6.8),轻轻晃动玻片, 与瑞氏-姬姆萨染色液充分混匀,染色3-5 分钟。
4、水洗、吸干、镜检。
5、染色后胞浆和胞核的染色清晰分明,细胞核着色呈深浅不同的紫红色,胞浆呈浅红色,胞浆中颗粒区分明显。
瑞氏-姬姆萨染液注意事项:1、涂片厚薄适宜,涂片干透后固定,否则细胞在染色过程中容易脱落。
2、所加染液不能过少,以免蒸发而使染料沉淀。
冲洗时间不能过久,以防脱色。
3、染色对pH 十分敏感,稀释染液必须用缓冲液,冲洗用水应接近中性,否则可能会导致细胞染色异常,形态难以识别,甚至错误。
4、染色过淡可以复染,复染时应先加缓冲液,然后加染液。
染色过深可用流水冲洗或浸泡,也可用甲醇脱色。
瑞氏-姬姆萨染液相关染色液:名称规格名称规格中性红染色液(0.33%)500ml结晶紫水溶液(0.1%)100ml中性红染色液(0.5%)500ml核固红染色液(0.1%)100ml中性红染色液(0.1% 常规染色)100ml天狼星红染色试剂盒2*50mLTTC染色液(0.4%)500ml0.5%伊文斯蓝/埃文斯蓝溶液100mLMasson三色染色试剂盒7×50ml茜素红S染色液(1%,pH4.2)100mL普鲁士蓝染色试剂盒2*50ml0.2%核固红染色液100ml尼氏染色液(焦油紫法)2*100ml改良Lillie-Mayer苏木素染色液100ml吕氏碱性美蓝染色液(0.4%)100ml改良Lillie-Mayer苏木素染色液500ml亮绿SF染色液100ml Ehrlich苏木素染色液100ml溴甲酚绿-甲基红指示剂溶液100ml Ehrlich苏木素染色液500ml饱和油红O染色液100ml苏木素伊红混合染色液(一步法)100mlVan Gieson 染色液50ml苏木素伊红混合染色液(一步法)500mlVan Gieson 染色试剂盒3×50ml改良Harris苏木素染色液100mlSchiff试剂50ml改良Harris苏木素染色液500ml茜素红S染色液(0.2%)100ml Mayer苏木素染色液100ml煌焦油蓝染色液100ml Mayer苏木素染色液500ml2% TTC染色液100ml苏木素伊红(HE)染色液2×100ml革兰氏染色液试剂盒4×10ml苏木素伊红(HE)染色液2×500ml醋酸洋红染色液100ml Core苏木素染色液100ml姬姆萨原液100ml Core苏木素染色液500ml姬姆萨工作液100ml Carazzi苏木素染色液100ml瑞氏-姬姆萨复合染液100ml Carazzi苏木素染色液500ml瑞氏染液50ml Delafield苏木素染色液100ml结晶紫染色液(2.5%)10ml Delafield苏木素染色液500ml结晶紫染色液(1%)10ml Gill苏木素染色液(Gill No.1)100ml结晶紫染色液(0.1%)10ml Gill苏木素染色液(Gill No.1)500ml荚膜染色液(试剂盒)50ml×2Gill苏木素染色液(Gill No.2)100ml芽孢染色液(试剂盒)50ml×2Gill苏木素染色液(Gill No.2)500ml鞭毛染色液(试剂盒)100ml Gill苏木素染色液(Gill No.3)100ml石炭酸复红染液(苯酚品红染液)100ml Gill苏木素染色液(Gill No.3)500ml改良型石炭酸复红染液(苯酚品红染液)100ml Heidenhain铁苏木素染色液3×100ml 抗酸染色液(试剂盒)50ml×3天青石蓝苏木素染色液2×50ml 吕氏碱性美蓝染色液(0.1%)100ml改良MacConaill铅苏木素染色液140ml卢戈碘液(革兰氏染色)10ml苏木素无水乙醇溶液(5%)100ml番红染色液(沙黄)10ml苏木素无水乙醇溶液(10%)100ml卢戈碘液(标准碘液)100ml伊红染色液(进口水溶)100ml Mayer'苏木素染液(免疫组化)10ml伊红染色液(进口水溶)500ml HE染色液(试剂盒)3×10ml伊红染色液(水溶)100ml Cole氏苏木素染色液(常规染色)100ml伊红染色液(水溶)500ml Weigert苏木素染色液2×50ml伊红染色液(水溶,5%)100ml AB-PAS染色试剂盒50ml*6伊红染色液(醇溶)100ml糖原PAS染色液(过碘酸-雪夫染色液)50ml×2伊红染色液(醇溶)500ml糖原PAS染色液试剂盒(过碘酸-雪夫染色液)50ml×4Scott蓝化液500ml伊红染色液100ml氨水溶液(0.1%)500ml标准阿利新蓝染色液3×50ml氨水溶液(0.3%)500ml阿利新蓝染色液(pH2.5)100ml氨水溶液(0.5%)500ml阿利新蓝染色液(pH=1.0)(试剂盒)3×50ml氨水溶液(1%)500ml碱性品红乙醇溶液(5%)100ml天青石蓝B染色液50ml碱性品红水溶液(1%)100ml天青石蓝B染色液100ml。
瑞氏染液使用说明

瑞氏染液使用说明货号:G1040规格:50ml/100ml保存:室温避光保存,有效期至少2年。
产品说明:瑞氏染料是由碱性染料美蓝(Methvlem blue)和酸性染料伊红(Eostm Y)组成的复合染料,溶于甲醇。
伊红通常为钠盐,有色部分为阴离子。
美蓝通常为氯盐,有色部分为阳离子。
甲醇的作用:一是溶解美蓝和伊红,使其解离为有色美蓝正离子的和伊红负离子。
后两者可以选择性地吸附于血细胞内的不同成分而使其着色;二是固定细胞形态,加速染色反应,增强染色效果。
使用方法:本产品可作为多种组织或细胞的染色使用,不同组织、细胞,不同的用途可以有不同的使用方法。
具体方法请根据自己需求参考既有文献,本产品以涂片为例,举例说明,仅供参考。
1、取涂片、自然干燥。
2、滴加瑞氏染液染3分钟,使标本被其中甲醇所固定。
3、加等量PH6.4的磷酸盐缓冲液(或等量超纯水)轻轻晃动玻片,与瑞氏染色液混匀,静置5分钟。
4、水洗、吸干、镜检。
5、细菌染成蓝色,组织细胞胞浆红色,细胞核蓝色。
注意事项:1、涂片厚薄适宜,涂片干透后固定,否则细胞在染色过程中容易脱落。
2、所加染液不能过少,以免蒸发而使染料沉淀。
冲洗时间不能过久,以防脱色。
3、染色对pH十分敏感,稀释染液必须用缓冲液,冲洗用水应接近中性,否则可能会导致细胞染色异常,形态难以识别,甚至错误。
4、染色过淡可以复染,复染时应先加缓冲液,然后加染液。
染色过深可用流水冲洗或浸泡,也可用甲醇脱色。
相关试剂:P210010×多聚赖氨酸G1010姬姆萨染色液G1100伊红染色液G1140苏木素染色液(常规染色)G1120H-E染色试剂盒。
瑞氏-姬姆萨复合染色液使用说明
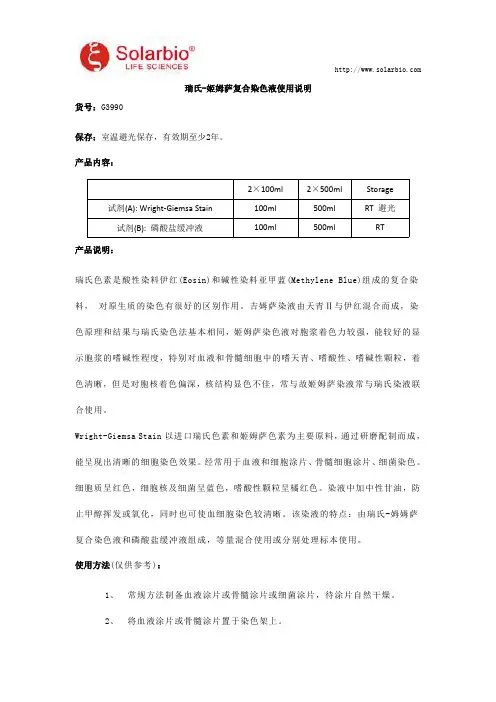
瑞氏-姬姆萨复合染色液使用说明货号:G3990保存:室温避光保存,有效期至少2年。
产品内容:2×100ml2×500ml Storage 试剂(A):Wright-Giemsa Stain100ml500ml RT避光试剂(B):磷酸盐缓冲液100ml500ml RT产品说明:瑞氏色素是酸性染料伊红(Eosin)和碱性染料亚甲蓝(Methylene Blue)组成的复合染料,对原生质的染色有很好的区别作用。
吉姆萨染液由天青Ⅱ与伊红混合而成,染色原理和结果与瑞氏染色法基本相同,姬姆萨染色液对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,特别对血液和骨髓细胞中的嗜天青、嗜酸性、嗜碱性颗粒,着色清晰,但是对胞核着色偏深,核结构显色不佳,常与故姬姆萨染液常与瑞氏染液联合使用。
Wright-Giemsa Stain以进口瑞氏色素和姬姆萨色素为主要原料,通过研磨配制而成,能呈现出清晰的细胞染色效果。
经常用于血液和细胞涂片、骨髓细胞涂片、细菌染色。
细胞质呈红色,细胞核及细菌呈蓝色,嗜酸性颗粒呈橘红色。
染液中加中性甘油,防止甲醇挥发或氧化,同时也可使血细胞染色较清晰。
该染液的特点:由瑞氏-姆姆萨复合染色液和磷酸盐缓冲液组成,等量混合使用或分别处理标本使用。
使用方法(仅供参考):1、常规方法制备血液涂片或骨髓涂片或细菌涂片,待涂片自然干燥。
2、将血液涂片或骨髓涂片置于染色架上。
3、滴加适量Wright-Giemsa Stain覆盖涂片,室温染色1~2min。
4、涂片滴加等量磷酸盐缓冲液,轻轻晃动玻片或采用其他方式混合,使磷酸盐缓冲液不Wright-Giemsa Stain混匀,室温静置3~10min。
5、步骤3、4亦可以采用如下方法:取Wright-Giemsa Stain和磷酸盐缓冲液等量混合,即为Wright-Giemsa工作液,滴加该工作液于血液涂片或骨髓涂片上,室温静置3~10min。
瑞士-染色方法

瑞士-吉姆萨染色液使用方法
磷酸缓冲液1ml,蒸馏水9ml混匀即可使用。
工作液一般临时配置。
1:玻片上血膜下面过酒精灯几次干透后,加染色液2-3滴覆盖全膜;
2:约30-120秒钟,滴加缓冲液(染液与缓冲液的比例,血片为1:1.5);
3:混匀后染色3-5分钟;
4:自来水冲洗数秒钟,静置待玻片干后滴香柏油镜检。
检查标准:
淋巴母细胞的形态:胞体比正常细胞大3~4倍,呈圆形或椭圆形,胞浆常有伪足突出,染色淡蓝,常有空泡,泡核增大,核质疏松,常呈细丝网状结构,可见核分裂现象;过渡型淋巴细胞的形态:介于上述母细胞与正常淋巴细胞之间,体积稍大,多在12~15μm,胞浆稍多,淡蓝色,核大于正常细胞,核质疏松。
注意和正常淋巴细胞的区别:淋巴细胞呈球形,平均直径10μm。
小淋巴细胞核大,呈圆形或卵圆形,有时核的一侧有缺陷,呈豆形,染色质粗大,细胞质很少,嗜碱性,核周围的细胞质常有淡染晕。
试验数据处理淋巴细胞的转化率以百分率计算,即:
转化率=活化细胞数/(活化细胞数+未转化细胞数)×100%。
瑞氏吉姆萨染色步骤

瑞氏吉姆萨染色步骤瑞氏吉姆萨染色是一种常用的细胞染色技术,它能使细胞的形态、结构和功能等方面的信息得到更加清晰的展现。
下面将介绍瑞氏吉姆萨染色的步骤。
一、制备细胞涂片首先需要制备细胞涂片,即取一定数量的细胞,将其分布均匀地涂在载玻片上。
制备细胞涂片时需要注意,要使细胞分布均匀,不要有过多的交叉和重叠现象。
二、固定细胞细胞涂片制备好后,需要进行固定。
固定的目的是防止细胞在染色过程中失去其原有形态和结构。
固定液可以用4%的乙醛或乙醇,也可以用甲醛进行固定。
三、染色在固定液起作用后,需要进行染色,这是瑞氏吉姆萨染色的核心步骤。
染色液的配方为:甲基绿、甲基红和亚甲蓝各1克,乙酸1毫升,蒸馏水100毫升。
将染色液滴在细胞涂片上,静置10-15分钟。
四、洗涤染色液静置后,需要用蒸馏水进行洗涤。
洗涤的目的是去除多余的染料和固定液。
五、脱水洗涤完成后,需要将细胞涂片进行脱水。
脱水的目的是使细胞涂片逐渐失去水分,加强细胞涂片的硬度和稳定性。
脱水可以用70%、80%、95%和绝对酒精进行,每种酒精浸泡时间为2-3分钟。
六、透明化脱水后,需要进行透明化处理。
透明化的目的是使细胞涂片变得透明,方便观察和保存。
透明化液可以用苯酚、苯酚-氯酸-甘油溶液等。
七、封片透明化完成后,需要进行封片,即用封片胶封住细胞涂片。
封片胶可以用环氧树脂或丙烯酰胶进行。
总结瑞氏吉姆萨染色是一种常用的细胞染色技术,能够使细胞形态、结构和功能等信息得到更加清晰的展现。
其步骤包括制备细胞涂片、固定细胞、染色、洗涤、脱水、透明化和封片。
不同的步骤需要注意不同的细节,只有每个步骤都严格按照要求操作,才能得到满意的染色结果。
姬姆萨染色液(10×Giemsastain)说明书
姬姆萨染色液(10×Giemsastain)说明书
本产品仅供体外研究使用,不得用于临床诊断
产品简介:
血液和细胞涂片、细菌、染色体显带、原生动物寄生虫等染色细胞核呈紫红色或蓝紫色,胞浆呈粉红色。
含10×磷酸盐缓冲液,1:1:8稀释后使用,但磷酸盐缓冲液稀释后即配即用,不易保存。
姬姆萨色素(又称吉姆萨色素)是由天青Ⅱ与伊红混合而成,Giemsa染色原理和结果与瑞氏染色基本相同,姬姆萨染色液对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,特别是对血液和骨髓细胞中的嗜天青、嗜酸性、嗜碱性颗粒,着色清晰,但是对胞核着色偏深,核结构显色不佳,故姬姆萨染液常与瑞氏染液联合使用。
Giemsa Stain以进口的姬姆萨色素、甲醇为主要原料,含特有衬染剂,经研磨配制而成,能呈现出清晰的细胞染色效果,
经常用于组织切片、血液和细胞涂片、细菌、染色体显带、原生动物寄生虫等染色。
嗜酸性颗粒为碱性蛋白质,与酸性染料伊红结合,染粉红色,称为嗜酸性物质;细胞核蛋白和淋巴细胞胞浆为酸性,与碱性染料美蓝或天青结合,染紫蓝色,称为嗜碱性物质;中性颗粒呈等电状态与伊红和美蓝均可结合,染淡紫色,称为中性物质。
瑞氏-吉姆萨染液配法
英文拼写 Wright's stain是由酸性染料伊红和碱性染料美蓝组成的复合染料,溶于甲醇。
后解离为带正电的美蓝和带负电的伊红离子。
使用方法瑞氏(Wright's staim;美蓝-伊红Y)染色:1.瑞氏染料是由碱性染料美蓝(Methvlem blue)和酸性染料黄色伊红(Eostm Y)合称伊红美蓝染料即瑞氏(美蓝-伊红Y)染料。
2.用甲醇作瑞氏染料溶剂,即成瑞氏染液。
甲醇是瑞氏染料良好溶剂,有两种作用:(1)甲醇使瑞氏染料中美蓝(M)与伊红(E)在溶液中离解,可使细胞成分选择性吸附其中的有色物质而着色。
甲醇ME(瑞氏染料)----→M+ + E-在配制的瑞氏染液中美蓝如放置过久即可氧化而含有天青,美蓝天青与伊红化合物能使核染成紫红色,但不能使胞浆染为蓝色,多余美蓝就可以使胞浆染成蓝色,染色主要是化学作用,是离子彼此结合的反应。
(2)甲醇具有强大的脱水力,可将细胞固定在一定形态及增加细胞结构的表面积,提高细胞对染料吸收作用,同时由于甲醇吸附染色液中的水,使染色液升温,加速染色反应。
染液配制(1) 瑞氏染液配制:瑞氏染料 830gm或1g甲醇(AR)500ml或600ml○先称干燥(事先放入温箱干燥过夜)瑞氏染料放置乳钵内,用乳棒轻轻敲碎染料成粉末,再行研磨至听不到研芝麻声即呈细粉末,加少许甘油或甲醇溶解研磨,使染料在乳缸内显“一面镜”光泽,而无染料粉粒沉着。
○再加较多量甲醇研磨呈一面镜光亮,静置片刻,将上层液体倒入一清洁储存瓶内(最好用甲醇空瓶),再加甲醇研磨,重复数次,至乳钵内染料及甲醇用完为止,摇匀,密封瓶口。
○存室温暗处,储存愈久,则染料溶解、分解就越好,一般储存3个月以上为佳。
(2) 缓冲液:●缓冲液作用:○染色对氢离子浓度是十分敏感的,据观察pH值的改变,可使蛋白质与染料形成的化合物重新离解。
○缓冲液须保持一定的pH使染色稳定,PBS的pH 一般在6.4~6.8,○偏碱性染料可与缓冲液中酸基起中和作用,偏酸性染料则与缓冲液中的碱基起中和作用,使pH恒定。
姬姆萨染液使用说明书
PBS 前片子不要干,否则沉渣很多,导致染色不均;
3 染色:具体染色时间视细胞而定,一般 3~30min,染色时最好在镜下观察;
4 水洗:冲片时注意控制水流,太小会有细小的染液渣子附着,太大则有可能加重脱片。染
过片子也还可以修饰弥补。如果染色过浅,可复染;过深可用乙醇瞬时脱色。
5 镜检:显微镜下观察。
姬姆萨染液
500mL
说明书
1份
1
染料美蓝或天青结合,染紫蓝色;中性颗粒呈等电状态与伊红和美蓝均可结合,染淡紫色。
pH 对细胞染色有影响。细胞各种成分均含蛋白质,由于蛋白质系两性电解质,所带电
荷随溶液 pH 而定,在偏酸性环境中正电荷增多,易与伊红结合,染色偏红;在偏碱性环境
中负电荷增多,易与天青结合,染色偏蓝。因此细胞染色对氢离子浓度十分敏感,染色用载
结果
细胞核被染成紫红色或紫蓝色,而细胞质则被染成浅红色。
注意事项
1. 染色工作液宜现用现配,旧染液染色效果不佳。工作液保存时间不宜超过 48h;
பைடு நூலகம்
2. 姬姆萨对 pH 极敏感,因此,PBS 的 pH 要准确,否则染色效果不佳。如用染色缸进行染
色时,随染色时间的延长,在染液表面常形成一层氧化膜(发亮)易附着在玻片上形成污秽,
杭州昊鑫生物科技股份有限公司
htpp://
姬姆萨染液
姬姆萨染液(Giemsa Staining Solution)
姬姆萨染液由天青,伊红组成。染色原理和结果与瑞氏染色法基本相同。嗜酸性颗粒为
碱性蛋白质,与酸性染料伊红结合,染粉红色;细胞核蛋白和淋巴细胞胞浆为酸性,与碱性
且不易除掉,尤其用的不是现配试剂时,更易于形成氧化膜。染色前应先用小片滤纸刮除液
吉姆萨染液—病理切片常用染色方法
当疾病侵入人体,会引起相应病灶部位的病理性改变,对于相应病灶部位的观察经大量应用于临床工作及科学研究。
20世纪90年代病理检查进入组化、免疫组化、分子生物学及癌基因检查。
随着自然科学的迅速发展,新仪器设备和技术应用到医学中来,超微结构病理、分子病理学、免疫病理学、遗传病理学等方法也都应用到病理检查中。
癌细胞活体切片图为探讨器官、组织或细胞所发生的疾病过程,可采用某种病理形态学检查的方法,检查他们所发生的病变,探讨病变产生的原因、发病机理、病变的发生发展过程,最后做出病理诊断。
今天我们要介绍的产品,就是在病理学以及疾病研究中常用的染色剂——吉姆萨染液。
(abs47047618)吉姆萨染液别名姬姆萨染色液,吉姆萨染色液,姬姆萨染原液。
为天青色素、伊红、次甲蓝的混合物,本染色液最适于血液涂抹标本、血球、疟原虫、立克次体以及骨髓细胞、脊髓细胞等的染色。
染前用蛋白酶等进行处理,然后再用姬姆萨染液染色,在染色体上,可以出现不同浓淡的横纹样着色。
姬姆萨染液可将细胞核染成紫红色或蓝紫色,胞浆染成粉红色,在光镜下呈现出清晰的细胞及染色体图像。
吉姆萨染色图吉姆萨染色原理及结果与瑞氏染色基本相同,从图中可以看出,吉姆萨染色液(Giemsa stain)对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,特别是对血液和骨髓细胞中的嗜天青、嗜酸性、嗜碱性颗粒,着色清晰,但是对胞核着色偏深,核结构显色不佳,故吉姆萨染色常与瑞氏染色联合使用。
嗜酸性颗粒为碱性蛋白质,与酸性染料伊红结合,染粉红色,称为嗜酸性物质;细胞核蛋白和淋巴细胞胞浆为酸性,与碱性染料美蓝或天青结合,染紫蓝色,称为嗜碱性物质;中性颗粒呈等电状态与伊红和美蓝均可结合,染淡紫色,称为中性物质。
在使用时,pH对细胞染色有影响。
细胞各种成分均含蛋白质,由于蛋白质系两性电解质,所带电荷随溶液pH而定,在偏酸性环境中正电荷增多,易与伊红结合,染色偏红;在偏碱性环境中负电荷增多,易与天青结合,染色偏蓝。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
瑞氏-姬姆萨染液使用说明
货号:G1020
规格:100ml/500ml
保存:室温避光保存,有效期至少2年。
产品说明:
瑞氏-姬姆萨染液是一种复合染液,兼有瑞氏和姬姆萨染液二者优点,主要应用于血液和骨髓涂片染色。
各种细胞及细胞的各种成分由于其化学性质不同,对瑞氏-姬姆萨染色液中的酸性染料和碱性染料的亲和力也不同,因此,标本涂片经瑞氏-姬姆萨染色液染色后,相应各类细胞呈现不同的着色,从而达到辨别其形态特征的目的。
姬姆萨染色液对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,着色清晰,色泽纯正,但是对胞核着色偏深,核结构显示较差。
瑞氏染色对细胞核着色程度适中,细胞核结构和色泽清晰艳丽,对核结构的识别较佳,但对胞浆着色较差,故采用瑞氏姬姆萨混合染色,具有染色效果好,对比清晰,操作简便等特点。
使用方法:
本产品可作为多种组织或细胞的染色使用,不同组织、细胞,不同的用途可以有不同的使用方法。
具体方法请根据自己需求参考既有文献,本产品以涂片为例,举例说明,仅供参考。
1、取涂片、自然干燥。
2、滴加瑞氏-姬姆萨染液2-3滴覆盖整个标本涂片,染1-2分钟。
3、滴加等量PH6.4的磷酸盐缓冲液(或等量超纯水),轻轻晃动玻片,
与瑞氏-姬姆萨染色液充分混匀,染色3-5分钟。
4、水洗、吸干、镜检。
5、染色后胞浆和胞核的染色清晰分明,细胞核着色呈深浅不同的紫红色,胞浆呈浅红色,胞浆中颗粒区分明显。
注意事项:
1、涂片厚薄适宜,涂片干透后固定,否则细胞在染色过程中容易脱落。
2、所加染液不能过少,以免蒸发而使染料沉淀。
冲洗时间不能过久,以防脱色。
3、染色对pH十分敏感,稀释染液必须用缓冲液,冲洗用水应接近中性,否则可能会导致细胞染色异常,形态难以识别,甚至错误。
4、染色过淡可以复染,复染时应先加缓冲液,然后加染液。
染色过深可用流水冲洗或浸泡,也可用甲醇脱色。
相关试剂:
P210010×多聚赖氨酸
G1010姬姆萨染色液
G1040瑞氏染液
G1100伊红染色液
G1140苏木素染色液(常规染色。
