氯气的理化性质(标准版)
氯气的性质

方向进行,同时又可以向逆反应方向进行。
“氯水” 分子:Cl2 、 H2O、HClO; 的微粒 离子:H+、Cl–、ClO–(OH–)
光照
2HClO 或△ 2HCl+O2↑
思考
氯气和水反应生成HCl和HClO,试分析 氯气和氢氧化钠、氢氧化钙溶液反应的产物。
1.请写出Cl2和NaOH溶液反应的化学方程式:
铁在氯气 中燃烧
剧烈燃烧,产 生大量白烟
剧烈燃烧,产生 棕褐色烟
点燃
2Na+ Cl2 2NaCl 2Fe + 3Cl2点燃2FeCl3
铜在氯气
剧烈燃烧,产生 棕黄色的烟
中燃烧
点燃 Cu + Cl2 CuCl2
氯气的化学性质很活泼,可与大多数金属在点 燃或加热的条件下直接化合,而且生成高价态 金属氯化物。
Cl2+2NaOH
NaCl+NaClO+H2O
2.请写出Cl2和石灰乳反应的化学方程式:
2Cl2+2Ca(OH)2
CaCl2+Ca(ClO)2+2H2O
【其有效成分是Ca(ClO)2 】漂白粉
为什么漂白粉可以用来漂白?结合有关次氯酸 的知识, 试解释漂白粉作用原理。
Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO
二、氯气可以和许多安静燃烧,发出苍白色火焰,瓶口出现 白雾
实验结论:
点燃
H2+Cl2
2HCl
1、与H2混合光照
实验现象:
发生爆炸,产生白雾。
实验结论:
光照
H2+Cl2
2HCl
思考:H2与Cl2 在点燃和光照的条件下 都能反应生成HCl,那么在工业制盐酸采 用什么条件?(点燃还是光照)
《氯气的性质及用途》 讲义

《氯气的性质及用途》讲义一、氯气的物理性质氯气是一种黄绿色、有强烈刺激性气味的气体。
在通常情况下,氯气的密度比空气大,这意味着在相同的条件下,氯气会相对下沉。
氯气易液化,在低温和加压的条件下,氯气可以转化为液态。
液态氯是一种透明的、浅黄色的液体。
氯气能溶于水,但溶解度不是特别大。
在常温常压下,1 体积的水大约能溶解2 体积的氯气。
溶解在水中的氯气一部分会与水发生反应。
二、氯气的化学性质1、与金属的反应氯气具有很强的氧化性,能够与许多金属发生反应。
例如,钠在氯气中燃烧时,会发出黄色的火焰,生成白色的氯化钠固体。
2Fe + 3Cl₂= 2FeCl₃(铁与氯气反应生成氯化铁)Cu + Cl₂= CuCl₂(铜与氯气反应生成氯化铜)2、与非金属的反应氯气也能与一些非金属单质发生反应。
比如氢气在氯气中燃烧,会产生苍白色的火焰,生成氯化氢气体。
H₂+ Cl₂= 2HCl3、与水的反应氯气能与水发生可逆反应,生成盐酸和次氯酸。
Cl₂+ H₂O ⇌ HCl + HClO次氯酸具有强氧化性,能够杀菌消毒,也是漂白剂的有效成分。
但次氯酸不稳定,在光照条件下容易分解。
2HClO = 2HCl + O₂↑4、与碱的反应氯气能与碱溶液发生反应。
Cl₂+ 2NaOH = NaCl + NaClO + H₂O (此反应常用于实验室吸收多余的氯气)2Cl₂+ 2Ca(OH)₂= CaCl₂+ Ca(ClO)₂+ 2H₂O (工业上用此反应制取漂白粉)三、氯气的用途1、消毒杀菌由于氯气与水反应生成的次氯酸具有强氧化性,能够杀灭细菌和病毒,所以氯气常用于自来水的消毒。
但在使用时需要严格控制用量,以确保水中残留的氯气不会对人体健康造成危害。
2、制造氯化物氯气是制造许多氯化物的重要原料,如氯化氢、氯化铁、氯化铜等。
这些氯化物在化工、冶金、医药等领域都有广泛的应用。
3、制造有机化合物氯气可以参与许多有机化学反应,用于制造农药、塑料、橡胶等有机化合物。
氯气的理化性质和危险特性
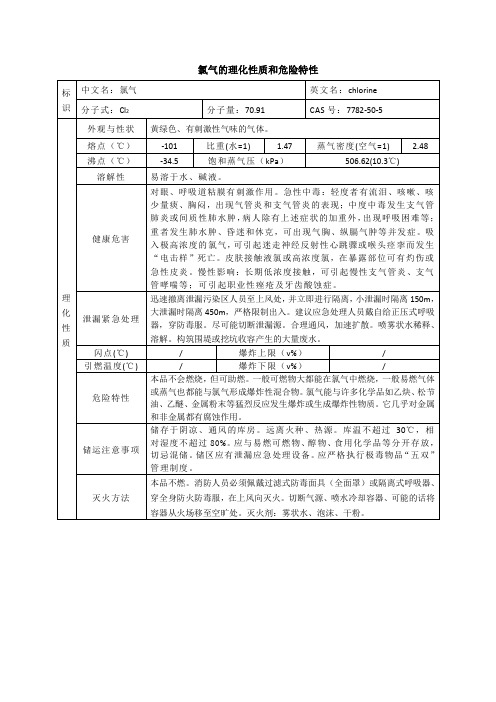
易溶于水、碱液。
健康危害
对眼、呼吸道粘膜有刺激作用。急性中毒:轻度者有流泪、咳嗽、咳少量痰、胸闷,出现气管炎和支气管炎的表现;中度中毒发生支气管肺炎或间质性肺水肿,病人除有上述症状的加重外,出现呼吸困难等;重者发生肺水肿、昏迷和休克,可出现气胸、纵膈气肿等并发症。吸入极高浓度的氯气,可引起迷走神经反射性心跳骤或喉头痉挛而发生“电击样”死亡。皮肤接触液氯或高浓度氯,在暴露部位可有灼伤或急性皮炎。慢性影响:长期低浓度接触,可引起慢性支气管炎、支气管哮喘等;可引起职业性痤疮及牙齿酸蚀症。
泄漏紧急处理
迅速撤离泄漏污染区人员至上风处,并立即进行隔离,小泄漏时隔离150m,大泄漏时隔离450m,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿防毒服。尽可能切断泄漏源。合理通风,加速扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生的大量废水。
闪点(℃)
/
爆炸上限(v%)
/
引燃温度(℃)
氯气的理化性质和危险特性
标识
中文名:氯气
英文名:chlorine
分子式:Cl2
分子量:70.91
CAS号:7782-50-5
理化性质
外观与性状
黄绿色、有刺激性气味的气体。
熔点(℃)
-101
比重(水=1)
1.47
蒸气密度(空气=1)
2.48
沸点(℃)
-34.5
饱和蒸气压(kPa)
506.62(10.3℃)/Βιβλιοθήκη 爆炸下限(v%)/
危险特性
本品不会燃烧,但可助燃。一般可燃物大都能在氯气中燃烧,一般易燃气体或蒸气也都能与氯气形成爆炸性混合物。氯气能与许多化学品如乙炔、松节油、乙醚、金属粉末等猛烈反应发生爆炸或生成爆炸性物质。它几乎对金属和非金属都有腐蚀作用。
氯气的物理化学性质

氯气的物理化学性质氯气,化学式为Cl₂。
常温常压下为黄绿色气体,有强烈刺激性气味的有毒气体,密度比空气大,可溶于水,易压缩经压缩可液化为金黄色液态氯,是氯碱工业的主要产品之一,用作强氧化剂与氯化剂。
下面店铺给你分享氯气的物理化学性质,欢迎阅读。
氯气的物理性质状态通常情况下为有强烈刺激性气味的黄绿色的有毒气体。
密度氯气密度是空气密度的2.5倍,标况下ρ=3.21kg/m³。
易液化熔沸点较低,常温常压下,熔点为-101.00℃,沸点-34.05℃,常温下把氯气加压至600~700kPa或在常压下冷却到-34℃都可以使其变成液氯,液氯即Cl₂,液氯是一种油状的液体,其与氯气物理性质不同,但化学性质基本相同。
溶解性可溶于水,且易溶于有机溶剂(例如:四氯化碳),难溶于饱和食盐水。
1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为 3.170g/L,比空气密度大。
结构原子结构:氯原子最外层有7个电子,反应中易得到1个电子或共用一个电子对达到稳定结构(共价键)分子结构:氯分子为双原子分子,分子式Cl₂。
离子结构:氯离子最外层有8个电子,因而很稳定。
氯气的化学性质毒性氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成损伤:次氯酸使组织受到强烈的氧化;盐酸刺激黏膜发生炎性肿胀,使呼吸道黏膜浮肿,大量分泌黏液,造成呼吸困难,所以氯气中毒的明显症状是发生剧烈的咳嗽。
症状重时,会发生肺水肿,使循环作用困难而致死亡。
由食道进入人体的氯气会使人恶心、呕吐、胸口疼痛和腹泻。
1L空气中最多可允许含氯气0.001mg,超过这个量就会引起人体中毒。
金属1、金属钠在氯气中燃烧生成氯化钠。
现象:钠在氯气里剧烈燃烧,产生大量的白烟,放热。
2、铜在足量氯气中燃烧生成氯化铜。
现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色(绿色较明显),加足量水后,溶液完全显蓝色。
《氯气的性质及用途》 知识清单

《氯气的性质及用途》知识清单一、氯气的物理性质氯气是一种黄绿色、有强烈刺激性气味的气体。
在常温常压下,氯气的密度比空气大。
它能溶于水,在常温下,1 体积的水大约能溶解 2 体积的氯气。
氯气的熔点和沸点都比较低,在加压或降温的条件下,氯气可以转变为液态(称为液氯)或固态。
二、氯气的化学性质1、与金属的反应氯气具有很强的氧化性,能与大多数金属发生反应。
例如,钠在氯气中燃烧,产生黄色的火焰,生成白色的氯化钠固体:2Na + Cl₂=2NaCl ;铁在氯气中燃烧,产生棕褐色的烟,生成氯化铁:2Fe +3Cl₂= 2FeCl₃;铜在氯气中燃烧,产生棕黄色的烟,生成氯化铜:Cu + Cl₂= CuCl₂。
2、与非金属的反应氯气也能与许多非金属单质发生反应。
例如,氢气在氯气中安静地燃烧,发出苍白色火焰,生成氯化氢气体:H₂+ Cl₂= 2HCl 。
当氢气和氯气混合后在光照条件下会发生爆炸。
3、与水的反应氯气能溶于水,并与水发生反应,生成盐酸和次氯酸:Cl₂+H₂O ⇌ HCl + HClO 。
次氯酸具有强氧化性,能杀菌消毒和漂白。
4、与碱的反应氯气能与碱溶液发生反应。
例如,氯气与氢氧化钠溶液反应,生成氯化钠、次氯酸钠和水:Cl₂+ 2NaOH = NaCl + NaClO + H₂O 。
这个反应常用于制取漂白液。
5、与还原性物质的反应氯气可以与具有还原性的物质发生反应,如二氧化硫、硫化氢等。
三、氯气的用途1、用于消毒由于氯气与水反应生成的次氯酸具有强氧化性,能够杀菌消毒,所以氯气常用于自来水的消毒。
2、制造盐酸氢气在氯气中燃烧生成氯化氢,氯化氢溶于水得到盐酸。
3、制造漂白剂氯气与碱反应生成的次氯酸盐具有漂白性,可用于制造漂白粉、漂白液等漂白剂。
4、用于工业合成氯气是许多有机和无机化合物合成的重要原料,例如用于制造聚氯乙烯(PVC)等塑料。
5、用于冶金在冶金工业中,氯气常用于提取某些金属,如金、铂等。
四、氯气的制取实验室制取氯气通常使用二氧化锰和浓盐酸在加热的条件下反应:MnO₂+ 4HCl(浓)= MnCl₂+ Cl₂↑ + 2H₂O 。
2、氯气的性质

三、氯气的用途 1、制氯化物。 制氯化物。 2、制漂白剂:氯水、漂白粉、二氧 制漂白剂:氯水、漂白粉、 化氯 3、冶炼金属 4、制药物、染料 制药物、 5、制塑料:聚氯乙烯、氯丁橡胶 制塑料:聚氯乙烯、
二、氯气的性质 物理性质: 物理性质: 在通常情况下,氯气是一种黄绿色、 在通常情况下,氯气是一种黄绿色、 有刺激性气味的有毒气体; 体积水约能 有刺激性气味的有毒气体;1体积水约能 溶解2体积 体积Cl 但难溶于饱和食盐水。 溶解 体积 2;但难溶于饱和食盐水。 化学性质: 化学性质: 氯气是一种化学性质很活泼的非金 属单质, 属单质,能与多种金属和非金属直接化 也能与其它很多物质直接反应。 合;也能与其它很多物质直接反应。
1、与金属反应 、
点燃
Cl2+2Na==2NaCl 3Cl2+2Al==2AlCl3 3Cl2+2Fe==2FeCl3 (在气体中反应只生成FeCl3 在气体中反应只生成 常温下干燥Cl 不与铁反应) 常温下干燥 与铁反应)
点燃 点燃 点燃
Cl2+Cu==CuCl2
2、与非金属反应 、 Cl2+H2==2HCl (常温不反应;点燃H2可在 2中燃 常温不反应;点燃 可在Cl 烧;将H2与Cl2混合点燃或强光照射 会发生爆炸) 会发生爆炸) 生成的HCl溶于水即得盐酸。 溶于水即得盐酸。 生成的 溶于水即得盐酸
4、与碱反应 、 Cl2+2NaOH==NaCl+NaClO+H2O (用于实验中尾气的吸收) 用于实验中尾气的吸收) 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (工业上制取漂白粉) 工业上制取漂白粉) 漂白粉的主要成分为: 漂白粉的主要成分为: CaCl2和Ca(ClO)2 有效成分为: 有效成分为:Ca(ClO)2
氯气Chlorine的理化性质

氯气C h l o r i n e的理化性质集团公司文件内部编码:(TTT-UUTT-MMYB-URTTY-ITTLTY-氯气(C h l o r i n e)的理化性质本品为无色无臭气体,化学性质不活泼,不燃,常温下和锂能直接反应,炽热时与镁、钙、锶、钡、氧和氢直接化合,微溶于水、乙醇。
本品用于合成氨,制硝酸、氰化物、炸药等,作为惰性气体可用于填充灯泡和高温计。
也用作物质保护剂、冷冻剂。
对人体的危害本品侵入人体的途径为吸入。
空气中氮气含量过高,使吸入氧气分压下降,引起缺氧窒息。
吸入氮气浓度不太高时,患者最初感胸闷、气短、疲软无力;继而有烦躁不安、极度兴奋、乱跑、叫喊、神情恍惚、步态不稳,称之为“氮酩酊”,可进入昏睡或昏迷状态。
吸入高浓度,患者可迅速昏迷、因呼吸和心跳停止而死亡。
潜水员深潜时,可发生氮的麻醉作用;若从高压环境下过快转入常压环境,体内会形成氮气气泡,压迫神经、血管或造成微血管阻塞,发生“减压病”。
急救措施吸入本品后,迅速脱离现场至空气新鲜处。
保持呼吸道通畅,如呼吸困难,给输氧。
如呼吸心跳停止,立即进行人工呼吸和胸外心脏按压术。
就医。
防护措施本品生产过程密闭操作,提供良好的自然通风条件。
呼吸系统防护:一般不需特殊防护。
当作业场所空气中氧气浓度低于18%时,必须佩戴空气呼吸器、氧气呼吸器或长管面具。
眼睛防护:一般不需特殊防护。
身体防护:穿一般作业工作服。
手防护:戴一般作业防护手套。
其他防护:避免高浓度吸入。
进入罐、限制性空间或其他高浓度区作业,须有人监护。
消防措施本品一般储存于高压容器内,若遇高热,容器内压增大,有开裂和爆炸的危险。
灭火方法为,本品不燃,要尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
泄漏应急处理迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿一般企业管理工作服。
尽可能切断泄漏源。
合理通风,加速扩散。
漏气容器妥善处理,修复、检验后再用。
氯气的性质

氯气的性质
1.氯气的物理性质
颜色气味密度特性
黄绿色刺激性气味比空气大易液化
注意实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
(如图所示)
2.氯气的化学性质
(1)氧化性
原子结构:
类别:Cl2是活泼的非金属单质,能氧化许多金属、非金属以及一些具有还原性的物质。
(2)从化合价的角度认识Cl2的化学性质——歧化反应
氯气与水或碱反应,氯元素的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
3.从平衡的角度理解氯水的成分和性质
氯气能溶于水(1∶2),氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应。
(1)氯水中存在三种平衡关系:
①Cl2+H2O HCl+HClO
②HClO H++ClO-
③H2O H++OH-
(2)氯水性质的多重性
新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
注:氯水常代替氯气进行溶液中的实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯气的理化性质(标准版)
Safety management is an important part of production management. Safety and production are in
the implementation process
( 安全管理 )
单位:_________________________
姓名:_________________________
日期:_________________________
精品文档 / Word文档 / 文字可改
氯气的理化性质(标准版)
本品为无色无臭气体,化学性质不活泼,不燃,常温下和锂能直接反应,炽热时与镁、钙、锶、钡、氧和氢直接化合,微溶于水、乙醇。
本品用于合成氨,制硝酸、氰化物、炸药等,作为惰性气体可用于填充灯泡和高温计。
也用作物质保护剂、冷冻剂。
对人体的危害
本品侵入人体的途径为吸入。
空气中氮气含量过高,使吸入氧气分压下降,引起缺氧窒息。
吸入氮气浓度不太高时,患者最初感胸闷、气短、疲软无力;继而有烦躁不安、极度兴奋、乱跑、叫喊、神情恍惚、步态不稳,称之为“氮酩酊”,可进入昏睡或昏迷状态。
吸入高浓度,患者可迅速昏迷、因呼吸和心跳停止而死亡。
潜水员深潜时,可发生氮的麻醉作用;若从高压环境下过快转入常压环境,体内会形成氮气气泡,压迫神经、血管或造成微血管阻塞,发生“减压病”。
急救措施
吸入本品后,迅速脱离现场至空气新鲜处。
保持呼吸道通畅,如呼吸困难,给输氧。
如呼吸心跳停止,立即进行人工呼吸和胸外心脏按压术。
就医。
防护措施
本品生产过程密闭操作,提供良好的自然通风条件。
呼吸系统防护:一般不需特殊防护。
当作业场所空气中氧气浓度低于18%时,必须佩戴空气呼吸器、氧气呼吸器或长管面具。
眼睛防护:一般不需特殊防护。
身体防护:穿一般作业工作服。
手防护:戴一般作业防护手套。
其他防护:避免高浓度吸入。
进入罐、限制性空间或其他高浓度区作业,须有人监护。
消防措施
本品一般储存于高压容器内,若遇高热,容器内压增大,有开裂和爆炸的危险。
灭火方法为,本品不燃,要尽可能将容器从火场
移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
泄漏应急处理
迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿一般企业管理工作服。
尽可能切断泄漏源。
合理通风,加速扩散。
漏气容器妥善处理,修复、检验后再用。
储运措施
本品储存于阴凉、通风的库房。
远离火种、热源。
防止日光直晒及雨淋水湿。
库温不宜超过30℃。
储区应备有泄漏应急处理设备。
本品采用钢瓶运输时必须戴好钢瓶上的安全帽。
钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护拦板,并用三角木垫卡牢,防止滚动。
严禁与易燃物或可燃物等混装混运。
夏季应早晚运输,防止日光曝晒。
铁路运输时要禁止溜放。
包装:钢瓶内贮存,瓶外漆成黑色,用黄色标明“氮气”。
钢瓶阀门应罩安全帽,瓶身应有防震胶圈。
养护
1.入库验收:核对品名,检查钢瓶有效期限钢印,检查阀门是否漏气。
2.堆码苫垫:用专用木架直立设置,平放时阀门在同一方向,垛底高10厘米至15厘米,堆码1层至4层,垛距80厘米,墙距、柱距40厘米。
3.在库检查:每日交接班各检查一次,每季度检查一次并称重。
4.温湿度管理:库温度不超过30℃。
5.安全作业:钢瓶不得摔、震、撞击或在地面滚动。
6.保管期限:1年。
云博创意设计
MzYunBo Creative Design Co., Ltd.。
